Les fondamentaux – Chapitre 10 – Traitement de l’image reconstruite
A. Blum
Plan du chapitre
- Introduction
- Reconstructions d’acquisitions volumiques
- Recalage, soustraction, fusion
- Réalité augmentée
- Conclusion
Objectif
- Connaître les principales modalités de traitement de l’image.
Introduction
En imagerie médicale, la formation de l’image résulte de la mesure physique des interactions entre un processus physique (rayons X, ultrasons, ondes radiofréquences, etc.) et les tissus biologiques. Ces variations d’interactions sont captées, analysées et transformées en signaux. Ces signaux sont alors traduits en une ou plusieurs images immédiatement interprétables.
L’image médicale est numérique. Qu’elle représente une projection ou une coupe, elle se divise en unités élémentaires appelés pixels (picture element). Ces pixels possèdent une information topographique et une valeur de signal représentant les interactions avec les tissus biologiques.
Lorsque l’image représente une coupe, le pixel correspond à une unité de volume élémentaire appelée voxel (volume element) (voir chapitre 2). On dispose des informations concernant sa position au sein de la coupe, sa position au sein du volume, l’épaisseur de la coupe (identique à l’épaisseur du voxel) et sa valeur de signal. L’accès aux informations affectées à chaque pixel et à chaque voxel fournit de multiples possibilités de traitement de l’image pour les modalités d’acquisition par coupes (tomodensitométrie [TDM], imagerie par résonance magnétique [IRM] et échographie). Ce chapitre aborde quelques-unes des nombreuses opérations de traitement de l’image :
- reconstructions d’acquisitions volumiques ;
- segmentation qui vise à délimiter les contours d’organes et les sélectionner ;
- recalage, permettant soustraction ou fusion.
Reconstructions d’acquisitions volumiques
Reconstructions multiplanaires (MPR)
L’empilement des coupes permet de reconstituer le volume et de produire des coupes dans tous les plans de l’espace (axial, coronal, sagittal, oblique) (figure 10.1). Ces coupes sont appelées reconstructions multiplanaires (multiplanar reconstruction [MPR]). Leur qualité est d’autant meilleure que la résolution spatiale longitudinale (axe perpendiculaire au plan de coupe) est élevée, c’est-à-dire que l’épaisseur du voxel et la distance séparant les coupes sont faibles. Un volume isotrope (résolution identique dans les trois axes ou voxel cubique) procure les meilleurs résultats. En TDM, le chevauchement des coupes améliore la résolution spatiale longitudinale.
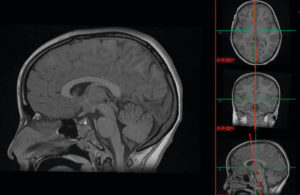
MPR : le volume obtenu à partir d’une acquisition sur le crâne en IRM en pondération T1 permet d’analyser les structures cérébrales dans les trois plans de l’espace.
Reconstructions projectives
Cette technique permet de projeter sur un même plan, selon une direction choisie, les voxels d’intensité maximale (maximal intensity projection [MIP]) (figure 10.2) ou les voxels d’intensité minimale (minimal intensity projection [MinIP]) (figure 10.3). La technique MIP est utile pour étudier les structures vasculaires. La technique MinIP est utile pour étudier les structures contenant de l’air, comme les bronches, ou pour de fines structures au sein de l’os en haute résolution.
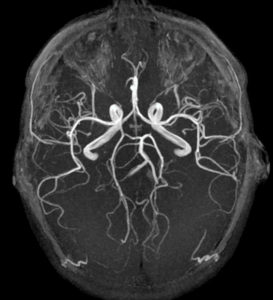
Projection en mode MIP (maximum intensity projection) dans le plan axial à partir d’une séquence d’angio-IRM sans injection de produit de contraste (technique de temps de vol ou time of flight) montrant les artères du cercle artériel du cerveau.
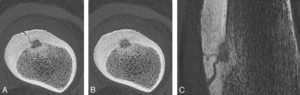
Projection MinIP (minimum intensity projection).
Ostéome ostéoïde de 8 mm de hauteur du fémur gauche chez une femme de 31 ans exploré en super haute résolution (coupes de 0,25 mm d’épaisseur, matrice 1024 × 1024). A, B. Coupes axiales. C. Image MinIP dans le plan sagittal. Noter la qualité de l’analyse de la réaction corticopériostée et la démonstration d’une multitude de vaisseaux alimentant le nidus. Noter également qu’une image MinIP de l’os n’a d’intérêt qu’avec des voxels particulièrement petits.
Source : Blum A, Teixeira P. Scanner et IRM ostéo-articulaires en pratique. Paris : Elsevier Masson ; 2022.
Segmentation
La délimitation d’une zone (par exemple un organe ou une tumeur) dans une image permet de mieux visualiser la structure, d’en quantifier le signal ou d’en mesurer le volume. Une telle zone est appelée région d’intérêt (region of interest [ROI]) et sa délimitation est appelée segmentation. Celle-ci peut se faire manuellement, mais l’utilisation d’algorithmes automatiques ou semi-automatiques de segmentation d’organes et de lésions permet d’augmenter la précision, la fiabilité et la répétabilité de leur représentation ainsi que la mesure de leur volume. Différentes techniques de segmentation sont utilisées ; la plus simple est de déterminer si un pixel appartient ou non à la région d’intérêt en fonction de la valeur du signal par simple seuillage. D’autres techniques plus complexes prennent en compte la taille, la régularité du contour, les caractéristiques des pixels voisins, la connectivité (le fait que la région soit d’un seul tenant).
Rendu de volume et illumination globale
Les images 3D ont pour objectif d’améliorer l’analyse topographique des structures, en offrant une vue globale de la région explorée. Les images 3D font appel à une technique dite de volume rendering technique (VRT). Elles sont réalisées après un seuillage des voxels afin de sélectionner les structures d’intérêt. Des pseudo-couleurs et un certain degré de transparence sont affectés à chaque voxel en fonction de leur valeur de signal. Certains logiciels permettent une mesure des distances ou des angles tridimensionnels.
L’obtention d’une vue 3D sur un plan est obtenue en appliquant deux principes :
- le principe des surfaces cachées : une structure proche de l’œil de l’observateur cache un objet plus distant ;
- l’ombrage : en supposant que l’œil de l’observateur soit la source lumineuse, les objets proches de son œil ou qui lui font face sont plus lumineux que ceux qui sont lointains ou dans l’axe du faisceau lumineux (figure 10.4A).
![Figure 10.4 Comparaison des techniques de rendu de volume (volume rendering technique [VRT]) et du global illumination dans un cas de plaie par balle. A. VRT. B. Global illumination reconstruction. Noter la meilleure visibilité des lésions grâce à l'imagerie photoréaliste (B). Source: Blum A, Gillet R, Rauch A, et al. 3D reconstructions, 4D imaging and postprocessing with CT in musculoskeletal disorders: Past, present and future. Diagn Interv Imaging 2020 ; 101(11) : 693-705.](https://www.cnp-mn.fr/wp-content/uploads/2023/01/Les-fondamentaux-10.4-300x150.jpg)
Comparaison des techniques de rendu de volume (volume rendering technique [VRT]) et du global illumination dans un cas de plaie par balle.
A. VRT. B. Global illumination reconstruction. Noter la meilleure visibilité des lésions grâce à l’imagerie photoréaliste (B).
Source: Blum A, Gillet R, Rauch A, et al. 3D reconstructions, 4D imaging and postprocessing with CT in musculoskeletal disorders: Past, present and future. Diagn Interv Imaging 2020 ; 101(11) : 693-705.
La technique d’illumination globale, plus souvent appelée global illumination (imagerie photoréaliste), remplace progressivement la VRT grâce à une représentation plus réaliste de l’éclairage des objets (figures 10.4B et 10.5B) et à la possibilité d’utiliser des images avec une forte résolution spatiale, ce qui permet d’améliorer la détection et la perception des lésions (figures 10.6 et 10.7).
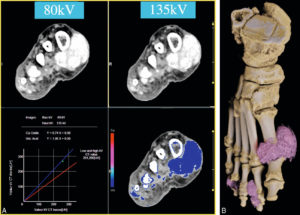
TDM en double-énergie du pied droit chez un patient suivi pour une goutte.
A. Caractérisation du tophus à partir d’une acquisition à basse énergie (80 kV) et haute énergie (135 kV) et la détermination de sa composition sur chacune de ces acquisitions. B. Global illumination fournissant une cartographie des multiples tophus de l’avant-pied droit.
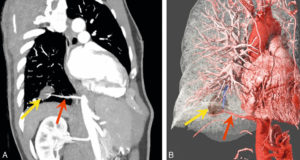
Séquestration pulmonaire intralobaire chez un homme de 59 ans.
MPR oblique (A) et global illumination (B) après segmentation des vaisseaux et du poumon. La séquestration pulmonaire est une malformation congénitale du poumon où une partie du tissu pulmonaire n’est connecté ni à l’arbre bronchique, ni à la circulation vasculaire pulmonaire. Noter la séquestration (flèche jaune) et son artère nourricière qui naît de l’aorte thoracique descendante (flèche rouge).
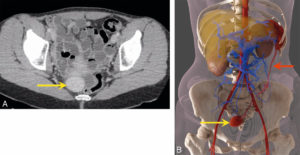
Ectopie splénique.
Coupe axiale en TDM (A) et global illumination après segmentation des vaisseaux et des différents organes (B). Noter la rate accessoire (flèche jaune) et son long pédicule vasculaire (flèche rouge) dont la topographie contribue au diagnostic. L’ectopie splénique ou « rate baladeuse » se définit comme la migration de la rate dans n’importe quel quadrant de l’abdomen. Elle peut être asymptomatique, de découverte fortuite ou responsable de douleurs abdominales en cas d’épisodes de torsion ou d’infarctus splénique.
Recalage, soustraction, fusion
L’appariement et le recalage d’images prennent une place croissante dans l’analyse des données car ces opérations fournissent une analyse simultanée de deux acquisitions différentes d’un même patient :
- soit d’une même modalité à des temps différents ; par exemple TDM sans puis avec injection ; suivi de la réponse au traitement par chimiothérapie d’une tumeur au cours du temps ;
- soit de deux modalités différentes ; par exemple : TDM et TEP pour superposer l’information anatomique et fonctionnelle ; TDM et IRM.
Les opérations de recalage sont le préalable à la fusion ou à la soustraction des images.
Recalage
Pour pouvoir efficacement comparer deux images, les structures étudiées doivent avoir la même position. Or, lorsque les images ont été acquises sur deux appareils différents ou lorsque le patient a bougé entre deux acquisitions sur un même appareil, la mise en correspondance des images nécessite une opération appelée recalage. Les tailles du champ de vue et des pixels n’étant pas nécessairement les mêmes pour les deux images, la première étape du recalage consiste en un reformatage des images dans une base commune. La seconde étape repose sur des transformations rigides ou élastiques des objets de l’image afin de les faire correspondre :
- transformations rigides, lorsque l’objet ne s’est pas déformé mais a simplement bougé, qui consistent en de simples translations et rotations ;
- transformations élastiques, lorsque l’objet se déforme comme lors des mouvements respiratoires ou des battements cardiaques. Ces opérations sont plus complexes et altèrent potentiellement les mesures de signal.
Soustraction
La soustraction est utilisée depuis longtemps en angiographie numérisée. Une première acquisition est réalisée sans injection de produit de contraste, suivie d’une deuxième acquisition avec injection. Les deux séries sont ensuite soustraitées numériquement ; la différence correspond alors aux zones où se localise le produit de contraste, notamment dans les vaisseaux et les tissus hypervascularisés qui sont ainsi mieux visualisés. Cette technique est désormais élargie aux images en coupe ; elle est notamment appliquée en TDM et en IRM de perfusion pour l’analyse de la cinétique de rehaussement d’une tumeur.
Fusion
La fusion met en concordance dans le même espace numérique des images de même nature ou de nature différente. En médecine nucléaire (tomoscintigraphie, TEP-TDM, TEP-IRM) comme en IRM fonctionnelle, elle combine des informations fonctionnelles et morphologiques pour améliorer la valeur diagnostique des examens (figure 10.8).
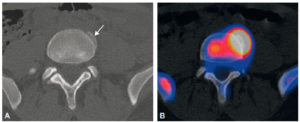
Tomoscintigraphie avec TDM (A) et image de fusion d’une tomoscintigraphie osseuse et TDM (B) d’un syndesmophyte dans le cadre d’une spondylarthrite ankylosante.
La TDM montre l’anomalie morphologique (flèche). L’image de fusion montre l’activité ostéoblastique qui lui est associée.
Réalité augmentée
L’imagerie médicale est essentielle pour la planification préopératoire, mais elle peut également être utilisée pendant l’intervention pour en améliorer la précision et la sécurité. Le principe de la réalité augmentée consiste à superposer au monde réel et en temps réel des objets issus d’images médicales (TDM, IRM, etc.). Cette technique fait appel aux principes de segmentation, de recalage et de fusion de données multimodales. La réalité augmentée est une des processus nécessaires à la chirurgie assistée par ordinateur (CAO).
Conclusion
Les performances accrues de l’informatique permettent de faire appel à des techniques de reconstruction d’image plus nombreuses et plus performantes. Elles autorisent également des opérations combinées des données acquises et la manipulation en temps réel des différentes informations.
Essentiel à retenir
- Les modalités d’imagerie en coupe permettent de produire des volumes numériques, auxquels de multiples traitements peuvent être appliqués : reconstructions dans tous les plans de l’espace, représentations tridimensionnelles, seuillage, segmentation, recalage et fusion.
 |
Chapitre suivant |
 |
Retour au sommaire |
