Les fondamentaux – Chapitre 18 – Processus inflammatoires
G. Bierry , C. Blondet et F. Besson
Plan de l’article
- Physiopathologie de l’inflammation
- Phase initiale : œdème
- Phase séquellaire : fibrose
- Médecine nucléaire
Objectifs
- Comprendre les bases physiopathologiques des modifications inflammatoires visibles en imagerie médicale.
- Connaître les différents aspects d’une lésion inflammatoire en radiographie conventionnelle, tomodensitométrie (TDM), imagerie par résonance magnétique (IRM), échographie.
- Connaître les médicaments radiopharmaceutiques (MRP) utilisés en médecine nucléaire, notamment en tomographie par émission de positons (TEP) dans l’exploration de l’inflammation.
- Connaître les avantages et limites des différentes modalités d’imagerie pour l’exploration des anomalies inflammatoires.
Physiopathologie de l’inflammation
L’inflammation est la réponse physiologique d’un tissu vivant vascularisé à une agression (infection, traumatisme, corps étranger, allergie, auto-immunité, etc.) dans le but de limiter l’agression et de permettre la réparation tissulaire. Ce processus comprend des phénomènes généraux (syndrome inflammatoire biologique, fièvre, altération de l’état général) et des phénomènes locaux.
Au niveau local, la réaction inflammatoire est un processus dynamique combinant des modifications de l’espace extracellulaire et une infiltration cellulaire. Le flux sanguin artériolaire locorégional et la perméabilité capillaire augmentent, ce qui entraîne une extravasation de plasma depuis l’espace intravasculaire vers l’espace extracellulaire : c’est l’œdème tissulaire. Cliniquement, cet œdème se manifeste par une augmentation de taille, un aspect rougeâtre en superficie, une augmentation de la chaleur locale et une douleur (tumor, rubor, calor, dolor). Parallèlement, des cellules sont recrutées et/ou activées sur le site inflammatoire. Dans les premières heures, les polynucléaires neutrophiles sont les leucocytes prépondérants, relayés ensuite par les monocytes et lymphocytes pour circonscrire l’agression. Les cellules sont extraites de la lumière vasculaire pour pénétrer dans les tissus par diapédèse. Ensuite, les tissus sont nettoyés par les polynucléaires et surtout les macrophages pour permettre la cicatrisation ad integrum. En cas de réparation incomplète ou insuffisante, la réaction inflammatoire peut devenir chronique. Parfois, quand la réparation ad integrum n’est pas possible, le tissu original est remplacé par de la fibrose.
Pour détecter des zones inflammatoires, l’imagerie médicale non isotopique (radiographie, TDM, IRM ou échographie) va chercher à mettre en évidence les modifications extracellulaires, et surtout l’œdème tissulaire et l’hypervascularisation. La médecine nucléaire va permettre d’identifier la présence et la distribution des cellules inflammatoires.
Phase initiale : œdème
Avec la douleur, l’œdème est la première manifestation cliniquement évidente de l’inflammation. Le but de l’imagerie est de détecter cet œdème, signe de l’inflammation, soit pour confirmer la suspicion clinique (dans la majorité des cas), soit pour le mettre en évidence avant l’apparition des signes cliniques, ou dans des zones d’exploration difficiles ou profondes (cavité abdominale par exemple).
Plus une technique d’imagerie est capable de détecter précocement l’œdème, et donc de révéler les phases initiales d’une atteinte inflammatoire, plus elle est sensible.
Par ordre décroissant de sensibilité, on retrouve l’IRM (très sensible), la TDM et l’échographie (moyennement sensibles) et les radiographies standard (peu sensibles).
Radiographies
Les radiographies révèlent les différences de densité des tissus mais ne peuvent les différencier visuellement qu’en quatre grandes familles de densité :
- aérique (air, tissu pulmonaire) ;
- graisseuse ;
- hydrique (eau, épanchement, organes pleins, muscles, etc.) ;
- osseuse (ou calcifiée).
Les interfaces entre des tissus de densités différentes forment des lignes visibles sur les radiographies (par exemple la corticale osseuse limitée par la densité hydrique des parties molles, ou le rebord du cœur limité par la densité aérique des poumons). L’œdème (eau extracellulaire) est visible soit par modification de la densité du tissu inflammatoire, soit par déplacement des tissus adjacents qui ont une autre densité.
L’œdème a, par définition, une densité hydrique ; sa présence est plus facile à détecter dans les tissus ayant une densité de base non hydrique (poumon, os) que dans ceux ayant une densité spontanée proche de l’eau (muscles, foie, rein, etc.). Par ailleurs, le tissu inflammatoire augmente de volume et va déplacer les tissus environnants : les lignes créées par les interfaces (liquide/graisse ; liquide/air, etc.) sont déplacées.
Inflammation des tissus mous et des organes pleins
Comme cela a été décrit plus haut, les radiographies sont relativement peu sensibles pour la détection de l’œdème dans les tissus mous (muscles, peau) et les organes pleins (foie, rein, etc.) qui ont une densité radiographique de base « hydrique ».
Il faut plutôt rechercher une augmentation de la taille du tissu/organe atteint, souvent seulement détectable par le déplacement des interfaces avec les tissus environnants (s’ils ont des densités différentes) (figure 18.1).
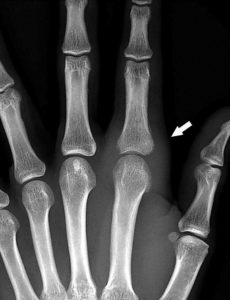
Radiographie conventionnelle de la main montrant un épaississement des tissus mous (flèche) chez une patiente ayant une atteinte inflammatoire (polyarthrite rhumatoïde) de l’articulation métacarpophalangienne de l’index.
Inflammation osseuse
L’augmentation de l’eau extracellulaire dans les os va faire diminuer leur densité (on passe d’une densité osseuse à une densité plus hydrique). Les os apparaissent moins denses ; on parle de déminéralisation (figure 18.2).
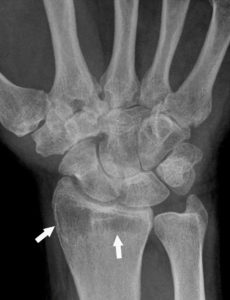
Radiographie conventionnelle du poignet montrant une déminéralisation inflammatoire (dite « en bande ») (flèches) chez une patiente ayant une atteinte inflammatoire (polyarthrite rhumatoïde) du carpe.
Ces modifications sont cependant très tardives, très en retard sur la clinique : les radiographies sont ainsi peu sensibles pour la détection des inflammations osseuses débutantes ; l’IRM est préférable.
Inflammation pulmonaire
L’inflammation du tissu pulmonaire entraîne, dans la majorité des cas, la formation d’un transsudat/exsudat (œdème pulmonaire) dans les alvéoles pulmonaires.
Dans les poumons, l’œdème est relativement aisé à voir en radiographie car la densité du poumon est très basse (aérique, c’est-à-dire celle de l’air). L’œdème va remplacer la densité aérique par une densité hydrique, et comme la différence entre les deux densités est importante, l’œdème sera relativement aisé à reconnaître. Une augmentation de la densité dans le poumon est appelée une opacité.
Séreuses
Les atteintes inflammatoires des séreuses (plèvre, péricarde, péritoine, synoviale) se manifestent précocement par un épanchement, sous la forme d’une formation de tonalité hydrique.
TDM
Comme les radiographies, la TDM utilise des rayons X comme source de rayonnement ; le raisonnement sur les densités est ainsi le même que pour les radiographies. La TDM réalise cependant des acquisitions en coupes et non en projection ; elle est ainsi plus sensible que la radiographie et peut détecter des modifications inflammatoires plus précoces et/ou difficiles à voir.
La TDM est notamment plus performante que la radiographie pour démontrer l’œdème dans les tissus ayant une densité naturelle de type hydrique (organes pleins, muscles, tissus mous, etc.). Dans ces tissus, l’œdème forme une zone de moindre densité ; on parle d’une zone hypodense ou d’hypodensité. Les épanchements sont hypodenses, de façon identique à l’eau. L’injection de produit de contraste iodé par voie intravasculaire entraîne une augmentation du contraste (hyperdensité dans le tissu inflammatoire) en raison des modifications vasculaires (angiogenèse, modifications de perméabilité) : on parle de prise de contraste ou de rehaussement.
Un autre signe très important et souvent plus évident à repérer est la modification du contraste habituel du tissu graisseux. À l’état normal, la graisse apparaît « propre » en TDM : noire, homogène, bien limitée. L’inflammation induit un aspect flou et une augmentation hétérogène de sa densité (figure 18.3).
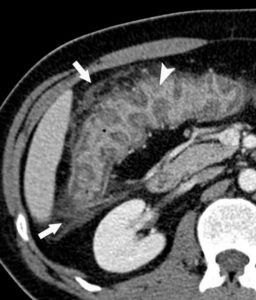
TDM abdominale avec injection de produit de contraste chez un jeune patient ayant une atteinte inflammatoire colique (maladie de Crohn) montrant un épaississement et une prise de contraste de la paroi colique (tête de flèche) et une infiltration de la graisse périphérique (flèches).
IRM
L’IRM est l’examen d’imagerie de référence pour la détection des modifications de quantité et de distribution de l’eau. Elle est donc très sensible pour la détection de l’œdème ; c’est l’examen d’imagerie médicale non isotopique le plus performant pour détecter les phases précoces d’une réaction inflammatoire (figure 18.4).
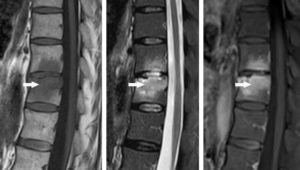
IRM de la colonne vertébrale (séquences sagittales T1, T2 et T1 avec injection d’agent de contraste) montrant une atteinte inflammatoire des vertèbres T11 et T12 (flèches) chez un patient ayant une atteinte inflammatoire de type spondylarthrite ankylosante : aspect caractéristique de l’inflammation en hyposignal T1, hypersignal T2 avec un rehaussement en T1 après injection d’agent de contraste.
Un tissu œdématié a un signal IRM qui se rapproche de celui de l’eau : plus noir en T1 – on parle d’hyposignal ou d’hypo-intensité – ; plus blanc en T2 – on parle d’hypersignal ou d’hyperintensité.
L’injection par voie intraveineuse de produit de contraste à base de gadolinium produit une augmentation du contraste (hypersignal) sur la séquence T1 du tissu inflammatoire ; comme en TDM, il s’agit d’une prise de contraste ou d’un rehaussement (voir figure 18.4).
Échographie
L’échographie est un examen très performant pour détecter les atteintes inflammatoires dans les zones explorables (tissus superficiels, zone abdominopelvienne chez les sujets minces ou les enfants). L’accumulation d’eau extracellulaire dans le tissu œdématié réduit son échogénicité ; il apparaît plus hypoéchogène (plus noir) que le tissu normal. Un épanchement dans une séreuse apparaît en échographie comme une formation fortement hypoéchogène, identique à l’eau : on parle d’aspect anéchogène (figure 18.5).
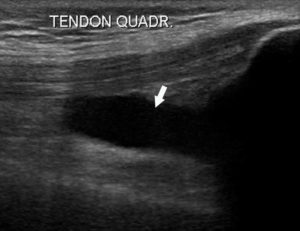
Échographie montrant un épanchement (anéchogène) dans l’articulation du genou (flèche) dans le contexte d’une inflammation de la synoviale.
Un autre avantage important de l’échographie est la possibilité d’une étude fonctionnelle directe par application de la technique Doppler (écho-Doppler). Elle met directement en évidence l’hypervascularisation tissulaire de la réaction inflammatoire (hypersignal Doppler) (figure 18.6).
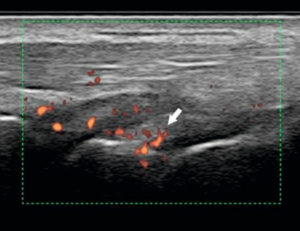
Échographie avec Doppler montrant une hypervascularisation (flèche) de la synoviale du poignet chez un patient ayant une atteinte inflammatoire (polyarthrite rhumatoïde) du carpe.
Phase séquellaire : fibrose
La fibrose (ou sclérose) est une cicatrice, développée en remplacement du tissu original s’il n’a pas pu être régénéré ou a été détruit après la réaction inflammatoire. La fibrose est, grossièrement, un dépôt excessif de tissu conjonctif fibreux qui modifie l’architecture et parfois la fonction de l’organe atteint. La zone fibrotique est plus dense, plus compacte que le tissu original, et plus pauvre en eau avec un espace extracellulaire réduit suite à des adhérences. Des distorsions architecturales par rétraction sont fréquentes, avec une perte de l’élasticité normale.
Radiographie et TDM
En radiographie et TDM, la fibrose apparaît souvent plus dense que le tissu original, dans une zone plus ou moins étendue et épaisse en fonction du tissu lésé. Les adhérences cicatricielles forment des bandes, qu’on peut comparer à des zones de tissus compactés, « collés », peu élastiques, qui souvent déforment la structure et/ou limitent son expansion (figure 18.7).
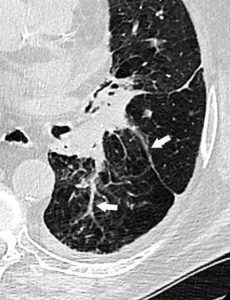
TDM thoracique (fenêtre parenchymateuse) montrant des adhérences fibrotiques cicatricielles (flèches).
IRM
Les plages de fibrose apparaissent en hyposignal par rapport aux tissus sains aussi bien sur les séquences T1 que T2, à cause de la réduction du volume de l’espace extracellulaire (moins d’eau donc moins de signal) et d’une diminution de la vascularisation. Les tissus fibreux peuvent se rehausser après injection de produit de contraste, mais de façon tardive (quelques minutes), à l’opposé des tissus inflammatoires qui sont rehaussés de façon précoce (quelques secondes).
Médecine nucléaire
L’inflammation étant par définition un processus physiologique non spécifique, l’objectif de l’imagerie nucléaire n’est pas d’établir un diagnostic étiologique mais de détecter et de localiser d’éventuels foyers inflammatoires. L’identification de ces foyers accumulant le MRP permet, dans un second temps, d’orienter des biopsies ciblées à visée diagnostique lorsqu’elles sont nécessaires ou de suivre sous traitement ces foyers dans un objectif d’évaluation thérapeutique. Trois approches d’imagerie isotopique sont actuellement disponibles en pratique clinique :
- la scintigraphie au gallium 67 (67Ga), sous forme de citrate, méthode historique ;
- la scintigraphie osseuse (diphosphonates marqués au 99mTc) ;
- la TEP au 18F-FDG, méthode isotopique actuelle de référence en pathologie inflammatoire.
Scintigraphie au 67Ga
Le 67Ga est un analogue de l’ion ferrique Fe3 + qui se fixe sur diverses protéines plasmatiques (ferritine, transferrine, lactoferrine). Au cours d’une réaction inflammatoire, les leucocytes recrutés au niveau du site lésionnel libèrent localement de grandes quantités de lactoferrine. Le 67Ga préalablement injecté par voie intraveineuse s’accumule donc préférentiellement au niveau du site inflammatoire, riche en lactoferrine. MRP historique en imagerie isotopique de l’inflammation, il est de moins en moins utilisé du fait de temps d’acquisition élevés (jusqu’à 48-72 heures après l’injection du MRP) et de la disponibilité de la TEP au 18F-FDG (voir plus loin).
Scintigraphie osseuse en plusieurs temps (diphosphonates marqués au 99mTc)
Les diphosphonates se fixent naturellement sur la phase minérale de la matrice osseuse (cristaux d’hydroxyapatite en formation). Par conséquent, les diphosphonates radiomarqués au 99mTc permettent d’imager tout processus de remodelage osseux (ostéoblastose), qu’il soit inflammatoire, infectieux ou tumoral. Le temps scintigraphique osseux nécessite environ 2 à 3 heures de délai entre l’injection du MRP et l’acquisition des images (temps nécessaire à la fixation du MRP sur la matrice osseuse). Néanmoins, un temps d’acquisition « précoce » réalisé environ 10 minutes après l’injection du MRP permet d’identifier la biodistribution tissulaire du MRP, qui, en cas de processus inflammatoire, s’accroît localement du fait d’une augmentation réactionnelle locorégionale du flux sanguin artériolaire et de la perméabilité capillaire. Il est par conséquent possible, en scintigraphie osseuse, de détecter une composante inflammatoire locorégionale d’un processus osseux/ostéoarticulaire d’intérêt (figure 18.8).
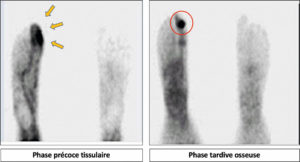
Processus ostéoblastique du 1er rayon du pied droit avec composante inflammatoire locorégionale (scintigraphie osseuse au 99mTc des pieds en deux temps).
Hyperhémie des parties molles de l’orteil droit en phase précoce (A, flèches), témoignant d’une composante inflammatoire locorégionale du processus osseux d’intérêt, visualisé en phase osseuse (B, hyperfixation focale, cercle).
TEP au 18F-FDG
Analogue du glucose marqué au fluor 18 (18F), le 18F-FDG est un MRP qui reflète le métabolisme glucidique des cellules. Les cellules médiatrices de l’inflammation, une fois activées, présentent un métabolisme accru et accumulent donc le 18F-FDG. Par conséquent, la TEP au 18F-FDG est un examen d’une très grande sensibilité pour détecter les phénomènes inflammatoires actifs. Les acquisitions volumiques sont réalisées sur l’ensemble du corps (typiquement vertex à mi-cuisse, voire pieds si besoin), permettant d’obtenir une évaluation corps entier en 3D, avec une résolution spatiale bien plus élevée qu’en scintigraphie conventionnelle. Les lésions séquellaires pures n’étant pas métaboliquement actives, elles ne présentent pas de traduction métabolique. Il est par conséquent possible de discriminer des lésions inflammatoires chroniques en phase « active » de séquelles inflammatoires cicatricielles (c’est-à-dire métaboliquement inactives), de morphologie parfois similaire.
Ce MRP ne présente aucun effet indésirable. Les images sont réalisées entre 1 heure et 1 heure et 30 minutes après l’injection intraveineuse du MRP, chez des patients à jeun depuis 6 heures. Incontournable en oncologie (bilan initial et suivi des cancers), l’intérêt du 18F-FDG en pathologie inflammatoire est plus récent et quelques grandes indications sont actuellement définies : vascularites des gros troncs artériels (figure 18.9), sarcoïdose (figure 18.10), maladies auto-immunes, pathologie inflammatoire ostéoarticulaire, mais aussi fièvres au long cours.
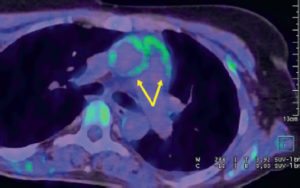
Maladie de Takayasu (vascularite des gros vaisseaux)/stade inflammatoire actif (TEP-TDM au 18F-FDG en coupe axiale de l’artère pulmonaire).
Hypermétabolisme des parois de l’aorte ascendante et du tronc pulmonaire (flèches), témoignant de l’inflammation active des parois artérielles.
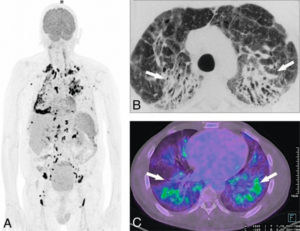
Sarcoïdose avec atteinte pulmonaire chronique.
A. Image volumique TEP-FDG (3D-MIP) montrant de multiples foyers hypermétaboliques lymphatiques sus- et sous-diaphragmatiques (en noir). B. TDM thoracique du même sujet (coupe axiale) montrant une fibrose pulmonaire, avec distorsions bronchiques par rétraction du parenchyme pulmonaire (flèches). C. Le 18FDG (TEP-TDM en coupe axiale) confirme le caractère hypermétabolique de la fibrose pulmonaire (flèches), témoignant d’un processus inflammatoire encore actif.
Essentiel à retenir
- Dans les processus inflammatoires à la phase initiale, l’imagerie non isotopique (radiographie, TDM, IRM, échographie) permet de mettre en évidence l’œdème.
- Les zones inflammatoires œdématiées ont un aspect se rapprochant de celui de l’eau (hypodense en TDM, hyperintense en T2 en IRM, etc.).
- Les lésions actives ont un signal augmenté précocement après injection de produit de contraste (on parle de prise de contraste, ou de rehaussement).
- Les lésions cicatricielles sont en revanche peu hydratées, avec peu de prise de contraste ou une prise de contraste retardée avec de fréquentes déformations architecturales.
- L’imagerie nucléaire est sensible pour la détection des processus inflammatoires : vascularites, fièvres au long cours, sarcoïdose.
- La scintigraphie osseuse en plusieurs temps permet d’identifier une composante inflammatoire associée aux processus osseux/ostéoarticulaires évalués.
- La scintigraphie au 67Ga est aujourd’hui supplantée par la TEP au 18F-FDG.
 |
Chapitre suivant |
 |
Retour au sommaire |
