Les fondamentaux – Chapitre 20 – Processus ischémiques
P.M. Walker et A. Redheuil
Plan du chapitre
- Ischémie : définition et mécanismes
- Imagerie des processus ischémiques
Objectifs
- Connaître les différents tableaux liés aux processus ischémiques en radiographie, TDM, IRM, échographie et médecine nucléaire.
- Connaître les avantages et limites des différentes modalités d’imagerie pour l’exploration des processus ischémiques.
- Connaître la séméiologie de l’ischémie dans les différentes modalités d’imagerie.
- Connaître les produits de contraste et les médicaments radiopharmaceutiques (MRP) utilisés en imagerie dans l’exploration de l’ischémie.
Ischémie : définition et mécanismes
L’ischémie est un état physiopathologique secondaire à un déficit d’oxygénation d’un tissu par inadéquation entre les apports et les besoins en oxygène. Elle résulte de l’interruption de tout ou partie de la circulation artérielle d’un organe ou d’une région le plus souvent par complication locale d’une plaque d’athérome (sténose serrée, thrombose, embolie ou dissection), dans un contexte favorisant l’athérosclérose (vieillissement, hypertension artérielle [HTA], diabète, dyslipidémie, tabagisme), ou à l’occasion d’une embolie artérielle d’origine cardiaque ou aortique.
L’ischémie peut également survenir lors de l’occlusion d’une veine (thrombophlébite cérébrale par exemple), dont il peut résulter une congestion, une hémorragie et un infarctus veineux. Les facteurs de risque des thromboses veineuses sont les états d’hypercoagulabilité (contexte postopératoire, alitement prolongé, grossesse ou post-partum, thrombophilie).
Quand l’ischémie est temporaire ou rapidement prise en charge, les dégâts sur l’organe ne sont pas permanents et les cellules ne sont pas détruites totalement. En revanche, en cas d’ischémie prolongée, les dommages sur l’organe sont irréversibles. La diminution de l’apport de sang artériel dans un organe ou un tissu entraîne, en effet, une baisse de son oxygénation et la perturbation, voire l’arrêt de sa fonction.
Ainsi, dans l’ischémie aiguë myocardique, l’accumulation de lactate dans le myocarde entraîne une diminution de ses capacités de contraction et de relaxation. Si elle est suffisamment grave et prolongée, l’ischémie peut conduire à un infarctus du myocarde, qui désigne la mort cellulaire.
Le phénomène ischémique est ubiquitaire, c’est-à-dire qu’il peut se produire dans tous les organes (tube digestif, rein, poumon et membres, en particulier inférieurs) ; toutefois, les ischémies aiguës les plus fréquentes intéressent le cerveau et le cœur.
Physiopathologie de l’ischémie cérébrale
Le cerveau, dépourvu de réserves d’oxygène et de glucose, est fortement dépendant des apports extérieurs en substrats énergétiques et, par conséquent, fortement dépendant du débit sanguin. Chez l’adulte, le débit sanguin cérébral normal est en moyenne de 50 mL/min/100 g de tissu cérébral. L’autorégulation permet de maintenir constant le débit sanguin cérébral pour les pressions de perfusion entre 50 et 150 mmHg. En dehors de ces valeurs, le débit sanguin cérébral est directement proportionnel à cette pression. En dépit de la mise en jeu de moyens de protection, une altération fonctionnelle du métabolisme cellulaire apparaît dès que le débit sanguin cérébral est inférieur à environ 20 mL/min/100 g de cerveau. En cas d’occlusion artérielle, on distingue un centre d’ischémie dense au sein duquel le débit sanguin est inférieur à 10 mL/min/100 g et, au pourtour, une zone de tissu avec un débit intermédiaire entre 10 et 20 mL/min/100 g. Cette zone, désignée sous le terme de pénombre ischémique, correspond à la partie du tissu cérébral ischémié où le débit sanguin est insuffisant pour maintenir un fonctionnement cellulaire normal, la survie cellulaire y demeurant cependant assurée dans un premier temps (figure 20.1). En deçà de 10 mL/min/100 g de cerveau, la zone d’oligémie maximale tolérable est atteinte. Si cet état d’oligémie se prolonge plus de quelques minutes, l’évolution se fait vers une mort cellulaire.
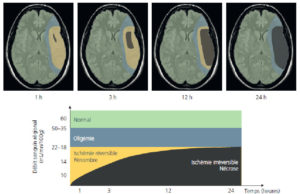
Représentation schématique de l’ischémie cérébrale montrant les phases d’apparition de l’oligémie, de la pénombre (ischémie réversible) et de la nécrose.
Imagerie des processus ischémiques
Il faut distinguer l’insuffisance artérielle chronique de l’insuffisance artérielle aiguë. Dans le cas de l’insuffisance artérielle chronique, la réduction du calibre artériel (induite le plus souvent par une plaque d’athérome) est à l’origine d’une inadéquation entre les besoins métaboliques de l’organe et l’apport artériel, le plus souvent asymptomatique en dehors de l’effort, dont l’expression est l’angor pour les coronaires, la claudication intermittente des membres inférieurs pour les artères des membres inférieurs ou la « claudication du grêle » pour l’artère mésentérique supérieure. Cette insuffisance artérielle est mise en évidence en imagerie ou en électrophysiologie lors d’épreuves d’effort ou de stress. Elle est parfois compensée par le développement d’une circulation collatérale si le processus sténosant apparaît progressivement. Cette collatéralité peut être mise en évidence en imagerie.
Dans le cas d’une occlusion artérielle aiguë, la symptomatologie est d’apparition brutale. Elle traduit soit une hypoperfusion d’organe, dont les conséquences sur la morphologie ou la fonction d’un organe sont généralement réversibles, soit une nécrose (infarctus constitué), qui est irréversible (voir encadré « Pour aller plus loin »). Le délai d’apparition des lésions irréversibles en cas d’ischémie aiguë varie en fonction de l’organe atteint et de la présence d’éventuelles voies de suppléance si l’épisode aigu survient dans un contexte d’insuffisance artérielle chronique. Ce délai est de l’ordre de 3 à 6 heures en fonction des organes atteints. La mise en œuvre des examens d’imagerie doit être rapide et, si elle oriente la prise en charge thérapeutique, elle ne doit pas la retarder.
L’imagerie a trois rôles principaux dans l’exploration d’un processus ischémique :
- affirmer l’existence d’une souffrance ischémique aiguë, la localiser, évaluer sa sévérité, son extension, sa cause et la dater (comme en cas d’AVC ischémique) devant un tableau clinique évocateur, d’installation aiguë (douleur thoracique, abdominale, déficit neurologique brutal et un terrain à risque) ;
- après un événement ischémique : faire le bilan de la sévérité des séquelles d’infarctus (zone d’ischémie irréversible, tissu non viable) et évaluer la viabilité et l’ischémie résiduelles ;
- prévenir la survenue de l’ischémie et de ses complications : c’est essentiellement le rôle des techniques d’imagerie vasculaire et des techniques fonctionnelles permettant de démasquer une insuffisance artérielle chronique.
L’imagerie permet d’évaluer, d’une part, la perfusion tissulaire, et d’autre part, les vaisseaux par des techniques distinctes (figure 20.2). L’exploration d’un processus ischémique est par conséquent souvent multimodale. Par exemple, lorsqu’un patient souffre d’un AVC, l’extension des lésions ischémiques du parenchyme cérébral est explorée préférentiellement en IRM ; les anomalies vasculaires causales (thrombus, sténose) sont explorées par échographie ou angiographie non invasive (TDM ou IRM). Enfin, si un traitement endovasculaire est possible, une angiographie invasive en radiologie interventionnelle (voir chapitre 15) permet, en fonction de la cause et du site de l’occlusion, de recanaliser le vaisseau occlus par thrombectomie, thrombolyse, angioplastie ou mise en place d’une endoprothèse (stent).
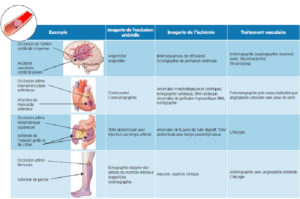
Illustration à partir de quatre exemples de l’exploration multimodale en imagerie des processus ischémiques.
En fonction des organes atteints et du degré d’urgence, l’une ou l’autre des techniques est privilégiée pour évaluer l’anatomie vasculaire d’une part, et le retentissement sur l’organe d’autre part.
Dessins : Cyrille Martinet.
Radiographie standard
La radiographie standard est très peu utile pour l’imagerie de l’ischémie. Une radiographie de thorax peut montrer une complication d’un infarctus du myocarde aigu sévère en mettant en évidence des signes d’œdème pulmonaire aigu que sont l’augmentation du contenu veineux pulmonaire (dilatation et redistribution vasculaire vers les sommets), la diffusion du liquide dans l’interstitium pulmonaire (syndrome interstitiel), voire une diffusion du liquide dans les alvéoles (syndrome alvéolaire). Cette technique d’imagerie n’a pas de place dans la visualisation directe de l’ischémie.
Angiographie X
Les techniques angiographiques utilisant les rayons X selon différents plans de l’espace sont très utiles pour explorer les artères grâce à l’injection intra-artérielle de produits de contraste iodés. Elles sont surtout utilisées à la phase aiguë des formes sévères d’ischémie ou en préalable à une intervention thérapeutique endovasculaire (revascularisation avec angioplastie et pose d’endoprothèse) (voir chapitre 15). L’opacification des artères permet d’identifier une occlusion artérielle, une sténose de la lumière artérielle, une dissection ou maladie artérielle sous-jacente comme un anévrisme. Une occlusion artérielle apparaît comme une interruption brutale de la progression du produit de contraste (exemple en figure 20.3). Des rétrécissements transitoires et fonctionnels de l’artère appelés « spasmes » peuvent également être visualisés. En cas d’occlusion artérielle, l’angiographie peut aussi mettre en évidence l’existence de branches artérielles collatérales permettant de compenser l’hypoperfusion.
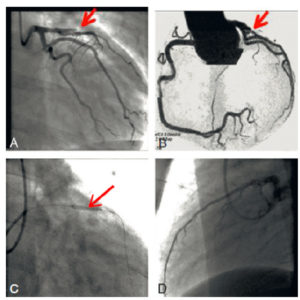
Occlusion d’une artère coronaire en angiographie.
A. Coronarographie sélective de l’artère coronaire gauche montrant une occlusion brutale de l’artère interventriculaire antérieure par un thrombus (flèche). B. L’occlusion était visible sur le coroscanner (flèche). C. Procédure de revascularisation coronaire par déploiement intracoronaire d’un stent monté sur ballon (flèche). D. Résultat final après désobstruction coronaire et mise en place d’un stent sur l’artère interventriculaire antérieure proximale.
TDM
La TDM permet de visualiser avec une grande précision les vaisseaux, mais aussi la perfusion des organes cibles. C’est un examen accessible en urgence et largement utilisé.
Une acquisition à un temps artériel précoce après l’injection de produit de contraste permet d’identifier un rehaussement très intense des structures vasculaires, et donc leur évaluation précise (figure 20.4). Ainsi, l’angio-TDM des troncs supra-aortiques permet d’estimer le degré de sténose d’une artère chez un patient asymptomatique présentant des facteurs de risque vasculaire. En ce qui concerne l’exploration des coronaires en TDM, une synchronisation de l’acquisition avec l’ECG est nécessaire (voir chapitre 26). Le coroscanner permet, de façon non invasive, d’analyser les sténoses, l’anatomie des coronaires, mais ne permet pas de geste endovasculaire contrairement à la coronographie. En revanche, contrairement à la coronarographie qui ne visualise que la lumière artérielle, le coroscanner permet une analyse de la paroi artérielle à la recherche d’athérome et de complications : thrombose, hématome, dissection.
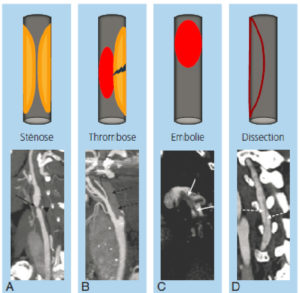
Aspects en angio-TDM des principaux types d’occlusion artérielle.
TDM réalisées après injection de produit de contraste au temps artériel avec reconstructions en mode MIP montrant la lumière artérielle (hyperdense) partiellement ou complètement oblitérée par une structure hypodense. A. Sténose carotidienne sévère (85 %) sur athérome (flèche noire) circonférentiel partiellement calcifié (tête de flèche). B. Thrombose complète de la carotide interne (flèches noires en pointillés). C. Embolie pulmonaire avec présence de thrombus hypodenses dans la lumière de l’artère pulmonaire gauche en vue sagittale (flèches blanches). D. Dissection d’une artère vertébrale avec visibilité du flap intimal dans la lumière artérielle (flèches blanches pointillées).
Une acquisition à un temps plus tardif, parenchymateux (au cours d’un même examen, sans injection supplémentaire), permet d’étudier la perfusion tissulaire de certains organes. Ainsi, en cas d’ischémie mésentérique, la TDM abdominopelvienne montre l’occlusion artérielle et l’état de la paroi des anses digestives du territoire artériel occlus qui peut aller d’un œdème, le plus souvent réversible (figure 20.5), à des lésions irréversibles comme l’absence de rehaussement de la paroi des anses digestives (figure 20.6), ou une nécrose des anses avec présence d’une pneumatose pariétale (présence d’air dans la paroi digestive).
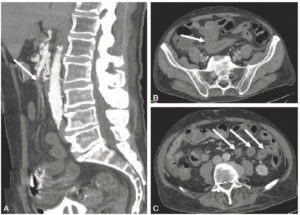
Homme de 74 ans, contexte de cholangiocarcinome intrahépatique. Douleurs abdominales intenses motivant la réalisation d’une TDM abdominale.
A. Images sagittales MIP au temps artériel précoce objectivant une occlusion complète de l’artère mésentérique supérieure (flèche). B, C. Les coupes axiales au temps portal montrent des anses jéjunales à paroi épaisse et hypodense (flèches), avec une prise de contraste persistante de la muqueuse. Il n’existe pas de signe de complication. Le taux de lactates sériques était normal, et le patient ne présentait pas de défaillance d’organe. Le tout correspond donc à une ischémie mésentérique aiguë d’origine artérielle embolique au stade précoce.
Remerciements au Dr Maxime Ronot.
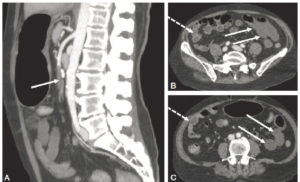
Homme de 58 ans. Douleurs abdominales intenses motivant la réalisation d’une TDM abdominale.
A. Images sagittales MIP au temps artériel précoce objectivant une occlusion complète de l’artère mésentérique supérieure (flèche). B, C. Les coupes axiales au temps portal montrent des anses jéjunales à paroi fine avec un défaut de rehaussement (flèches), comparé aux anses normales dans le flanc droit (flèches pointillées). Il n’existe pas de signe de complication, mais le taux de lactates sériques était à deux fois la valeur supérieure de la normale. Le tout correspond donc à une ischémie mésentérique aiguë d’origine artérielle embolique au stade tardif.
Remerciements au Dr Maxime Ronot.
Une TDM avec injection permet également de détecter la présence d’un réseau de vaisseaux collatéraux en cas de sténose chronique.
IRM
L’IRM est un examen d’imagerie médicale non invasif de référence pour la mise en évidence des processus ischémiques cérébraux et myocardiques. Elle fournit un bon contraste tissulaire spontané et, en association avec les produits de contraste gadolinés, des informations précieuses sur la perméabilité microvasculaire (souvent appelée perfusion) peuvent être récoltées.
L’exploration des conséquences sur le myocarde d’une sténose ou d’une occlusion coronaire en IRM se fait soit par l’étude de l’altération de la fonction contractile segmentaire du myocarde lors d’un stress pharmacologique inotrope (injection de dobutamine), soit par la mise en évidence d’une hypoperfusion relative dans le territoire d’une artère coronaire lors d’un stress pharmacologique vasodilatateur (régadénoson, adénosine ou dipyridamole). L’imagerie de l’infarctus du myocarde aigu (nécrose) ou chronique (séquelle fibreuse irréversible) se fait grâce à la mise en évidence d’un hypersignal tardif par rétention anormale du produit de contraste dans les zones concernées (sous-endocardique ou transmurale selon la sévérité) (figure 20.7). Lorsqu’il existe des zones au sein de la nécrose avec obstruction microvasculaire, on observe un hyposignal au sein de l’hypersignal adjacent par défaut de pénétration du produit de contraste (phénomène de « no reflow »). Par ailleurs, l’IRM est la technique de référence pour l’étude de la fonction systolique cardiaque et permet d’évaluer les conséquences fonctionnelles de l’ischémie ou de l’infarctus du myocarde en étudiant la contraction locorégionale du myocarde (hypokinésie, akinésie ou dyskinésie segmentaires), et d’évaluer la fonction globale par le calcul de la fraction d’éjection des ventricules droit et gauche. En revanche, l’analyse directe complète de la perméabilité des artères coronaires est insuffisante aujourd’hui en IRM ; sa résolution actuelle permet néanmoins de mettre en évidence une anomalie de naissance d’une artère coronaire.
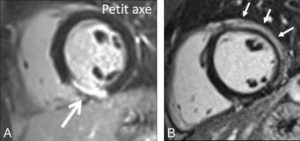
Séquences IRM de « rehaussement tardif » (imagerie T1) réalisée 10 minutes après injection d’un agent de contraste à base de chélates de gadolinium, montrant une séquelle de nécrose inféroseptale et inférieure du ventricule gauche dans le cadre d’un infarctus du myocarde (A) (flèche blanche large) atteignant l’endocarde, à différencier d’une myocardite aiguë latérale du ventricule gauche myocardite (B) (flèches blanches fines) où l’atteinte touche l’épicarde et préserve l’endocarde.
L’IRM est également une des modalités de choix pour la mise en évidence de l’ischémie cérébrale, car elle est capable de différencier les phases critiques telles que l’apparition de l’œdème cytotoxique, de l’œdème vasogénique et de la cavité porencéphalique. L’IRM de diffusion et de perfusion permet la distinction entre la pénombre et la nécrose. L’angio-IRM (réalisée sans injection de produit de contraste) apporte des renseignements sur la perméabilité des artères cérébrales (figure 20.8). Enfin, en cas de thrombophlébite cérébrale, l’IRM cérébrale permet de mettre en évidence des thromboses des sinus veineux cérébraux grâce également à des séquences d’angio-IRM veineuse, et d’apprécier le retentissement sur le parenchyme cérébral d’un éventuel infarctus veineux.
![Figure 20.8 IRM cérébrale à 2 heures de l'apparition d'un déficit hémicorporel gauche. Une cartographie du coefficient apparent de diffusion (A) et une image native de diffusion (B) montrent une zone d'ischémie limitée au territoire cérébral moyen (ou sylvien) profond (flèches blanches). L'image morphologique en pondération fluid-attenuated inversion recovery (FLAIR) dans le plan axial (C) au même niveau ne montre pas d'anomalie. L'angio-IRM (D) sans injection (3D-time of flight [TOF] en reconstruction MIP) montre une occlusion de l'artère cérébrale moyenne droite (flèche en pointillés). Remerciements au Pr Kremer.](https://www.cnp-mn.fr/wp-content/uploads/2023/01/Les-fondamentaux-20.8-225x300.jpg)
IRM cérébrale à 2 heures de l’apparition d’un déficit hémicorporel gauche.
Une cartographie du coefficient apparent de diffusion (A) et une image native de diffusion (B) montrent une zone d’ischémie limitée au territoire cérébral moyen (ou sylvien) profond (flèches blanches). L’image morphologique en pondération fluid-attenuated inversion recovery (FLAIR) dans le plan axial (C) au même niveau ne montre pas d’anomalie. L’angio-IRM (D) sans injection (3D-time of flight [TOF] en reconstruction MIP) montre une occlusion de l’artère cérébrale moyenne droite (flèche en pointillés).
Remerciements au Pr Kremer.
Échographie
L’échographie-Doppler est fondée sur l’étude du retour d’une onde ultrasonore modifiée après passage à travers les tissus explorés. Elle n’est pas irradiante, est facilement disponible au lit du malade, mais peut être non exhaustive chez certains patients peu échogènes. Elle représente l’examen de première ligne indispensable dans les explorations cardiaques et vasculaires périphériques. En pathologie ischémique cardiaque, l’échographie montre les anomalies de contraction segmentaires (figure 20.9) et évalue la fonction cardiaque globale par le calcul de la fraction d’éjection. Toutefois, elle ne permet pas l’analyse directe des artères coronaires (en dehors du tronc coronaire commun en échographie transœsophagienne), ni de la perfusion myocardique. Elle permet de détecter des complications de l’ischémie telles qu’une communication interventriculaire ou un épanchement péricardique.
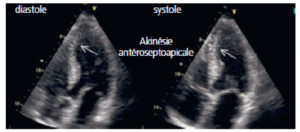
Échographie du cœur dans le plan 4 cavités montrant un segment du septum interventriculaire apical dont l’épaississement en systole est insuffisant (flèche), définissant une hypokinésie à ce niveau.
Il s’agit de la conséquence fonctionnelle ici d’un infarctus du myocarde antéro-septo-apical incomplet. En revanche, l’échographie ne permet pas ici, contrairement à l’IRM, une caractérisation tissulaire.
L’échographie-Doppler des vaisseaux périphériques permet de visualiser directement la sténose ou le thrombus, que ce soit à la phase aiguë ou à un stade asymptomatique. Elle est réalisable pour l’exploration des artères des membres inférieurs et supérieurs, des troncs supra-aortiques au niveau cervical et des artères rénales. Le Doppler pulsé permet d’évaluer le degré de sévérité d’une sténose artérielle en fonction du retentissement hémodynamique en aval de l’obstruction.
L’utilisation de produit de contraste ultrasonore (microbulles) peut permettre de mettre en évidence une zone d’hypoperfusion parenchymateuse en cas d’occlusion artérielle du territoire correspondant.
Médecine nucléaire
Deux approches sont possibles en médecine nucléaire pour explorer l’ischémie :
- utiliser des traceurs ou MRP permettant d’évaluer la perfusion d’un organe ou d’un tissu, sachant qu’une diminution de la perfusion est le plus souvent la cause de l’ischémie ;
- évaluer les conséquences de la survenue d’une ischémie, comme l’hypoxie cellulaire, ou certaines modifications métaboliques.
Exploration de la perfusion tissulaire
Le traceur « idéal » pour l’étude de la perfusion tissulaire est l’eau marquée à l’oxygène-15 (H215O) qui, comme l’eau non marquée, diffuse librement dans tous les compartiments de l’organisme proportionnellement aux débits sanguins locaux. L’H215O étant un émetteur de positons, il est donc possible de réaliser une imagerie et de quantifier la distribution de ce traceur avec de la TEP. Cependant, la période radioactive très courte de l’H215O (2 minutes) rend son utilisation très difficile (injection et acquisition réalisées simultanément, nécessité d’un cyclotron à proximité) ; ce traceur n’est donc pas utilisé en routine.
D’autres MRP plus simples d’utilisation ont été développés ; ils sont en revanche spécifiques d’un organe :
- pour le cœur, il s’agit le plus souvent de cations lipophiles (99mTc-tétrofosmine et 99mTc-sestamibi) qui vont s’accumuler et rester piégés dans les cardiomyocytes ; il est donc possible d’acquérir les images à distance de l’injection. On réalise le plus souvent les acquisitions d’images au repos et après un effort afin d’appréhender les éventuelles différences de perfusion myocardique entre l’effort (ou le stress) et le repos (figure 20.10) ;
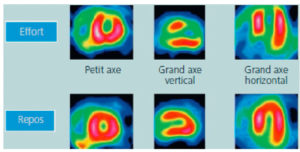
Images TEMP au 99mTc-sestamibi montrant un cas d’ischémie myocardique aux phases d’effort (ou stress) et de repos.
- pour le cerveau, il s’agit également de molécules lipophiles qui vont traverser la membrane hémato-encéphalique et s’accumuler dans les neurones : le 99mTc-éthylène cystéine dimère (ECD) et le 99mTc- HMPAO. Une fois dans le cytoplasme, ils sont convertis en composés hydrophiles et restent donc piégés (voir chapitre 23).
L’accumulation de ces MRP est relativement proportionnelle aux débits sanguins régionaux. Ils sont utilisés en scintigraphie conventionnelle et il n’est donc pas possible de quantifier précisément leur fixation, mais seulement de manière relative (voir chapitre 5). Cependant, du fait de leur disponibilité et de leur facilité d’usage, ils sont très utilisés en routine.
Exploration des conséquences de l’ischémie : l’hypoxie cellulaire
Certains traceurs comme le 18F-FMISO (fluoromisonidazole) s’accumulent spécifiquement dans le cytoplasme des cellules hypoxiques. Ce dernier peut être utilisé, par exemple, pour mettre en évidence des zones de pénombre en cas d’AVC (figure 20.11) ou en oncologie pour mettre en évidence des zones ischémiques dans les tumeurs, qui sont généralement plus résistantes à certains traitements. Cependant, son utilisation en routine reste encore à préciser.
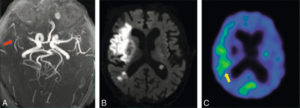
IRM et TEP 18F-FMISO dans le cas d’un AVC à J30.
L’angio-IRM (A) montre une revascularisation partielle (flèche rouge) et la TEP (C) indique une absence de fixation du traceur dans la zone hyperintense en DWI (B). Néanmoins, une fixation du traceur est visible (flèche jaune), postérieure à la lésion, et évoque une possible hypoxie persistante.
Source : Takasawa M, Reda Moustafa R, Baron JC. Applications of nitroimidazole in vivo hypoxia imaging in ischemic stroke. Stroke 2008;39 :1629–37. © Wolters Kluwer 2008.
L’ischémie entraîne également des désordres métaboliques comme dans les cardiomyocytes avec le passage d’un métabolisme aérobie (bêta-oxydation des acides gras) à une prédominance de la glycolyse anaérobie. Ce basculement métabolique peut être mis en évidence avec la TEP au 18F-FDG, un analogue du glucose qui va donc s’accumuler préférentiellement dans le myocarde ischémique par rapport au myocarde normal.
Essentiel à retenir
- L’imagerie permet d’affirmer l’existence d’une souffrance ischémique aiguë et d’établir une cartographie des tissus infarcis, c’est-à-dire non viables, et des tissus ayant un potentiel de récupération si une reperfusion est envisageable.
- La prise en charge en imagerie d’un processus ischémique est le plus souvent multimodale, en fonction des organes atteints, et tient compte du degré d’urgence de l’intervention. Elle repose essentiellement sur les techniques angiographiques en angio-TDM, en angio-IRM et en angiographie X pour visualiser l’obstruction vasculaire, et sur l’IRM, la TDM et la scintigraphie, pour l’évaluation du retentissement sur le parenchyme.
- En médecine nucléaire, il est possible d’évaluer la perfusion d’un organe ou d’un tissu ainsi que l’hypoxie cellulaire, voire certaines modifications métaboliques.
 |
Chapitre suivant |
 |
Retour au sommaire |
