Les fondamentaux – Chapitre 27 – Imagerie de l’abdomen
O. Lucidarme et D. Kharroubi
Plan du chapitre
- Connaître les techniques d’imagerie de l’abdomen et pouvoir les expliquer au patient
- Séméiologie de base en imagerie abdominale
- Principales indications en imagerie abdominale
- Description et indications des examens de médecine nucléaire
Objectifs
- Connaître les techniques d’imagerie de l’abdomen et pouvoir les expliquer au patient.
- Connaître la séméiologie de base de l’imagerie de l’abdomen utilisant les rayons X.
- Connaître l’intérêt et les principales indications des produits de contraste en TDM.
- Connaître la séméiologie de base en imagerie abdominale échographique.
- Connaître la séméiologie de base en IRM abdominale.
- Connaître l’intérêt et l’indication des produits de contraste en IRM.
- Connaître l’intérêt et l’indication des MRP en médecine nucléaire.
- Comprendre la place des différentes techniques d’imagerie de l’abdomen dans les principaux syndromes.
- Connaître les techniques d’imagerie de l’abdomen et pouvoir les expliquer au patient
Techniques radiologiques anciennes
Schématiquement, les techniques historiques d’exploration de l’abdomen étaient fondées sur l’imagerie en projection (radiographies) jusqu’à l’avènement des techniques d’imagerie en coupes.
Ainsi, l’abdomen sans préparation (ASP), qui correspond à une radiographie simple de l’abdomen (figure 27.1) était très largement employé et parfois associé aux opacifications digestives. L’opacification améliore l’analyse du contenu des organes creux en étudiant le liseré muqueux (bords du produit de contraste limités par la muqueuse), le volume et la forme des organes, la régularité de leurs parois. Le produit de contraste utilisé est radio-opaque (sulfate de baryum, iode), parfois mélangé à de l’air (« double contraste » pour le côlon) :
- le transit œso-gastro-duodénal (TOGD) par l’ingestion du produit de contraste (figure 27.2) ;
- le transit du grêle qui consiste à faire absorber des quantités plus grandes de produit de contraste et à observer sa progression dans l’ensemble de l’intestin grêle par des radiographies régulières. Cet examen pouvait durer jusqu’à 2 heures/2 heures 30 avant que le produit ingéré n’atteigne la dernière anse iléale (figure 27.3) ;
- le lavement réalisé par l’introduction d’une canule dans le rectum et le remplissage par cette canule de la totalité du cadre colique par un produit de contraste radio-opaque liquide (figure 27.4).
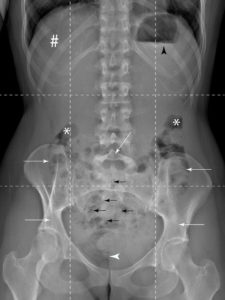
Exemple de radiographie d’abdomen sans préparation.
La région abdominale est divisée en neuf quadrants limités par deux lignes verticales médioclaviculaires et deux lignes horizontales passant par le bord inférieur des cartilages costaux et par les épines iliaques antérosupérieures. Les quadrants supérieurs sont les hypochondres droit et gauche, séparés par l’épigastre. L’hypochondre droit et l’épigastre sont occupés par le foie (#), de densité homogène. L’hypochondre gauche est occupé par l’estomac et par la rate. Le niveau hydroaérique (tête de flèche noire) est lié au remplissage gastrique avec de l’air qui s’accumule dans le fundus. Sa présence témoigne d’un cliché réalisé en position debout. Les quadrants moyens sont les flancs droit et gauche, séparés par la région ombilicale. Les flancs contiennent le côlon (flèches blanches) (ascendant et descendant, ainsi que les angles coliques droit et gauche) (astérisques). La région ombilicale contient le côlon transverse (flèche blanche) et l’intestin grêle (flèches noires), principalement le jéjunum. Les quadrants inférieurs sont les fosses iliaques droite et gauche, séparées par l’hypogastre. La fosse iliaque droite contient le cæcum et l’appendice vermiculaire ; la fosse iliaque gauche contient le côlon sigmoïde ; l’hypogastre contient l’iléon, la vessie et le rectum. Les quatre densités sont visibles : densité aérique de l’air contenu dans le tube digestif (noir sur l’image), densité osseuse du rachis, du bassin et des côtes (blanc sur l’image), densité graisseuse de la graisse sous-cutanée (gris sombre sur l’image) et densité hydrique du foie et des reins (gris clair sur l’image).
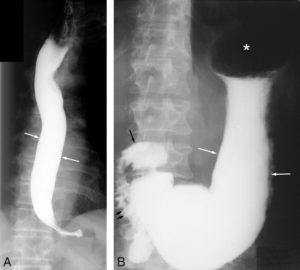
Exemple de TOGD.
La lumière de l’œsophage (A) et de l’estomac (B) est opacifiée par un produit de contraste liquide à base de sulfate de baryum ingéré par le patient. Le produit de contraste vient mouler les parois de l’œsophage et de l’estomac, qui correspondent à l’interface avec la muqueuse appelée le liseré muqueux (flèches blanches). Le TOGD permet également d’objectiver l’anatomie (forme, taille et position) de l’œsophage, de l’estomac, du bulbe (flèche noire), et du cadre duodénal (double flèche noire). Plusieurs clichés peuvent être réalisés en faisant tourner le patient pour dégager toutes les portions et toutes les faces de l’œsophage, de l’estomac et du cadre duodénal. Astérisque : fundus gastrique.
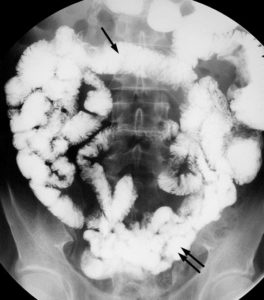
Exemple de transit du grêle.
La lumière des anses jéjunales (flèche noire) et iléales (double flèche noire) est opacifiée par l’ingestion d’une grande quantité de sulfate de baryum. Des clichés comme celui-ci étaient réalisés à intervalles réguliers pour suivre la progression du produit de contraste au travers des anses grêles jusqu’à la dernière anse. Des clichés sous compression dosée et sur différentes incidences pouvaient être réalisés pour étudier le contenu, le calibre et le liseré muqueux de chacune des anses intestinales.
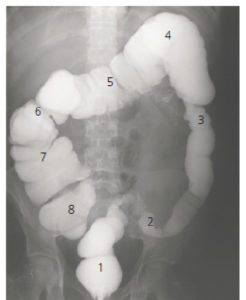
Exemple de lavement opaque.
La lumière de l’ensemble du cadre colique est opacifiée grâce à l’introduction par une canule rectale d’un produit de contraste liquide à base de sulfate de baryum. Les clichés réalisés donnent des informations sur l’anatomie du cadre colique, son calibre et la régularité du liseré muqueux de chacune de ses portions. 1. Rectum ; 2. côlon sigmoïde ; 3. côlon descendant (gauche) ; 4. angle colique gauche ; 5. côlon transverse ; 6. angle colique droit ; 7. côlon ascendant (droit) ; 8. cæcum.
Ces techniques ne permettaient cependant pas d’explorer efficacement les organes pleins. Elles sont, à l’exception du TOGD, toutes remplacées par de l’imagerie en coupes qui permet d’explorer la cavité des organes creux, leurs parois, les organes pleins et l’ensemble de l’atmosphère autour de ces organes (péritoine, graisse rétropéritonéale). Les endoscopies digestives (fibroscopie œso-gastro-duodénale et coloscopie optique) participent également à l’exploration des anomalies de la paroi et de la muqueuse de l’œsophage, de l’estomac, du duodénum et du côlon, permettant de plus la réalisation de biopsies ou d’actes interventionnels.
Ainsi, désormais :
- l’ASP a été remplacé par l’échographie et la TDM abdominales. Il n’est plus indiqué que dans quelques cas (recherche de corps étrangers, surveillance de lithiase rénale, etc.) ;
- le lavement radio-opaque a été largement remplacé par la coloscopie optique et le coloscanner. Il conserve néanmoins quelques indications en pédiatrie ;
- le transit du grêle est totalement remplacé par l’entéroscanner (voir plus loin) et l’entéro-IRM. Des techniques de vidéocapsule ingérées par le patient sont également désormais disponibles ;
- le TOGD conserve des indications ponctuelles, notamment pour la chirurgie bariatrique car l’imagerie en coupes ne remplace pas totalement les informations anatomiques globales (taille, morphologie, position) qu’il peut fournir (voir figure 27.2).
Techniques d’imagerie actuelles
TDM
Cette technique utilise, comme en radiographie, les rayons X. La séméiologie tomodensitométrique est donc fondée sur les quatre densités fondamentales aérique, hydrique, graisseuse et calcique. Elles sont mieux identifiées que sur un ASP car l’image réalise une coupe anatomique et non une image en projection (figure 27.5).
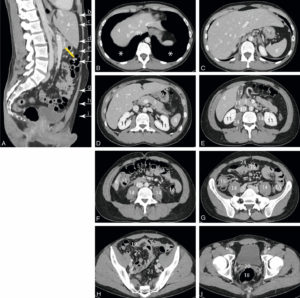
Reconstruction sagittale médiane (A) et coupes horizontales (B-I) de la région abdominopelvienne en TDM après injection intraveineuse de produit de contraste.
La région abdominale est divisée en deux par le plan du mésocôlon transverse (trait jaune), tendu entre le pancréas et le côlon transverse. L’étage sus-mésocolique comprend toutes les glandes annexes du tube digestif et la rate ; l’étage sous-mésocolique contient principalement l’intestin grêle et le côlon. Les lobes inférieurs des poumons sont visibles et sont de densité aérique (astérisque). La cavité péritonéale est normalement virtuelle ; les différents replis du péritoine, correspondant aux lames porte-vaisseaux des organes (mésentère, mésocôlon, omentum), sont de densité graisseuse. Le rachis est de densité osseuse. 1. Aorte ; 2. veine porte ; 3. pancréas ; 4. foie ; 5. côlon transverse ; 6. veines hépatiques ; 7. branche gauche de la veine porte ; 8. rate ; 9. estomac ; 10. veine cave inférieure ; 11. reins ; 12. vésicule biliaire ; 13. duodénum ; 14. muscles grands psoas ; 15. côlon ascendant ; 16. côlon descendant ; 17. côlon sigmoïde ; 18. rectum ; 19. intestin grêle ; 20. récessus rectovésical (Douglas) ; 21. mésocôlon transverse ; 22. mésentère ; 23. mésosigmoïde ; 24. grand omentum (épiploon).
L’injection intraveineuse de produit de contraste iodé sert à rehausser le parenchyme des organes pleins, les vaisseaux et la paroi des anses digestives (figure 27.6). Son rôle est d’apporter une information supplémentaire qui concerne l’importance de la vascularisation des tissus étudiés. Plus le tissu (sain ou pathologique) est vascularisé, plus il « s’imbibera » de produit de contraste et plus il apparaîtra « rehaussé », c’est-à-dire « hyperdense » par rapport à son aspect avant l’injection du contraste. La TDM injectée donne donc des informations sur l’anatomie (image en coupe), sur la composition des organes (grâce aux quatre densités radiologiques) et sur la richesse de leur vascularisation (rehaussement après injection de produit de contraste iodé intraveineux). Il est également parfois nécessaire d’utiliser des produits de contraste spécifiques introduits dans la lumière digestive par ingestion (opacification digestive haute) ou par lavement (opacification digestive basse). Contrairement aux techniques historiques, les produits de contraste digestifs utilisés en TDM ne sont pas toujours des produits radio-opaques (sulfates de baryum ou iode), mais peuvent être des liquides radiotransparents tels que de l’eau ou le CO2. L’ingestion d’eau sert à distendre la lumière intestinale et, associée à l’injection intraveineuse d’un produit de contraste iodé, permet de visualiser les anomalies du rehaussement des parois digestives (tumeurs, ischémie, inflammation).
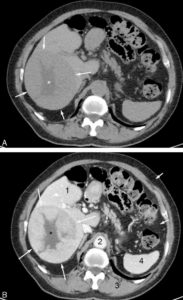
Exemple d’examen tomodensitométrique réalisé avant (A) et après (B) injection de produit de contraste iodé par voie intraveineuse.
Avant injection de produit de contraste, la lésion qui occupe la majeure partie du foie (flèches) présente une densité très proche de celle du parenchyme hépatique adjacent. Seule sa portion centrale apparaît de densité moins élevée (astérisque). Après injection de produit de contraste, les lumières vasculaires telles que l’aorte (2) se rehaussent fortement. Les organes richement vascularisés tels que le foie (1) ou la rate (4) se rehaussent également de façon plus marquée que les structures très peu vascularisées comme le muscle (3) ou les tissus graisseux (flèches courtes). La tumeur (flèches) est moins vascularisée que le foie. Elle est donc mieux visible après injection car elle se rehausse moins que le parenchyme adjacent. Sa portion centrale (astérisque) n’est le siège d’aucun rehaussement visible. Elle est probablement dévascularisée, nécrotique au centre.
Modalités pratiques de réalisation d’une TDM abdominopelvienne
Exploration standard de l’abdomen et du pelvis
L’examen dure entre 5 et 10 minutes (installation du patient comprise). Les patients n’ont pas besoin d’être à jeun sauf en cas d’entéroscanner (voir plus loin). Le patient est placé en décubitus dorsal, puis passe au travers de l’anneau de la TDM au cours de l’examen. Sur les machines modernes, les anneaux sont larges et peu épais. Il n’y a donc le plus souvent pas de problème pour les patients claustrophobes. Selon les indications, l’examen est effectué sans ou après injection intraveineuse de produit de contraste iodé. La décision d’injection est prise par le radiologue responsable de l’examen après recherche des contre-indications (voir chapitre 4). De même, la décision de demander au patient de boire du produit de contraste ou de l’eau pour réaliser un balisage digestif est prise par le radiologue en fonction des anomalies recherchées.
Entéroscanner
L’entéroscanner consiste à positionner une petite sonde flexible (sonde d’entéroclyse) par le nez jusque dans l’angle duodénojéjunal (de Treitz) sous contrôle radioscopique. Branchée sur l’extrémité proximale de cette sonde, une pompe injecte ensuite régulièrement, sans à-coups, environ 1 à 1,5 litre d’eau tiède pour bien remplir la lumière de la totalité des anses grêles jusqu’à la dernière anse iléale. Ce remplissage est indolore et ne prend que quelques minutes. Il est bien toléré si l’extrémité distale est positionnée au-delà de l’angle duodénojéjunal car, dans ce cas, il n’y a pas de reflux d’eau vers l’estomac. Le patient doit être à jeun car le bol alimentaire gêne considérablement la pose de la sonde et l’avancée de l’eau dans la lumière de l’intestin grêle. Des coupes TDM avant puis après injection intraveineuse de produit de contraste iodé permettent enfin d’étudier la totalité de l’intestin grêle en coupes fines : le diamètre des anses intestinales, le liseré muqueux, le rehaussement des parois de l’intestin et l’ensemble des autres organes de la cavité péritonéale (figure 27.7). Cet examen dure 10 à 20 minutes et a définitivement remplacé le transit du grêle. Il existe une variante sans mise en place d’une sonde d’entéroclyse, donc « moins invasive », en faisant boire un mélange eau-macromolécule. Le remplissage des anses est cependant de moins bonne qualité.
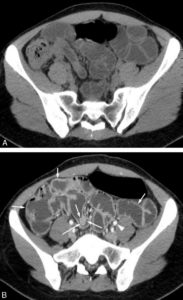
Exemple d’entéroscanner avant (A) et après (B) injection intraveineuse de produit de contraste iodé.
L’instillation par une pompe dans une sonde nasojéjunale placée au-delà de l’angle dudodénojéjunal permet de remplir rapidement d’eau les anses grêles d’eau et de les déplisser. Après injection de produit de contraste, confirmée par l’observation d’un rehaussement net de la lumière des vaisseaux comme l’artère iliaque externe gauche par exemple (tête de flèche), la paroi des anses intestinales vascularisées se rehausse (flèches courtes) et permet de mettre en évidence une tumeur (flèches) développée dans la lumière d’une anse intestinale à partir de la paroi.
Coloscanner ou coloscopie virtuelle
Le coloscanner a désormais remplacé le lavement opaque (en dehors de la pédiatrie). Il consiste à introduire une canule dans le rectum et à insuffler à l’aide d’une pompe du CO2 de façon douce et régulière afin de gonfler le côlon et de distendre ses parois. Une préparation préalable est nécessaire (régime sans résidu et prise de laxatifs pour vider le côlon la veille et jeûne le jour de l’examen) pour que le côlon soit vide de matières fécales. Une fois la distension obtenue (ce qui prend environ 1 minute), des coupes TDM jointives sont effectuées sur l’ensemble du cadre colique. Les pixels qui sont situés à l’interface entre la lumière colique et la paroi du côlon (le liseré muqueux) sont ensuite extraits automatiquement et empilés pour obtenir une reconstruction en 3D du liseré muqueux. Il est ensuite possible, à la manière d’un jeu vidéo, de naviguer de façon virtuelle à l’intérieur de la lumière du côlon ainsi reconstruite. En général, une coloration artificielle destinée à reproduire la couleur de la muqueuse est appliquée aux images, et les images obtenues sont très comparables à celles qui peuvent être vues par coloscopie optique (figure 27.8). La principale différence est que, si un polype ou une tumeur sont identifiés, la coloscopie virtuelle n’en permet ni la biopsie, ni la résection.
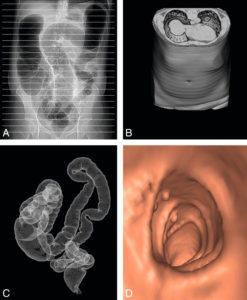
Les différentes étapes de réalisation d’un coloscanner.
Dans un premier temps, le côlon est gonflé par une pompe au CO2 via une canule introduite dans le rectum, puis des coupes tomodensitométriques axiales fines jointives sont réalisées (A). Ces coupes sont empilées les unes sur les autres pour reconstruire l’abdomen et son contenu en 3D (B). De ce volume sont extraits les pixels situés à l’interface entre l’air de la lumière colique et la paroi et qui correspondent aux pixels situés sur le liseré muqueux (C). Il est possible de faire naviguer une caméra virtuelle au sein de la lumière de cette reconstruction de la muqueuse du côlon en appliquant une couleur artificielle à la paroi. L’image obtenue est très similaire à celle d’une endoscopie (D).
IRM
Les séquences utilisées en IRM abdominale sont le plus souvent des séquences pondérées T2 ou T1 avant et/ou après injection de chélates de gadolinium (voir chapitre 8). Les séquences fortement pondérées en T2 sont utiles en IRM abdominale : les liquides non circulants sont en hypersignal (blanc), tout le reste restant en hyposignal (noir). Elles permettent d’étudier les canaux biliaires et pancréatiques et sont appelées séquences de cholangio-IRM (ou bili-IRM). Seuls l’arbre biliaire, la vésicule biliaire et le liquide contenu dans le conduit pancréatique (canal de Wirsung) restent visibles en hypersignal (figure 27.9), permettant de détecter des anomalies de type distension, sténose, présence de calcul dans la lumière des voies biliaires ou des canaux du pancréas.
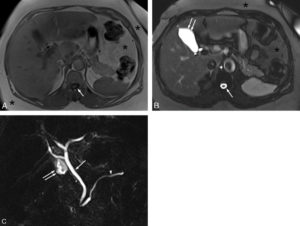
Exemple d’IRM centrée sur la partie haute de l’abdomen en pondération T1 (A), pondération T2 (B) et séquences de cholangio-IRM (C).
En pondération T1 (A), les différents organes explorés (foie, pancréas, rate, etc.) présentent des niveaux de gris intermédiaires. On reconnaît la séquence en pondération T1 car le LCS est noir (flèche). La graisse apparaît en hypersignal relatif (astérisques). Sur la coupe en pondération T2 (B), le LCS (flèche) et le liquide contenu dans la vésicule biliaire (double flèche) sont blancs. Les différents organes qui composent la partie haute de l’abdomen ont des niveaux de gris intermédiaires, légèrement différents de ceux de la coupe en pondération T1. La graisse reste en hypersignal relatif (astérisques). La séquence de cholangio-IRM est une séquence hyperpondérée T2 (C) dans laquelle seuls les liquides stagnants sont blancs. Tout le reste est noir. Cette coupe coronale oblique passe par la voie biliaire principale (flèche), quelques voies biliaires intrahépatiques, le conduit pancréatique (de Wirsung, tête de flèche). On voit également une portion de la vésicule biliaire (double flèche). Cette séquence est très utile pour analyser les processus pathologiques qui peuvent toucher les voies biliaires (sténose, dilatation, calcul, tumeur, etc.).
Pour reconnaître une image en pondération T2, il faut chercher une structure liquidienne (vésicule biliaire, vessie, LCS) et identifier si elle est en hypersignal par rapport à un muscle adjacent (blanche). Le plus simple est de regarder le LCS dans le canal vertébral car il est visible sur toute la hauteur de l’abdomen. Sur les images en pondération T1, les liquides sont en hyposignal (noir) (voir figure 27.9).
Modalités pratiques de réalisation d’une IRM abdominale
L’examen dure entre 15 et 45 minutes. Les patients n’ont pas besoin d’être à jeun, sauf en cas d’entéro-IRM ou de cholangio-IRM. Le patient est placé en décubitus dorsal. Pour les examens abdominaux, le patient sera positionné de façon à ce que son abdomen se situe au centre du tunnel, ce qui peut poser problème chez les patients claustrophobes.
Selon l’indication, l’examen peut requérir une injection intraveineuse de chélates de gadolinium dont l’effet sera le même qu’en TDM avec les produits de contraste iodés, c’est-à-dire obtenir des informations sur la richesse de la circulation sanguine dans chaque tissu. La décision d’injection et le choix des différentes séquences réalisées incombent au radiologue responsable de l’examen en fonction de la pathologie recherchée (ce qui rend une demande d’examen complète indispensable). Les examens d’IRM sont en général centrés sur une région anatomique. L’enregistrement du signal en IRM est réalisé par des antennes dites « de surface » et positionnées au plus près des organes étudiés. Cela signifie que toute la cavité abdominale ou pelvienne n’est pas systématiquement explorée, contrairement à une TDM abdominopelvienne. Une IRM hépatique n’explore pas le pelvis. Une IRM pelvienne ou rénale n’explore pas le foie. Il est possible d’effectuer en IRM un examen global de la cavité abdominopelvienne, mais cela nécessite d’anticiper en plaçant les antennes de surface sur l’ensemble des segments à étudier et cela rallonge le temps d’acquisition.
Échographie
L’échographie permet d’explorer l’abdomen – principalement les organes pleins – en temps réel, sans radiations ionisantes et à un coût moindre qu’en IRM (voir chapitres 7 et 14). L’emploi du Doppler (figure 27.10) et/ou de produits de contraste spécifiques (figure 27.11) (microbulles, voir chapitre 7) est également très utile pour enrichir la séméiologie de l’échographie.
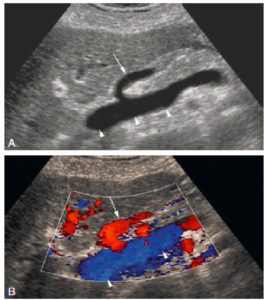
Exemple d’image échographique en mode B (A) et en mode Doppler couleur (B) centrée sur le pédicule hépatique.
En mode B, les vaisseaux circulants apparaissent anéchogènes (ici la veine porte ; têtes de flèche). On note un vaisseau qui vient se jeter dans la veine porte et qui correspond à la veine gastrique gauche (flèche). Le Doppler couleur permet de savoir dans quelle direction circule le flux sanguin. Par définition, les flux codés en bleu s’éloignent de la sonde, et les flux codés en rouge se dirigent vers la sonde. Le flux dans la veine porte s’éloigne donc de la sonde en se dirigeant vers le foie. Le flux dans la veine gastrique gauche se dirige vers la sonde, donc s’échappe de la veine porte pour aller se diriger vers l’estomac, ce qui est pathologique.
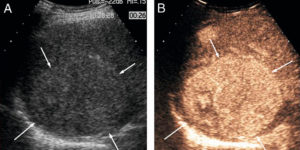
Exemple d’échographie de contraste.
Lésion hépatique (flèches) avant injection de produit de contraste (A) et après injection (B). Avant injection, l’anomalie présente des niveaux de gris quasi identiques au foie adjacent (isoéchogène). Après injection, on observe un rehaussement (ici arbitrairement codé en orange) plus important au sein de la tumeur que du foie alentour car cette lésion est plus richement vascularisée que le foie.
L’échographie permet également de mesurer la souplesse ou la dureté des organes et en particulier du foie. Cette « palpation » échographique s’appelle l’élastométrie ultrasonore ou élastographie. Plus le foie est dur, plus il est fibreux. Il est donc possible, grâce à l’élastographie, de suivre l’évolution des hépatopathies chroniques jusqu’au stade de la cirrhose en évitant le plus possible la réalisation de biopsies hépatiques (figure 27.12).
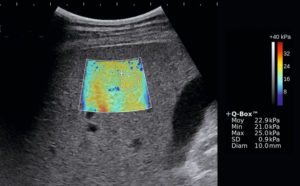
Exemple d’élastographie (ou élastométrie ultrasonore) du foie.
Sur une image du foie en mode B, on positionne une région conique tronquée dans laquelle la machine va émettre des ondes ultrasonores particulières à l’origine de la propagation d’ondes de cisaillement dans le foie. La mesure de la vitesse de propagation de ces ondes de cisaillement par l’échographe renseigne sur la valeur du module de Young, affichée avec une échelle de couleur en chaque point de la zone de mesure et qui correspond à la dureté du tissu. Ici, les valeurs sont élevées (22,9 kPa dans la région d’intérêt ronde), ce qui correspond à un foie très dur de cirrhose.
Modalités de réalisation d’une échographie abdominale
Pour une échographie abdominale, les patients doivent être à jeun depuis 6 heures. En effet, lors du repas, l’ingestion concomitante d’air remplit l’estomac et l’intestin. Or, l’air réfléchit totalement le faisceau ultrasonore. Ainsi, si l’air est abondant dans l’estomac et l’intestin, les structures et les organes pleins situés en arrière sont masqués et l’échographie n’est pas contributive. De plus, si l’échographie est destinée à étudier la vésicule biliaire (pour rechercher un calcul par exemple), un repas récent conduit à une vidange de la vésicule ; elle est alors collabée, ce qui empêche d’étudier son contenu et ses parois. Pour toutes ces raisons, être à jeun signifie ne pas manger mais également ne pas boire d’eau ou de café, ne pas fumer et ne pas mâcher de chewing-gum (c’est-à-dire toute action qui entraîne une déglutition accrue de salive et donc d’air).
La sonde échographique utilisée est une sonde basse fréquence, autour de 3,5 MHz, pour étudier des organes volumineux et/ou profonds. Le patient est habituellement placé en décubitus dorsal, mais l’examen peut être pratiqué dans n’importe quelle position, y compris assis ou debout pour permettre à l’opérateur d’accéder aux organes intra- ou rétropéritonéaux. La durée d’un examen varie de 5 à 30 minutes selon la complexité des anomalies recherchées.
Séméiologie de base en imagerie abdominale
Cette séméiologie est fondée sur l’étude des quatre densités radiologiques, l’étude de l’échostructure en échographie, du signal en IRM ainsi que sur l’emploi des produits de contraste intraveineux et les opacifications digestives.
Péritoine
Pneumopéritoine
La présence de clartés aériques dans la cavité abdominale en dehors de la lumière du tube digestif définit un pneumopéritoine. Elle peut refléter soit la perforation d’un organe creux (tube digestif), soit le passage d’air depuis l’extérieur restant piégé dans la cavité abdominale (traumatisme pénétrant, chirurgie récente). Un pneumopéritoine est identifié avec les meilleures sensibilité et spécificité en TDM, sous la forme d’images de densité aérique généralement piégées dans les zones les plus antérieures chez un sujet en décubitus dorsal (sous la paroi abdominale, en avant du foie, sous le ligament rond, proche du lit vésiculaire notamment). La TDM est incontournable pour la détection d’une perforation digestive débutante (figure 27.13).
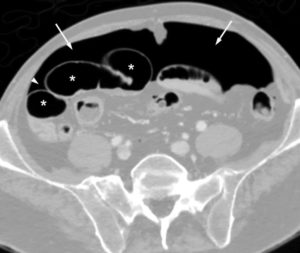
Pneumopéritoine en TDM.
La coupe transversale anatomique permet de localiser avec précision les plages de densité aérique. Certaines sont situées dans la lumière des anses digestives, de façon physiologique (astérisques) ; d’autres sont situées en dehors des anses digestives (flèches), ce qui correspond à un pneumopéritoine et donc à la perforation du tube digestif. La topographie extradigestive de l’air est affirmée par la constatation d’un angle aigu avec les parois des anses digestives (tête de flèche).
Ascite
L’ascite correspond à l’accumulation de liquide dans l’espace normalement virtuel de la cavité péritonéale. En échographie, sa présence est détectée sous forme d’un liquide anéchogène (figure 27.14A) ou faiblement échogène. Son accumulation déclive fait que le liquide intrapéritonéal est d’abord retrouvé dans le récessus rectovésical (de Douglas) ou dans les gouttières pariétocoliques. En TDM, l’épanchement se traduit par des plages de densité liquidienne visibles autour des organes, dans la cavité péritonéale qui ne se rehaussent pas après injection intraveineuse de produit de contraste iodé. En l’absence d’injection, les limites entre les organes (de densité hydrique) et de l’ascite (de densité hydrique) ne sont pas toujours identifiables et une ascite peu abondante peut être méconnue (figure 27.14B).
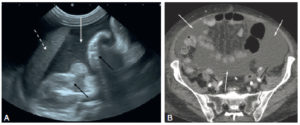
Ascite en échographie et en TDM.
En échographie (A), une coupe longitudinale passant par le bord inférieur du foie (flèche en pointillés). L’ascite est hypoéchogène (flèche blanche) et les anses digestives (flèches noires) sont visibles dans le liquide. En TDM (B), en coupe axiale après injection de produit de contraste iodé par intraveineuse (comme le montre le rehaussement des lumières vasculaires des artères iliaques) (flèches noires), on observe autour des anses digestives dont les parois sont rehaussées ou qui contiennent de l’air, une plage de densité hydrique (flèches blanches) qui correspond à un épanchement intrapéritonéal.
Infiltration de la graisse péritonéale
L’infiltration de la graisse péritonéale se traduit par une augmentation de densité des tissus graisseux infiltrés par du liquide, réalisant un aspect voilé de la graisse, dont les contours sont flous, avec une densité intermédiaire entre du tissu graisseux pur et du tissu hydrique pur.
Cet aspect signe une inflammation de la graisse qui a souvent pour origine une inflammation d’un organe situé à proximité (voir chapitre 18). Identifier une infiltration et sa topographie suffit souvent à obtenir une orientation diagnostique. Par exemple, une infiltration de la graisse dans l’hypochondre droit doit faire rechercher une affection vésiculaire (figure 27.15) ; en fosse iliaque droite, une pathologie appendiculaire ; en fosse iliaque gauche, une affection diverticulaire ; autour du pancréas, une pancréatite, etc.
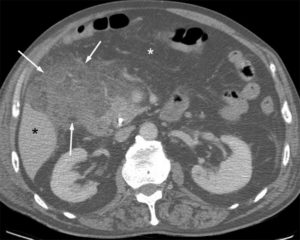
Aspect caractéristique d’une infiltration inflammatoire de la graisse des mésos (flèches) réalisant une augmentation de densité du tissu graisseux sous la forme d’un voile de densité intermédiaire entre la graisse pure (astérisque blanc) et la densité hydrique (astérisque noir).
La topographie de cette infiltration inflammatoire renseigne sur l’organe touché. Il s’agit ici d’une infiltration située à la face inférieure du foie dans l’hypochondre droit consécutive à une cholécystite aiguë non visible sur cette coupe.
On peut alors rechercher les signes directs de l’inflammation (recrutement inflammatoire avec hyperhémie et œdème) de l’organe intra-abdominal responsable de l’infiltration de la graisse péritonéale qui sont :
- la vésicule biliaire : un épaississement des parois de la vésicule biliaire supérieur à 3 mm lors d’une cholécystite aiguë ;
- l’appendice : un épaississement des parois de l’appendice supérieur à 3 mm lors d’une appendicite aiguë ;
- le tube digestif : un épaississement des parois du côlon lors d’une colite (voir plus loin « Anomalies de la paroi digestive »).
Tube digestif
Dysphagie
En imagerie, la sensation de blocage des aliments est explorée par une opacification digestive haute ou TOGD qui consiste en l’ingestion d’un produit de contraste. L’analyse sémiologique des images élémentaires est présentée en figure 27.16.
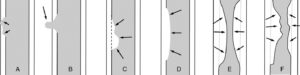
Images d’addition (A, B) et de soustraction (C-F) en TOGD.
Les images d’addition sont définies par un débord du produit de contraste au-delà du liseré muqueux supposé (flèches). Ce débord peut être limité à l’épaisseur de la paroi et correspond plutôt à une ulcération (A). Il peut également être plus régulier et faire une hernie au-delà de la paroi qui correspond à un diverticule (B). Les images de soustraction sont définies par une absence d’opacification au contact du liseré muqueux supposé (flèches). Lorsque le refoulement a des bords irréguliers (C), cela témoigne plutôt du développement sur la paroi d’une tumeur maligne. Le refoulement régulier du produit de contraste par rapport à la ligne théorique du liseré muqueux avec des angles obtus évoque un processus bénin (D). Les sténoses sont des rétrécissements de la lumière du tube digestif. Ces rétrécissements peuvent être centrés, longs et réguliers (E) (flèches). Dans ce cas, cela évoque une atteinte bénigne. Les sténoses peuvent être plus courtes, irrégulières et excentrées (F) (flèches) ; l’aspect est évocateur d’une tumeur maligne.
Le TOGD permet par ailleurs une analyse dynamique du passage du bol de produit de contraste et de différencier les dysphagies organiques des dysphagies fonctionnelles (par atteinte motrice de l’œsophage). Une fibroscopie œsophagienne (avec biopsies) et une TDM sont indispensables lorsqu’il existe une tumeur de l’œsophage.
Enfin, si une compression extrinsèque est suspectée, une TDM thoracique avec injection est réalisée.
Syndrome occlusif
L’air est normalement situé dans la lumière du tube digestif (de l’œsophage jusqu’au rectum). Il est réparti de manière harmonieuse au sein du tube digestif.
Une distension des anses digestives est un signe de mauvaise progression du bol alimentaire et peut, lorsqu’elle est segmentaire, témoigner d’un syndrome occlusif, c’est-à-dire de l’arrêt complet du transit intestinal. La répartition de l’air digestif et le diamètre des anses digestives sont donc des éléments séméiologiques fondamentaux en imagerie de l’abdomen.
Les niveaux hydroaériques (NHA) témoignent d’une stagnation concomitante d’air et de liquide au sein d’une anse digestive. La présence d’un NHA dans l’estomac est physiologique : après un repas, l’estomac est rempli de liquide et l’air surnage dans le fundus en position debout. La présence de NHA en dehors de l’estomac doit faire rechercher des signes d’arrêt du transit car, dans le tube digestif, une stase liquidienne et aérique survient si le péristaltisme des anses digestives disparaît (iléus réflexe, iléus postopératoire, ischémie, etc.), ou le plus souvent en amont d’un obstacle et donc une occlusion du grêle ou du côlon (figure 27.17). Ainsi, une distension significative des anses grêles (au-delà de 30 mm) combinée avec des NHA évoque une occlusion digestive. En imagerie de coupe (échographie, TDM, IRM), les NHA sont facilement identifiés. La position en décubitus dorsal, dans laquelle sont classiquement réalisées ces imageries de coupe, fait rechercher de l’air en position antérieure, car le liquide s’accumule dans les zones déclives.
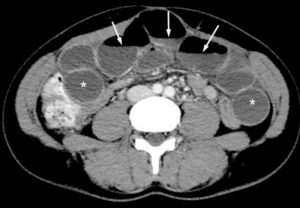
Niveaux hydroaériques en TDM sur une coupe axiale après injection de produit de contraste.
Les niveaux hydroaériques sont reconnaissables sous la forme d’une ligne parfaitement horizontale (flèches) limitant en haut des clartés aériques, et en bas des densités hydriques. On observe par ailleurs que les anses grêles sont dilatées et pleines de liquide (astérisques) ; l’ensemble signe une stagnation du liquide et de l’air dans l’intestin, et donc une occlusion.
La cause d’un NHA dans la vessie est soit une fistule entre la vessie et le tube digestif, soit un sondage vésical qui a introduit de l’air.
Anomalies de la paroi digestive
La paroi digestive est analysable en échographie. Il existe une alternance de couches hyper- et hypoéchogènes correspondant aux couches muqueuse, sous-muqueuse et musculeuse. Cet aspect est modifié en cas d’anomalie. Cependant, l’échographie de la paroi du tube digestif n’est informative que chez le patient mince et chez l’enfant.
La paroi digestive est plus couramment étudiée en TDM. La paroi est une structure fine, en règle générale de moins de 3 mm, de densité tissulaire qui se rehausse après injection de produit de contraste. L’épaisseur et le rehaussement des anses au temps portal (ou parenchymateux) sont modifiés en cas de processus ischémique, inflammatoire, infectieux ou tumoral (figure 27.18).
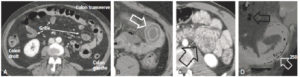
Aspects normaux et anormaux de la paroi des anses digestives en TDM.
A. Épaisseur et rehaussement normaux de la paroi des anses grêles et du côlon en coupe axiale. Noter qu’en fonction de leur degré de remplissage, les anses n’ont pas le même diamètre, ni le même aspect sur cet examen standard, réalisé sans remplissage de la lumière digestive. B. Aspect en cible de la paroi d’une anse grêle dans la fosse iliaque gauche : la muqueuse se rehausse fortement par rapport au muscle de la paroi abdominale et par rapport à la sous-muqueuse qui est œdématiée et à la séreuse (flèche blanche). Cet aspect est en rapport avec des anomalies inflammatoires, infectieuses ou ischémiques. C. Hypervascularisation d’anses grêles (flèche noire) dans le cadre de troubles de la perfusion vasculaire : la paroi se rehausse globalement de façon plus marquée que la paroi musculaire abdominale, réalisant un aspect « blanc » de la paroi. D. Pneumatose pariétale d’une anse grêle : l’aspect de la paroi est globalement noir en raison de la présence de bulles d’air dans l’épaisseur de la paroi (densité autour de –1000 = air) (flèche blanche). Noter la présence de bulles d’air dans le mésentère (aéromésentérie) (flèche noire).
Foie et voies biliaires
Calculs vésiculaires
Les calculs sont des formations cristallines ou non développées dans des cavités ou des canaux (vésicule biliaire, voies biliaires, voies urinaires, vessie). Ils peuvent être ronds ou plus irréguliers.
En radiographie et en TDM, les calculs, lorsqu’ils sont calciques, entraînent une forte atténuation des rayons X – générant ainsi une opacité en radiographie ou une image hyperdense en TDM. Il est important de savoir que les calculs biliaires ne sont cependant pas toujours calcifiés. Ils sont alors invisibles en TDM. Le meilleur examen pour détecter des calculs biliaires est l’échographie. En échographie, les calculs sont hyperéchogènes, avec une atténuation postérieure également appelée cône d’ombre postérieur (figure 27.19).
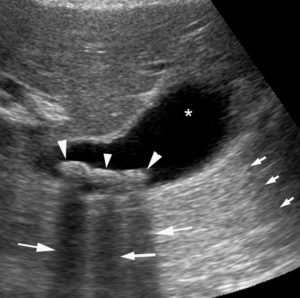
Aspect d’un calcul vésiculaire en échographie.
Le contenu de la vésicule biliaire est principalement anéchogène (astérisque), responsable d’un renforcement postérieur (flèches courtes), ce qui témoigne du contenu liquidien de sa lumière. On observe aussi trois formations hyperéchogènes (têtes de flèche) responsables de trois cônes d’ombre postérieur (flèches longues). Il s’agit de trois calculs vésiculaires.
Anomalies des voies biliaires
Lorsque les voies biliaires sont dilatées, elles apparaissent en échographie sous la forme d’une structure tubulée de contenu anéchogène. L’obstacle en aval de la dilatation est parfois identifiable en échographie (calcul, tumeur des voies biliaires).
Lorsqu’une lésion tumorale est suspectée, on s’oriente vers la TDM abdominopelvienne avec injection.
Enfin, la cholangio-IRM permet d’analyser le calibre des voies biliaires ; la présence de sténoses multifocales, d’épaississements pariétaux et de dilatations de l’arbre biliaire est évocatrice d’une inflammation plus que d’une tumeur (cholangite sclérosante).
Surcharge hépatique
Il existe deux grandes anomalies de surcharge : une surcharge en graisse appelée aussi stéatose et une surcharge en fer.
Stéatose
La stéatose correspond à une surcharge du foie en graisse. La graisse étant hyperéchogène (plus blanche que le tissu sur l’image échographique), une surcharge en graisse du parenchyme hépatique se traduit par un aspect plus blanc (figure 27.20A). En TDM, la graisse étant hypodense, une stéatose hépatique se traduit par une diminution de la densité du foie par rapport à la rate (figure 27.20B). L’IRM hépatique est le meilleur examen pour étudier l’importance d’une stéatose car il existe des séquences particulières (spectroscopie, Dixon) qui permettent de quantifier de la graisse contenue dans le foie (figure 25.20C, D) et d’éviter ainsi une biopsie hépatique.
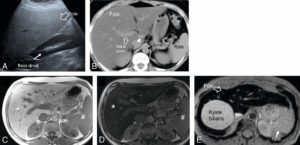
Aspects en imagerie des surcharges hépatiques.
A. Stéatose hépatique en échographie sur une coupe longitudinale passant par le foie et le rein droit : le parenchyme hépatique (flèche creuse) est plus hyperéchogène car plus riche en graisse que le parenchyme rénal (flèche pleine). B. Stéatose hépatique en coupe axiale en TDM après injection de produit de contraste au temps portal : le parenchyme hépatique est plus hypodense que la rate car il contient de la graisse qui diminue sa densité. C, D. IRM avec séquence Dixon. On observe une nette chute de signal du parenchyme hépatique (astérisque) sur l’image obtenue en opposition de phase (D) par rapport à la même image obtenue en phase (C). Cette chute de signal signe la présence d’une stéatose qui peut être quantifiée (ici 18 %). Noter que l’intensité du signal de la rate (#) n’est pas modifiée entre les deux images en phase et en opposition de phase car elle ne contient pas de graisse. E. Surcharge hépatique en fer en IRM en coupe axiale en pondération T2. Le foie présente un hyposignal (un aspect noir) très marqué en rapport avec une importante surcharge en fer. Noter par comparaison l’aspect en hypersignal du kyste biliaire et en isosignal de la rate qui ne contiennent pas de fer.
Surcharge en fer
Une surcharge en fer du foie n’est pas détectable échographiquement. L’IRM est la méthode aujourd’hui de référence pour estimer la surcharge en fer hépatique. Le fer perturbe le champ magnétique local en IRM et induit une chute du signal sur les séquences T2 dans le parenchyme (figure 27.20E). Plus cette chute est importante, plus la surcharge en fer est importante, ce qui permet sa quantification sans qu’une biopsie hépatique soit nécessaire.
Syndrome tumoral
Lésions kystiques
En échographie, les formations de contenu liquidien pur sont anéchogènes avec un renforcement postérieur des ultrasons (figure 27.21). L’échographie est une des rares techniques qui permette d’affirmer avec certitude qu’une formation présente un contenu liquidien. L’aspect anéchogène avec renforcement postérieur est rencontré pour toute formation liquidienne, qu’il s’agisse d’une structure anatomique (vésicule biliaire, vessie) ou d’une formation pathologique (kyste ou tumeur liquidienne).
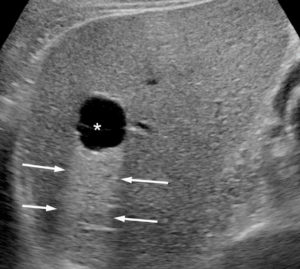
Exemple de kyste hépatique en échographie.
Au centre du foie, on identifie une formation anéchogène (astérisque). En arrière de cette formation, il existe un net renforcement du faisceau ultrasonore (flèches). Il s’agit donc d’une image liquidienne pure ; c’est un kyste bénin du foie.
Seule l’IRM avec des séquences en pondération T2 est capable de fournir des informations similaires sur le caractère purement liquidien d’une lésion (figure 27.22).
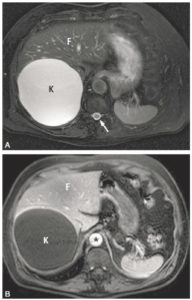
Exemple d’IRM en pondération T2 (A) et T1 (B) du foie (F).
La séquence en pondération T2 est reconnue car le LCS est en hypersignal (flèche). À la face postérieure du foie, on observe une volumineuse formation en franc hypersignal T2 et en franc hyposignal T1 (K). La séquence en pondération T1 a été effectuée après injection de produit de contraste, comme en témoigne le rehaussement de la lumière de l’aorte (astérisque). Cela a permis de confirmer que cette formation n’était le siège d’aucune prise de contraste. Cette formation est donc une formation liquidienne pure qui correspond à un kyste bénin.
Lésions solides
En échographie, les formations solides renvoient à un large spectre d’anomalies (tumeurs bénignes, tumeurs malignes, infections). Elles sont identifiées par des différences d’échogénicité et d’échostructure avec les organes adjacents dans lesquels elles se développent. Elles sont le plus souvent hypoéchogènes sans modification du faisceau d’ultrasons en arrière (figures 27.23 et 27.24).
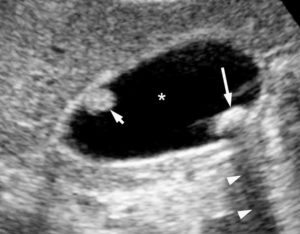
Coupe échographique de la vésicule biliaire : le contenu vésiculaire est principalement anéchogène (astérisque), avec un calcul (flèche longue) qui présente un cône d’ombre postérieur (têtes de flèche).
Accroché à sa paroi antérieure (la plus haute sur l’image), il existe une formation moins hyperéchogène que la précédente, isoéchogène par rapport à la paroi de la vésicule biliaire (flèche courte). Elle n’est pas déclive et ne génère aucun cône d’ombre en arrière. Il ne s’agit donc pas d’un calcul mais d’une formation tissulaire qui correspond ici à un polype bénin.
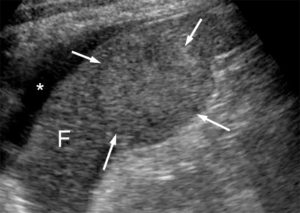
Coupe échographique du foie (F).
Autour du foie, le long de sa face antérieure, on note une lame de liquide anéchogène (astérisque). Au sein du parenchyme hépatique, on retrouve une lésion tumorale isoéchogène au foie adjacent (flèches) et qui n’est visible que parce qu’elle déforme les contours de la face inférieure du foie. Il s’agit d’une métastase hépatique de mélanome.
Devant une lésion solide (ou tissulaire), l’injection d’un produit de contraste est essentielle car l’intensité du rehaussement de la lésion reflète l’importance de sa vascularisation et c’est souvent cette information qui permet de distinguer les lésions entre elles. Cette injection de produit de contraste peut être réalisée en échographie (utilisation de microbulles) (voir chapitre 7), mais ce sont surtout l’imagerie par TDM et celle par IRM qui sont utilisées. On décrit ainsi des lésions hypervascularisées ou hypovascularisées par rapport aux organes adjacents (voir figure 27.5). Les formations liquidiennes strictes, kystiques, ou des épanchements, seront de densité liquidienne avant injection et ne présentent aucun rehaussement après injection.
La séméiologie en IRM est fondée sur l’analyse du contraste obtenu par une combinaison de séquences en pondération T1 et T2 et des séquences après injection de produit de contraste (figure 27.25). L’IRM est plus sensible que la TDM pour détecter le rehaussement des structures faiblement vascularisées, ce qui rend l’IRM plus performante que la TDM pour caractériser la vascularisation des tumeurs.
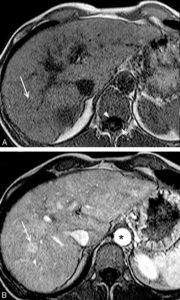
Exemple d’IRM en pondération T1 du foie avant (A) et après (B) injection intraveineuse de chélates de gadolinium.
La séquence T1 est reconnue car le LCS est noir (têtes de flèche). L’injection de gadolinium est reconnue car la lumière de l’aorte devient blanche (astérisque). Au sein du parenchyme hépatique, on identifie après injection un nodule (B, flèche) qui est plus rehaussé que le foie adjacent. Ce nodule était invisible avant injection. Il existe donc une petite tumeur hépatique plus vascularisée que le foie adjacent.
Enfin, certaines séquences spécifiques sont réalisées pour obtenir une information fonctionnelle : les séquences de diffusion, qui sont dérivées des séquences T2 permettent d’apprécier le degré de cellularité dans une région du corps en étudiant les mouvements protoniques à l’échelle du voxel.
Principales indications en imagerie abdominale
Principales indications de l’échographie
L’échographie est une technique d’imagerie très efficace pour l’étude :
- des organes pleins de l’abdomen (foie, rate, pancréas, reins) et, comme on l’a vu plus haut, pour rechercher des calculs biliaires ;
- de la progression de la fibrose présente dans le foie dans le cadre des hépatopathies chroniques grâce à l’élastographie ultrasonore, ce qui limite le recours aux biopsies hépatiques ;
- du tube digestif car son caractère « temps réel » permet de montrer le péristaltisme digestif et d’étudier l’épaisseur de la paroi ;
- des structures anatomiques contenant physiologiquement du liquide (vésicule biliaire, voies biliaires, vessie) et pour les lésions kystiques ;
- du sens et de la vitesse de la circulation sanguine artérielle et veineuse grâce aux Dopplers pulsé et couleur.
La limite de l’échographie tient à la présence de structures osseuses ou de structures contenant de l’air qui renvoient la totalité du faisceau ultrasonore vers la sonde et génèrent un cône d’ombre acoustique. Son utilisation est limitée chez les patients en surpoids.
Principales indications de la TDM
La TDM sans et/ou avec injection intraveineuse de produit de contraste iodé permet une imagerie en coupe de la totalité de l’abdomen. La TDM est particulièrement utile pour :
- l’étude des organes pleins et des organes creux (entéroscanner, coloscanner), et pour la recherche d’air extradigestif – d’où l’intérêt de la TDM dans l’imagerie des urgences digestives ;
- l’étude de la vascularisation des organes et donc la détection de lésions dont la vascularisation diffère de celle des organes sains (détection de lésions tumorales avec angiogenèse, caractérisation de leur vascularisation, détection de zones d’ischémie ou d’inflammation) ;
- l’étude des vaisseaux de l’abdomen à la recherche d’anomalies de diamètre (anévrisme) ou des réductions de calibre des vaisseaux (sténoses) ;
- la recherche de lésions traumatiques, ou de plaies pénétrantes.
Principales indications de l’IRM
Le contraste tissulaire est mieux étudié en IRM qu’en TDM (T1, T2, caractérisation de la graisse et des liquides, etc.), ce qui fait de l’IRM un examen plus performant que la TDM et l’échographie pour la caractérisation des lésions kystiques et solides se développant dans l’abdomen, en particulier dans le foie et le rectum.
Par ailleurs, l’IRM n’étant pas irradiante, elle est préférée à la TDM pour le suivi au long cours des entéropathies inflammatoires chroniques qui nécessitent des examens répétés.
Enfin, les séquences cholangiographiques sont complémentaires de l’échographie et de la TDM pour l’étude des voies biliaires et du pancréas.
Description et indications des examens de médecine nucléaire
La médecine nucléaire utilise des particules ou molécules marquées par un isotope radioactif, appelées médicaments radiopharmaceutiques (MRP), administrées aux patients pour révéler des processus physiopathologiques.
En ce qui concerne l’abdomen, l’imagerie nucléaire peut être classée en trois types d’explorations :
- les études dynamiques des transits digestif et hépatobiliaire ;
- les suivis cellulaires ;
- les études métaboliques ou moléculaires ciblées.
Études dynamiques des transits digestifs
Ce sont des examens anciens et peu connus car actuellement souvent remplacés par les explorations endoluminales (endoscopies). Néanmoins, ces examens peuvent toujours être réalisés, dans des services de médecine nucléaire spécialisés, dans des cas particuliers lorsque les explorations conventionnelles n’ont pas répondu à la question posée. Parmi ces examens, il existe :
- la scintigraphie explorant les reflux gastro-œsophagiens permettant, en condition physiologique, de quantifier la fréquence et les volumes des reflux ainsi que de rechercher des inhalations ;
- les études des motricités digestives permettant d’explorer le péristaltisme œsophagien, colique et la vidange gastrique ;
- la scintigraphie du transit hépatobiliaire qui permet d’évaluer la fonction hépatique, globale et segmentaire, par l’administration de la mébrofénine marquée au 99mTc, dont l’élimination purement hépatique suit le même transit que la bilirubine sans réabsorption (figure 27.26). Cette scintigraphie peut être demandée pour prédire la fonction hépatique d’un foie restant après chirurgie ou radiothérapie.
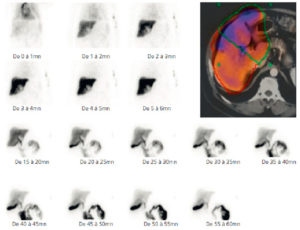
Images dynamiques d’une scintigraphie hépatobiliaire normale.
Captation hépatique du MRP et cinétique d’excrétion satisfaisantes (sans retard), suivie d’un passage digestif dans un délai normal du radiopharmaceutique. Image tomoscintigraphique en coupe axiale fusionnée à une TDM (image en couleur) permettant une segmentation du foie droit et gauche pour des mesures respectives de clairances.
Suivis cellulaires
Scintigraphie splénique
Cet examen consiste à prélever des hématies du patient, à les vieillir artificiellement en les chauffant à 49 °C, les marquer in vitro au 99mTc, puis à les réinjecter au patient. Il a pour but d’explorer la séquestration, par le parenchyme splénique fonctionnel, des hématies fragilisées (figure 27.27). Il peut être demandé pour caractériser une formation tissulaire apparue chez un patient splénectomisé en cas de suspicion de splénose (repousse d’une rate).
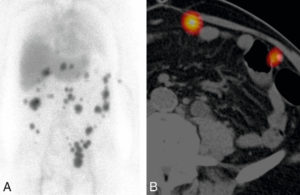
Image d’une scintigraphie splénique chez un patient présentant de multiples formations tissulaires abdominales apparues dans les suites d’une splénectomie.
Image d’une scintigraphie splénique en projection abdominale (A) : multiples lésions tissulaires intra-abdominales responsables d’une séquestration des hématies fragilisées radiomarquées, confirmant leur nature splénique (splénose abdominale). Image scintigraphique en coupe axiale fusionnée à une TDM (B).
Recherche scintigraphique d’une hémorragie chronique
Cet examen est demandé exceptionnellement pour localiser le site d’un saignement occulte digestif. Il consiste à marquer les hématies du patient in vivo ou in vitro au 99mTc pour localiser une radioactivité extravasculaire, digestive, témoignant d’un saignement actif.
Scintigraphie aux leucocytes marqués
Cet examen consiste à prélever les leucocytes du patient, les marquer in vitro avec de l’111In, puis à les lui réinjecter pour rechercher une accumulation digestive des leucocytes montrant une inflammation active en cas de maladie inflammatoire chronique de l’intestin (Crohn ou rectocolite hémorragique), ou une accumulation vasculaire révélant une inflammation et/ou un processus infectieux d’un anévrisme, d’une valve ou d’une prothèse.
Étude scintigraphique de la cinétique des plaquettes
Cet examen consiste à prélever les plaquettes du patient, les marquer in vitro avec de l’111In, puis à les lui réinjecter pour confirmer le site splénique de destruction des plaquettes chez les patients atteints d’un purpura thrombopénique idiopathique, avant d’envisager une splénectomie.
Études métaboliques et moléculaires ciblées
Ces études représentent la très grande majorité des imageries nucléaires digestives réalisées en pratique clinique. Elles ont pour objectif de caractériser l’activité et l’évolutivité d’une maladie tumorale ou inflammatoire, d’aider au diagnostic histologique de lésions tumorales, de participer au bilan d’extension des maladies inflammatoires et/ou tumorales, d’évaluer précocement l’efficacité des traitements. Comme pour le reste du corps, on utilise largement la TEP.
TEP au 18F-FDG
La TEP au 18F-FDG étudie le métabolisme glucidique (figure 27.28). Celui-ci est majoré dans les maladies tumorales et souvent corrélé à l’évolutivité de la maladie. Le métabolisme glucidique permet également d’observer les phénomènes inflammatoires. Cette TEP est donc utile pour caractériser l’évolutivité d’une lésion et pour rechercher par l’étude du métabolisme d’autres tumeurs ou inflammations.
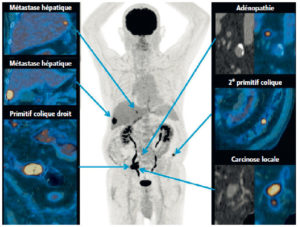
Évaluation métabolique en TEP au 18F-FDG d’un cancer du côlon droit.
L’étude métabolique permet d’évaluer l’extension de la maladie.
TEP aux analogues de la somatostatine radiomarqués
C’est une imagerie moléculaire ciblée qui permet de rechercher une surexpression des récepteurs à la somatostatine (figure 27.29). Ces récepteurs cellulaires à la somatostatine sont souvent surexprimés par certains tissus, en particulier les tumeurs neuroendocrines. Ces examens permettent donc d’aider au diagnostic et au bilan d’extension des tumeurs neuroendocrines.
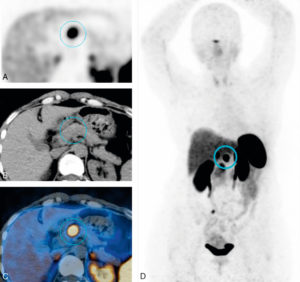
Évaluation moléculaire en TEP aux analogues de la somatostatine radiomarqués au 68Ga d’une lésion pancréatique.
L’intense fixation des analogues de la somatostatine témoigne d’une surexpression des récepteurs à la somatostatine par la lésion, caractéristique d’une tumeur neuroendocrine.
TEP à la 18F-DOPA (précurseur dopaminergique)
Cette imagerie métabolique recherche un métabolisme anormal des catécholamines. Cet examen permet donc d’aider au diagnostic histologique et de participer au bilan d’extension de tumeurs qui produisent des catécholamines (dérivées du neuroectoderme ou, pour certaines, de l’endoderme).
TEP à la 18F-Choline (précurseur des phospholipides membranaires)
La TEP à la 18F-Choline (18F-FCH) étudie le métabolisme lipidique membranaire témoignant indirectement du métabolisme cellulaire (renouvellement membranaire) et de la prolifération cellulaire (synthèse de nouvelles membranes). Ce MRP a la particularité d’être fortement métabolisé par les carcinomes hépatocellulaires bien différenciés. Ainsi, la TEP à la18F-FCH peut être indiquée pour la caractérisation d’une lésion hépatique, notamment la caractérisation pronostique des patients atteints d’un carcinome hépatocellulaire avant transplantation hépatique.
Essentiel à retenir
- L’imagerie de l’abdomen est en pleine mutation et les techniques d’imagerie historiques reposant sur les rayons X en projection (radiographies) et sur les opacifications digestives (lavement, transit du grêle) ont désormais laissé la place aux techniques d’imagerie en coupes (TDM, IRM et échographie).
- L’imagerie en coupes sert à l’exploration des organes pleins, de l’intestin grêle et de la paroi du côlon, en cas d’échec ou en complément de l’endoscopie.
- L’injection intraveineuse de produit de contraste permet d’enrichir considérablement la séméiologie et les possibilités diagnostiques de la TDM, de l’IRM mais également de l’échographie en étudiant la vascularisation des organes et des processus pathologiques.
- Pour un résultat équivalent, il est toujours préférable de remplacer l’imagerie par rayons X par une technique d’imagerie n’exposant pas aux rayonnements ionisants telle que l’échographie ou l’IRM. L’échographie est utilisée en première intention pour explorer l’abdomen, suivie de la TDM.
- L’IRM est plus onéreuse et moins disponible. Elle doit être réservée à la résolution des problèmes qui persistent après réalisation d’une échographie et/ou d’une TDM. L’IRM est rarement un examen de première intention pour explorer l’abdomen sauf pour les cancers du rectum.
- L’imagerie nucléaire recherche et étudie des phénomènes métaboliques ou cibles moléculaires (selon les MRP utilisés) pathologiques. Couplée à une TDM, elle permet de localiser et de souvent décrire morphologiquement l’anomalie repérée.
 |
Chapitre suivant |
 |
Retour au sommaire |
