Les fondamentaux – Chapitre 31 – Imagerie pédiatrique
E. Blondiaux , C. de Labriolle-Vaylet et I. Keller-Petrot
Plan du chapitre
- Radioprotection
- Ostéoarticulaire
- Système nerveux central
- Abdomen
- Appareil urinaire
- Fœtus
- Thorax
- Communication
Objectifs
- Radioprotection :
- connaître la vulnérabilité des enfants aux radiations ionisantes ;
- connaître les indications des différentes modalités et leur pertinence en fonction de l’indication et de l’âge de l’enfant.
- Ostéoarticulaire :
- connaître les particularités anatomiques du squelette de l’enfant ;
- avoir des notions en radiologie conventionnelle de croissance et de maturation osseuse ;
- connaître les principales méthodes de détermination de la maturation osseuse ;
- reconnaître les signes en faveur d’une fracture chez un enfant.
- Neurologie :
- connaître les indications et les limites de l’échographie et de l’imagerie par résonance magnétique (IRM) dans l’exploration de l’encéphale et de la moelle chez le nourrisson.
- Digestif :
- connaître les indications et les limites de l’échographie, de la tomodensitométrie (TDM), de l’IRM et des opacifications digestives dans l’exploration de l’abdomen de l’enfant ;
- connaître l’intérêt de l’échographie dans l’exploration du tube digestif de l’enfant.
- Urinaire :
- connaître les particularités de l’échographie urinaire de l’enfant.
- Fœtus :
- connaître les différentes modalités d’imagerie pour l’exploration du fœtus.
- Thorax :
- reconnaître la présence du thymus sur une radiographie du thorax.
- Communication :
- expliquer à l’enfant ou l’adolescent et à ses parents les modalités de réalisation des examens, à partir de notion de durée, de contention, de sédation et d’analgésie, de risque lié à l’exposition aux rayonnements ionisants ;
- établir une relation de confiance avec l’enfant et ses parents en vue de la réalisation de l’examen.
L’imagerie chez l’enfant est différente de l’imagerie chez l’adulte car elle s’adresse à un organisme en développement et en transformation constante.
L’interprétation d’un examen est nuancée par l’âge et par le contexte clinique, dont l’intérêt est primordial en imagerie pédiatrique. De façon conventionnelle, les définitions utilisées en fonction de l’âge de l’enfant sont les suivantes :
- nouveau-né : des premières heures de vie au 28e jour de vie ;
- nourrisson : du 28e jour de vie à 2 ans ;
- enfant : de 2 ans à l’adolescence ;
- adolescent : entre 10–12 ans jusqu’à 18 ans.
Nous abordons dans ce chapitre les notions importantes de radioprotection, de réalisation des examens ainsi que certaines spécificités de l’imagerie pédiatrique en radiologie et en médecine nucléaire.
Radioprotection
Les principes de base de la radioprotection que sont la justification des examens et leur optimisation doivent être appliqués en pédiatrie avec beaucoup de rigueur, la radiosensibilité des enfants étant plus grande que celle des adultes. Les cellules en croissance rapide seraient en effet plus radiosensibles que les cellules quiescentes (voir chapitre 6). En médecine nucléaire, intervient aussi le rôle de la proximité des organes les uns par rapport aux autres ; une activité volumique vésicale identique entraîne une dose à la moelle plus élevée chez l’enfant que chez l’adulte, du fait d’une distance plus faible. Le risque aléatoire de cancer à long terme est lié aux effets stochastiques des examens exposants aux rayonnements ionisants (RI) (radiographie, TDM et médecine nucléaire). Ces effets sont extrêmement faibles en imagerie diagnostique, mais plus l’espérance de vie est longue, plus le risque qu’ils se manifestent augmente.
Quelle que soit leur spécialité, tous les médecins sont susceptibles, au cours de leur formation ou de leur pratique, d’être un jour demandeurs d’un examen d’imagerie pour un enfant. Le principe de justification les concerne donc tous. Un examen utilisant des RI ne doit être réalisé, notamment chez l’enfant, que s’il modifie la prise en charge et qu’il n’existe pas d’examen non irradiant susceptible de fournir la même information. Le choix de l’examen d’imagerie le plus approprié à la question posée et à l’état de l’enfant est sous la responsabilité légale du radiologue ou du médecin nucléaire (prescripteur de l’examen), sur la base des informations qui lui sont fournies, par écrit, par le clinicien demandeur qui a l’obligation de s’identifier lisiblement pour permettre d’éventuelles discussions. Le Guide d’aide à la demande d’examens de radiologie et d’imagerie médicale (ADERIM, aderim.radiologie.fr) a été établi pour guider les cliniciens dans le choix des examens d’imagerie adaptés à la situation clinique.
L’optimisation de l’examen relève du prescripteur, puisqu’il s’agit de réaliser un examen de la meilleure qualité possible, délivrant une dose aussi faible que possible. Le choix du spécialiste portera sur le matériel employé, sur le protocole de réalisation et le choix des paramètres d’acquisition des examens, en tenant compte des recommandations internationales quand elles existent. En pédiatrie, il faut tenir compte aussi de la capacité de participation de l’enfant. La sédation est parfois nécessaire en radiologie, adaptée à l’âge. Les méthodes suivantes peuvent être utilisées : biberon avant 6 mois, sédation consciente médicamenteuse gérée par les radiologues ou les anesthésistes entre 6 mois et 3 ans, puis distraction au-delà de 3 à 5 ans. La prise en compte de la douleur est un impératif facilitant l’obtention de l’immobilité. Celle-ci est importante pour obtenir des clichés de bonne qualité et respecter les règles en matière de radioprotection en évitant de répéter les clichés de qualité insuffisante parce que l’enfant a bougé. Son obtention est facilitée en pédiatrie par une contention douce mais ferme (figure 31.1).
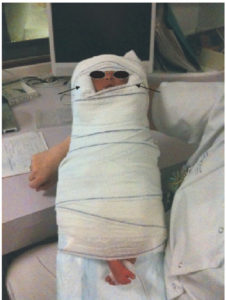
Emmaillotage par des bandes Velpeau® en IRM chez un nourrisson préalablement endormi avec un biberon.
Les coussins de part et d’autre des oreilles assurent la protection auditive (flèches noires).
Ostéoarticulaire
Un os en croissance
Le développement du squelette fait appel à deux mécanismes : la croissance et la maturation osseuses.
Croissance osseuse
La croissance osseuse se fait à la fois en longueur, à partir du cartilage de croissance, et en largeur, à partir du périoste (figure 31.2).
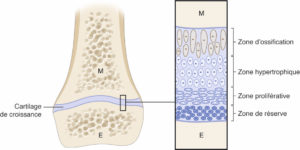
Représentation schématique de l’os en croissance.
E : épiphyse ; M : métaphyse.
Dessin : Cyrille Martinet.
Le cartilage de croissance (synonymes : physe, cartilage de conjugaison) est situé entre la métaphyse et l’épiphyse. Il est constitué de quatre couches, depuis l’épiphyse jusqu’à la métaphyse : les zones de réserve, proliférative, hypertrophique et d’ossification. La partie la plus fragile est celle située entre la zone d’ossification du cartilage de croissance et la métaphyse. Les fractures surviennent plus fréquemment à cet endroit. Les cartilages les plus actifs se situent près du genou et loin du coude. Comme la maquette cartilagineuse des épiphyses des os longs, le cartilage de croissance n’est pas radio-opaque. La fermeture du cartilage de croissance est une étape importante, car elle est le signe que la croissance est terminée.
Le périoste est très résistant. Il n’est pas visible en radiographie, sauf après son agression (traumatisme, infection, tumeur, etc.) lorsqu’une ossification du périoste ou apposition périostée apparaît (figure 31.3).
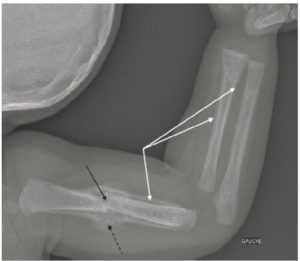
Radiographie de l’humérus et de l’avant-bras gauches de profil chez une enfant de 2 ans montrant des fractures multiples dans un contexte de traumatisme non accidentel.
Il existe une fracture du tiers moyen de la diaphyse humérale gauche (flèche noire) avec un cal osseux (flèche noire en pointillés) et des appositions périostées (flèches blanches) au niveau de l’humérus et du radius.
Maturation osseuse
La maturation osseuse se fait à partir de l’ossification de pièces cartilagineuses du squelette soit par ossification enchondrale pour les os longs, soit par ossification membraneuse pour les os plats. La maturation osseuse se déroule schématiquement en trois étapes :
- prénatale : ossification des maquettes cartilagineuses et diaphysaires ;
- enfance : tarse, carpe, épiphyses des os longs et voûte du crâne ;
- adolescence : fermeture physiologique des cartilages de croissance.
À la naissance, le carpe, le tarse et la plupart des épiphyses des os longs sont essentiellement constitués de cartilage, dont la tonalité est hydrique en radiographie. Cette maquette cartilagineuse, non visible sur une radiographie, s’ossifie progressivement, à partir de noyaux d’ossification. À la fin de la croissance, toute la maquette cartilagineuse a disparu ; elle est entièrement ossifiée (figure 31.4). Les os du crâne répondent à une double ossification, enchondrale au niveau de la base et de membrane (sutures) au niveau de la voûte.
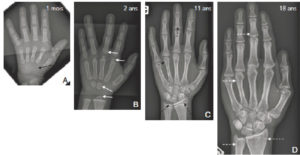
Ossification progressive du carpe et des épiphyses métacarpo-phalangiennes sur des radiographies de la main et du poignet gauches de face chez un nourrisson de 1 mois (A), un enfant de 2 ans (B), un adolescent de 11 ans (C) et un adulte de 18 ans (D).
À la naissance, le carpe n’est jamais ossifié : la maquette cartilagineuse est de tonalité hydrique et n’est donc pas visible directement sur une radiographie (flèche noire). Progressivement, le carpe et les épiphyses vont s’ossifier à partir des noyaux d’ossification (flèches blanches). Le cartilage de croissance reste radiotransparent tant que la croissance n’est pas terminée (flèches noires en pointillés). La fermeture du cartilage de croissance signe la fin de la croissance (flèches blanches en pointillés).
Les étapes relativement stéréotypées d’apparition progressive des noyaux d’ossification permettent d’estimer l’« âge du squelette » ou « âge osseux ». Ces étapes variant normalement peu d’un enfant à l’autre, il est possible de déterminer si un enfant présente une avance ou un retard de maturation osseuse. Les principales méthodes d’évaluation de la maturation osseuse sont les suivantes :
- avant 6 mois : comptage des points d’ossification sur des radiographies du membre supérieur et du membre inférieur ;
- à tout âge : évaluation de la présence et de la morphologie des épiphyses et des métaphyses sur une radiographie de la main et du poignet gauches ;
- adolescence : évaluation du noyau d’ossification secondaire des crêtes iliaques (figure 31.5). L’apparition du point d’ossification iliaque se fait vers 13–14 ans chez les filles et 15–16 ans chez les garçons. La fin de l’ossification de ce point complémentaire et la fusion complète avec l’aile iliaque se font en général en 3 ans. L’ossification et la fusion de la crête iliaque permettent un suivi de la maturation osseuse dans la surveillance de la scoliose (ce d’autant qu’il est visible sur les radiographies de rachis de surveillance de la courbure).
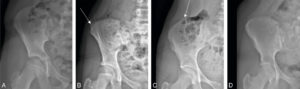
Méthode d’évaluation de l’âge osseux chez l’adolescent : radiographie de l’aile iliaque pour le test de Risser.
Le point iliaque n’est pas ossifié chez une fille de 10 ans : Risser 0 (A). Le point d’ossification est visible sur le versant latéral de l’aile iliaque chez une adolescente de 12 ans : Risser 1 (flèche) (B). Le point d’ossification se prolonge sur le versant médial de l’aile iliaque chez une adolescente de 13 ans : Risser 4 (C). Il est enfin complètement fusionné chez une adolescente de 16 ans : Risser 5 (D), signant la fin de la croissance.
Reconnaître une fracture chez un enfant
Quelles incidences faut-il réaliser ?
- La réalisation d’une radiographie dans deux plans orthogonaux est nécessaire pour mettre en évidence une fracture d’un os long (figure 31.6).
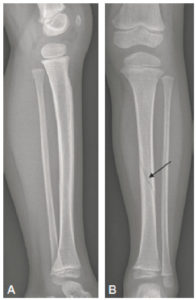
Radiographies de la jambe gauche chez une enfant de 3 ans montrant l’intérêt de réaliser deux incidences orthogonales.
La fracture spiroïde de la diaphyse tibiale est difficile à discerner sur le cliché de profil (A), alors qu’elle est parfaitement visible sur le cliché de face (B) (flèche).
- Les clichés de trois-quarts ne seront réalisés que si une fracture est fortement suspectée et non objectivée sur les radiographies de face et de profil.
- Les radiographies comparatives des membres sont le plus souvent inutiles dans le cadre d’une suspicion de fracture. Les ouvrages de référence sur la maturation du squelette de l’enfant et sur les variantes du normal permettent d’éviter une irradiation inutile sur des membres ou segments de membre a priori indemnes.
Particularités des fractures de l’enfant
Les traits de fracture transversaux, obliques, spiroïdes, comminutifs sont identiques à ceux de l’adulte. Certaines fractures sont propres à l’enfant, parmi lesquelles : la fracture en motte de beurre (plicature d’une corticale métaphysaire), en bois vert (fracture diaphysaire, une corticale étant rompue et l’autre continue), plastique (courbure de tout l’os, le plus souvent, la fibula ou l’ulna) (figure 31.7). La fracture sous-périostée ou en cheveu survient le plus souvent au niveau des membres inférieurs chez l’enfant autour de 2 ans et peut ne pas être visible sur la radiographie initiale.
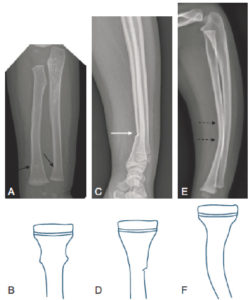
Radiographies et représentation schématique des fractures spécifiques de l’enfant.
A, B. Fracture en motte de beurre métaphysodiaphysaire distale du radius et de l’ulna droits chez un nourrisson de 18 mois (flèches noires). C, D. Fracture en bois vert diaphysaire distale du radius chez un enfant de 14 ans (flèche blanche). E, F. Fracture plastique du radius, sans luxation de la tête radiale, chez un enfant de 4 ans (flèches en pointillés).
Les fractures épiphyso-métaphysaires sont classées en fonction de la classification de Salter et Harris et du risque ultérieur de séquelles (figure 31.8). Leur point commun est qu’elles débutent toutes au sein du cartilage de croissance. Une complication rare mais grave de ces fractures propres à l’enfant est la survenue d’un arrêt de croissance anormal du fait de la création d’un pont osseux entre l’épiphyse et la métaphyse ou pont d’épiphysiodèse. Il peut en résulter une perte de longueur (figure 31.9) ou une désaxation en fonction du siège central ou latéral de ce pont.
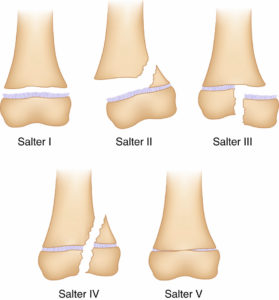
Classification de Salter et Harris des fractures épiphysométaphysaires.
Source : Skirven TM, Osterman AL, Fedorczyk J, et al. (Eds.). Rehabilitation of the Hand and Upper Extremity, 2-Volume Set, Seventh Edition. © Elsevier 2021.
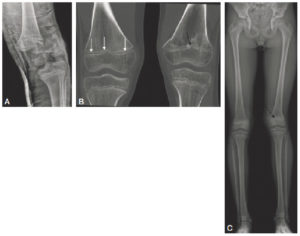
Fracture passant par le cartilage de croissance.
Sur la radiographie réalisée le jour du traumatisme chez un enfant de 11 ans (A), mise en évidence d’une fracture passant par le cartilage de croissance fémoral distal gauche avec déplacement important. Sur la TDM réalisée chez le même enfant un an après la fracture (B, reconstructions en coupe coronale des deux genoux) : à droite, le cartilage de croissance fémoral distal est normal (flèches blanches) ; à gauche : visibilité d’un pont d’épiphysiodèse (flèche noire). Sur la radiographie des deux membres inférieurs réalisée en position debout 2 ans après le traumatisme (C) : fermeture prématurée du cartilage de croissance fémoral distal gauche (flèche en pointillés) et inégalité de longueur des membres avec un raccourcissement du fémur gauche.
Fracture non visible sur la radiographie
Une fracture par torsion peut rompre les fibres osseuses sans qu’il y ait de séparation des fragments, qui sont plaqués les uns contre les autres par le périoste de l’enfant, particulièrement élastique et résistant. Une fracture sous-périostée ou en cheveu peut ne pas être visible sur la radiographie initiale. La répétition de clichés radiographiques 10 jours plus tard, quand les signes de réparation osseuse deviennent visibles, ou la réalisation d’une scintigraphie osseuse, qui visualise le renouvellement osseux en montrant une hyperfixation de la diaphyse, permettent d’établir le diagnostic (figure 31.10).
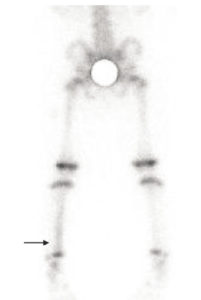
Chez un enfant de 18 mois boitant depuis une semaine, visibilité sur le cliché scintigraphique en incidence postérieure sur les membres inférieurs, 2 heures après l’injection d’un diphosphonate marqué au 99mTc, d’une hyperfixation des deux tiers inférieurs de la diaphyse tibiale gauche (flèche noire).
C’est l’aspect scintigraphique très évocateur de fracture en cheveu. Plus la fracture est récente, plus l’hyperfixation est intense.
Le recours à l’IRM est rarement nécessaire dans les situations orthopédiques courantes.
Dans le contexte d’une suspicion de maltraitance, scintigraphie et radiographie se complètent pour une évaluation de fractures multiples et d’âges différents.
Concernant les diagnostics différentiels, dont la suspicion d’infection ostéoarticulaire, nous vous invitons à vous référer aux chapitres 19 et 22.
Système nerveux central
Chez le nouveau-né, l’absence d’ossification des fontanelles et de la synchondrose entre les deux hémi-arcs postérieurs des vertèbres permet d’examiner en échographie le cerveau et la moelle avec une excellente résolution spatiale et sans sédation.
Échographie transfontanellaire (ETF)
L’ETF est réalisée en posant la sonde d’échographie sur la fontanelle antérieure. Elle permet de bien visualiser les ventricules latéraux, la substance blanche ainsi que la ligne médiane du prématuré et du nouveau-né à terme (figure 31.11). En revanche, l’exploration des zones latérales et de la fosse postérieure est limitée par la voûte du crâne. Cette échographie n’est pas réalisable au-delà du premier mois de vie car la fontanelle antérieure devient rapidement trop étroite pour laisser passer le faisceau ultrasonore. L’ETF est utile pour le dépistage des hémorragies péri- et intraventriculaires ainsi que des anomalies de la substance blanche comme la leucomalacie périventriculaire chez le nouveau-né prématuré. Une exploration plus précise des espaces péricérébraux, de la substance blanche ou de la substance grise, de la fosse postérieure est réalisée en IRM cérébrale, réalisable dès la période néonatale.
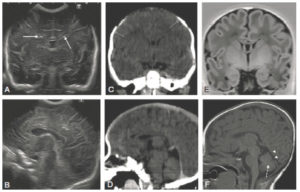
Comparaison des différentes techniques d’imagerie pour l’exploration du cerveau chez le nouveau-né.
L’échographie (A, B) permet de visualiser le parenchyme cérébral et les ventricules (flèches blanches), mais les régions pariétales et la fosse postérieure sont mal identifiées. En TDM (C, D), la voûte du crâne et les espaces péricérébraux sont bien explorés (flèches grises). En IRM, sur une séquence pondérée en T1 avec inversion récupération (E), la différenciation substance blanche-substance grise, et sur une séquence pondérée en T1 (F), la fosse postérieure avec le vermis (flèche blanche en pointillés), le tronc cérébral et la tente du cervelet (têtes de flèche) sont bien identifiés.
Échographie médullaire
Le nouveau-né est placé en décubitus ventral. Il est possible de réaliser des coupes sagittales et axiales du canal vertébral et de son contenu. La morphologie et la position du cône terminal, du filum terminal (la corde d’amarrage du cône terminal), des racines de la queue de cheval et des espaces périmédullaires (figure 31.12) sont identifiables échographiquement. Les principales indications de l’échographie médullaire sont les anomalies cutanées au niveau lombosacré (fossette sacrococcygienne, touffe de poils, angiome, pertuis cutané), qui représentent des signes évocateurs d’anomalie de fermeture du tube neural. Au-delà du premier mois de vie, les arcs postérieurs des vertèbres s’ossifient et l’échographie médullaire ne peut plus être réalisée. Une exploration complémentaire de la moelle, du cul-de-sac dural et des espaces périmédullaires peut être réalisée en IRM médullaire.
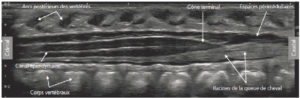
Échographie médullaire chez un nouveau-né de 15 jours dans le plan sagittal montrant le contenu du canal vertébral à l’étage dorsolombaire.
Abdomen
Échographie
Chez l’enfant, l’échographie est l’examen de première intention pour explorer l’abdomen, car la faible épaisseur du tissu graisseux et musculaire de la paroi abdominale de l’enfant permet d’explorer l’abdomen dans son ensemble avec une grande précision. De plus, l’échographie a l’avantage d’être non irradiante, non invasive et rapide à mettre en œuvre, ne nécessitant pas de préparation particulière. Le diagnostic étiologique des douleurs abdominales ou des occlusions comme la sténose hypertrophique du pylore, le volvulus du grêle (torsion de la masse des anses grêles libres sur son mésentère avec non seulement un arrêt du transit, mais également de la vascularisation et un risque majeur de nécrose de l’intestin grêle) ou l’invagination intestinale aiguë est le plus souvent réalisé en échographie. La paroi intestinale, avec ses différentes couches muqueuse, sous-muqueuse et séreuse, est identifiable en échographie avec des sondes de haute fréquence. Cela permet de diagnostiquer, entre autres, une appendicite aiguë (figure 31.13), les maladies inflammatoires ou infectieuses de la paroi intestinale (maladie de Crohn, etc.)
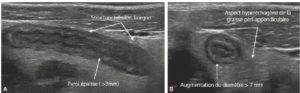
Échographie abdominale d’une appendicite aiguë non compliquée chez un enfant de 14 ans avec une coupe longitudinale (A) et axiale de l’appendice (B).
Radiographie d’abdomen sans préparation
La radiographie d’abdomen sans préparation (ASP) ne conserve que quelques indications chez l’enfant : recherche de signes en faveur d’une occlusion, recherche de perforation digestive (air libre dans le péritoine – pneumopéritoine) et recherche de corps étranger radio-opaque ou d’opacités calciques (calculs des voies urinaires). La séméiologie de l’ASP en position couchée doit être connue car la radiographie d’ASP est souvent réalisée en décubitus en pédiatrie, en particulier en période néonatale. Le pneumopéritoine n’apparaît pas sous la forme d’un croissant gazeux sous les coupoles diaphragmatiques sur un cliché en position couchée, mais sous la forme d’une clarté centrale péri-ombilicale, moulant les anses digestives et le ligament falciforme (figure 31.14). L’occlusion digestive d’origine mécanique sur le cliché en décubitus dorsal apparaît sous la forme d’une distension des anses digestives et d’une absence d’aération des anses en aval (au-delà des premières heures de vie).
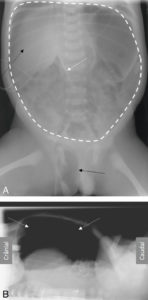
Pneumopéritoine chez un nouveau-né prématuré en position couchée sur une radiographie d’abdomen de face (A) et de profil avec rayon horizontal (B).
Pneumopéritoine visible en A sous la forme d’une hyperclarté pré-hépatique (flèche noire en pointillés), d’une clarté centrale (contourée par la ligne blanche en pointillés) moulant le ligament falciforme (flèche blanche) associée à la présence d’air dans le scrotum (flèche noire). Le pneumopéritoine est visible en B sous la forme d’un croissant gazeux sous la paroi abdominale (flèches blanches en pointillés).
Opacifications digestives
L’opacification digestive permet d’évaluer la topographie, la morphologie et la cinétique de progression du produit de contraste dans le tube digestif. Seul l’intérieur du tube digestif est visualisé. S’il existe un obstacle intrinsèque complet comme une atrésie, il se traduira par une interruption de la progression du produit de contraste. S’il existe une compression extrinsèque, elle se traduira par une déformation des bords du tube digestif. Ce type d’examen vient en complément des explorations radiographiques standard ou échographiques. En fonction de la partie du tube digestif que l’on veut explorer et du contexte clinique, le radiologue peut choisir entre deux types de produit de contraste : baryte, à base de sulfate de baryum, ou produit de contraste à base d’iode. Les opacifications digestives les plus couramment réalisées en pédiatrie sont :
- transit œso-gastro-duodénal (TOGD) et transit du grêle : on fait boire ou on administre par la sonde nasogastrique un produit de contraste qui permet d’opacifier ces différentes structures anatomiques afin de juger de leur morphologie et de la progression du produit de contraste ;
- lavement opaque : après mise en place d’une canule rectale, le rectum, puis l’ensemble du côlon jusqu’à la valvule iléocæcale et les dernières anses iléales sont opacifiés.
TDM abdominale
En raison de son caractère irradiant, mais également du fait d’interfaces graisseuses peu nombreuses chez l’enfant par rapport à l’adulte (le tube digestif n’est pas entouré de graisse chez l’enfant), la TDM abdominale a des indications limitées en pédiatrie. Elle est principalement indiquée dans le bilan des tumeurs abdominales de l’enfant et des appendicites aiguës compliquées avant un éventuel drainage percutané.
IRM abdominale
Les indications de l’IRM abdominale chez l’enfant sont en progression. Celle-ci est réalisée chez les enfants suivis pour une maladie inflammatoire du tube digestif, avec la réalisation d’une entéro-IRM pour laquelle un produit sans absorption digestive doit être bu avant l’examen pour distendre les anses digestives.
L’IRM permet de diagnostiquer et de surveiller les anomalies de la paroi intestinale et les fistules anopérinéales. C’est l’outil d’imagerie de référence dans le bilan des pathologies complexes des voies biliaires grâce à l’utilisation de séquences fortement pondérées en T2 qui permettent d’analyser les liquides stagnants. Enfin, pour les enfants suivis pour un cancer solide abdominal (comme un neuroblastome ou un néphroblastome), l’IRM permet le bilan de l’extension tumorale endocanalaire d’un neuroblastome et le suivi locorégional sans exposition aux RI.
Scintigraphie au pertechnétate
En cas de saignement digestif, il peut être indiqué de rechercher un diverticule de Meckel, résidu embryologique du canal omphalomésentérique, par méthode isotopique. Seuls les diverticules tapissés de muqueuse gastrique métaplasique (moins de 50 % des diverticules) sont détectables par cette méthode ; en principe, ce sont ceux qui sont susceptibles de saigner. Le médicament radiopharmaceutique (MRP) injecté (pertechnétate) se fixe sur la muqueuse gastrique qui tapisse le diverticule, et pas sur le reste de l’intestin (figure 31.15), l’intensité du foyer de fixation augmentant parallèlement à l’activité gastrique.
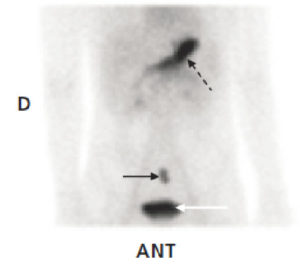
Recherche isotopique de diverticule de Meckel, vue antérieure de l’abdomen.
Le diverticule est le petit foyer indiqué par la flèche noire, qui a concentré le pertechnétate. L’estomac, dont la muqueuse fixe le pertechnétate, est visible (flèche noire en pointillés) comme le diverticule, et en dessous la vessie (flèche blanche), puisque le MRP s’élimine principalement par voie urinaire.
Scintigraphie à la méta-iodobenzylguanidine
Le neuroblastome est la tumeur extracrânienne la plus fréquente de l’enfant de moins 5 ans. La localisation initiale de la tumeur primitive est le plus souvent intra-abdominale. Dans 60 % des cas, la découverte se fait au stade métastatique. Le bilan préthérapeutique comporte une échographie abdominale et, le plus souvent, une TDM sans puis avec injection de produit de contraste. La scintigraphie à la 123I- méta-iodobenzylguanidine (MIBG) est actuellement l’examen de référence pour le bilan d’extension et l’évaluation thérapeutique. Plus de 90 % des neuroblastomes captent la MIBG marquée. Lorsque ce n’est pas le cas, une TEP au 18F-FDG est indiquée.
Appareil urinaire
L’échographie est l’examen de première intention pour l’exploration du rein et des voies urinaires en pédiatrie. Le rein a une forme de haricot. En comparaison de l’échographie rénale de l’adulte, la différenciation corticomédullaire est très bien visualisée chez l’enfant. Cette différenciation correspond à la différence d’échogénicité entre les pyramides rénales (triangulaires à sommet sinusal et hypoéchogènes) et le cortex rénal (plus échogène que les pyramides). Le sinus du rein de l’enfant ne contient pas de graisse, contrairement à l’adulte (figure 31.16). Les calices sont virtuels quand il n’y a pas de dilatation. Le pelvis rénal (pyélon ou bassinet) est visible sur une coupe transversale passant par le hile du rein, sous la forme d’une structure à bords parallèles dirigée en avant et en dedans. Il ne mesure pas plus de quelques millimètres de diamètre antéropostérieur lorsqu’il n’est pas dilaté. L’uretère n’est pas visible en arrière de la vessie ou au niveau lombaire quand il n’est pas dilaté.
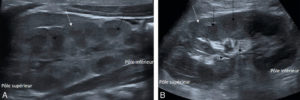
Échographie rénale montrant une coupe sagittale du rein droit en sonde de haute fréquence chez un nouveau-né de 20 jours (A) et de basse fréquence chez une adolescente de 13 ans (B).
La différenciation corticomédullaire est plus facilement identifiée chez le nouveau-né (A) chez lequel les pyramides rénales sont hypoéchogènes (flèches noires) et le cortex est plus hyperéchogène (flèches blanches) que chez l’enfant plus âgé (B). Les cavités intrarénales ne sont pas visibles en l’absence de dilatation. Le sinus du rein est hyperéchogène chez l’adolescente (B) (flèches en pointillés).
Les uropathies sont fréquemment découvertes lors des échographies anténatales. Une dilatation des voies urinaires peut disparaître, persister ou s’aggraver après la naissance. Quelle que soit sa cause (syndrome de jonction pyélo-urétérale, reflux vésico-urétéral, valves de l’urètre postérieur), une dilatation des voies urinaires doit être surveillée afin d’éviter une détérioration de la fonction rénale (figure 31.17). La surveillance est clinique, biologique et échographique en première intention. Lorsque la mesure des fonctions rénales relatives est indiquée, la scintigraphie rénale dynamique (MAG3®) est actuellement l’examen de référence. L’utilisation de l’IRM est en développement dans ce domaine. La recherche de cicatrices rénales se fait par échographie ou, mieux, par scintigraphie du cortex rénal (99mTc DMSA) (figure 31.18), en respectant un délai de 6 mois par rapport à l’épisode infectieux initial.
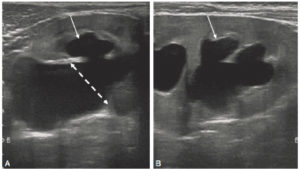
Échographie rénale en coupes axiale (A) et longitudinale (B) montrant une dilatation pyélocalicielle.
Le pyélon est dilaté (double flèche en pointillés) sur la coupe axiale centrée sur le hile du rein. Les calices sont également dilatés (flèches blanches).
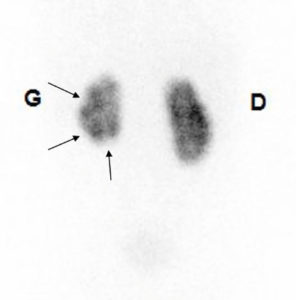
Scintigraphie rénale au 99mTc-DMSA.
Le rein gauche est de de plus petite taille que le rein droit ; il présente un aspect multicicatriciel avec plusieurs petites encoches corticales (flèches).
Fœtus
L’imagerie anténatale permet de surveiller la croissance et le bien-être fœtal ainsi que de dépister certaines malformations. Comme en postnatal, les techniques non irradiantes sont privilégiées.
L’échographie est utilisée en dépistage et pour le diagnostic des anomalies fœtales (figure 31.19). Certaines coupes sur le cerveau, le cœur, le rachis, les membres, l’abdomen et la face sont obligatoires en échographie de dépistage. À partir des mesures du périmètre crânien, du périmètre abdominal et de la longueur fémorale, une estimation du poids du fœtus peut être calculée. Les deux limites principales à l’échographie fœtale sont l’épaisseur de la paroi maternelle et la position du fœtus (par exemple, si le fœtus a le dos en avant, le cœur est plus difficile à examiner).
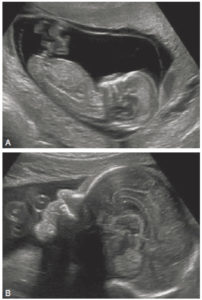
Échographie anténatale chez un fœtus à 12 SA (A) et 31 SA (B) montrant une coupe sagittale médiane de l’ensemble du fœtus à 12 SA et de la face fœtale à 31 SA.
On note qu’à 31 SA, les structures cérébrales sont bien visibles, comme en échographie transfontanellaire en postnatal (voir figure 31.11).
L’IRM est un examen de seconde intention, réalisé le plus souvent lorsqu’il existe une anomalie en échographie (figure 31.20).
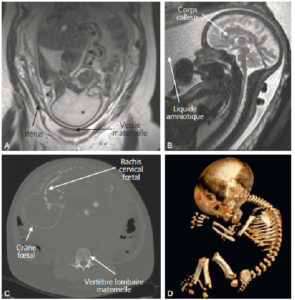
IRM (A, B) et TDM (C, D) fœtales.
Coupe de repérage en IRM montrant l’ensemble du fœtus tête (astérisque) en bas dans l’utérus (A) et coupe sagittale en pondération T2 centrée sur la ligne médiane cérébrale du fœtus (B) (on note un bras en coupe axiale devant les lèvres du fœtus). En TDM, sur les coupes en 2D (C), le squelette fœtal est visible, un peu moins dense que le squelette maternel (vertèbre lombaire) et il est possible de réaliser des reconstructions en 3D de l’ensemble du squelette fœtal, ici dans le cadre d’une suspicion d’achondroplasie (D).
La TDM est rarement utilisée. Elle sert au bilan étiologique et pronostique de maladies osseuses constitutionnelles ou d’anomalies de structures mal explorées en échographie et en IRM comme la voûte du crâne et le bassin. Par ailleurs, la TDM à très basses doses (qui ne permettent pas d’examiner le squelette fœtal) permet d’estimer les dimensions du bassin maternel lorsqu’il existe des facteurs de risque de dystocie ou de disproportion maternofœtale. En fonction des résultats de la pelvimétrie par TDM, l’accouchement est prévu par voie basse ou par césarienne.
La radiographie standard n’est plus utilisée pour l’exploration fœtale.
Thorax
Technique
Jusqu’à 7 ans environ, la radiographie de thorax est réalisée en incidence antéropostérieure (et non postéro-antérieure) pour plusieurs raisons : 1) surveiller chez le tout petit le moment de l’inspiration pour déclencher la prise du cliché ; 2) obtenir un cliché de face stricte (les enfants ont tendance à se retourner pour regarder ce qui se passe derrière eux). Chez l’enfant plus grand, la radiographie est effectuée en incidence postéro-antérieure pour protéger la glande mammaire et la thyroïde du rayon primaire et limiter l’agrandissement photographique.
Chez le nouveau-né, le cliché est réalisé en position allongée. L’incidence de face est le plus souvent suffisante. Le cliché de profil n’est utile que dans trois circonstances : recherche d’adénopathie, de métastase pulmonaire ou de masse thoracique.
Critères de qualité
Les critères de qualité d’une radiographie de thorax chez l’enfant sont les mêmes que chez l’adulte (voir chapitre 25), avec néanmoins quelques différences (figure 31.21). On considère que la radiographie est en bonne inspiration si l’on compte plus de 5 arcs antérieurs au-dessus de la coupole diaphragmatique droite (au lieu de 6 arcs antérieurs et 10 arcs postérieurs chez l’adulte). La silhouette cardiaque semble proportionnellement plus large chez l’enfant que chez l’adulte. Cela est lié à l’incidence antéropostérieure, qui entraîne un facteur d’agrandissement chez l’enfant, et à la présence du thymus visible sur une radiographie jusqu’à l’âge de 6 ans qui élargit le médiastin.
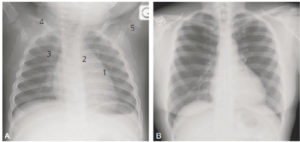
Cinq différences entre la radiographie thoracique d’un nourrisson (A) et celle d’un adulte (B).
Outre l’incidence antéropostérieure responsable d’un certain agrandissement, les différences sont : 1. présence du thymus ; 2. non-visibilité de la crosse aortique ; 3. portion antérieure du gril costal entièrement cartilagineuse, donc non visible sur la radiographie ; 4. courbure claviculaire accentuée du fait de la position des bras au-dessus de la tête ; 5. présence du point d’ossification huméral supérieur.
Il existe quelques particularités de l’image thoracique en pédiatrie à connaître :
- la portion antérieure du gril costal est entièrement cartilagineuse chez l’enfant ; elle n’est donc pas visible sur la radiographie de thorax ;
- trachée : chez le nourrisson, la trachée peut être coudée vers la droite sur un cliché en expiration. À cet âge, la trachée est encore souple et peut être refoulée par la crosse aortique et l’aorte descendante vers la droite. Sur le cliché en inspiration, la trachée redevient normalement rectiligne, discrètement latéromédiane droite. Avec l’âge, la trachée devient plus rigide. Elle doit être rectiligne, y compris sur un cliché en expiration chez l’enfant au-delà de 2–3 ans (figure 31.22) ;
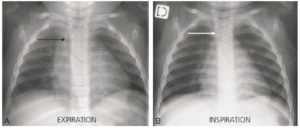
Déviation trachéale physiologique vers la droite chez un nourrisson de 20 mois sur une radiographie de thorax réalisée en expiration (flèche noire) (A).
Sur le cliché en inspiration, la trachée redevient rectiligne (flèche blanche) (B).
- thymus : le thymus est visible sur la radiographie de thorax de l’enfant jusqu’à 6 ans environ. Il se situe dans le médiastin antérieur et supérieur, et se traduit sur la radiographie par une masse de tonalité hydrique, homogène et non compressive effaçant les arcs du médiastin (signe de la silhouette). Les signes suivants sont relatifs à la présence du thymus sur une radiographie thoracique de face (figure 31.23) :
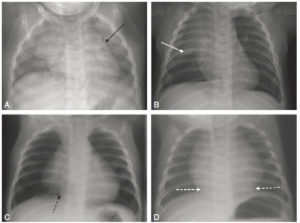
Aspects radiographiques normaux du thymus.
Aspect ondulé des bords du thymus sur un cliché réalisé en expiration (flèche noire) (A) ; aspect en voile latine (flèche blanche) (B) ; extension du thymus jusqu’à la coupole diaphragmatique (flèche noire en pointillés) (C) ; fausse impression de cardiomégalie du fait de l’extension inférieure du thymus (flèches blanches en pointillés) (D).
- signe de la vague : aspect ondulé des bords du thymus du fait de l’impression des arcs costaux antérieurs sur son bord antérieur ;
- incisure cardiothymique : zone de raccordement entre le bord latéral du thymus et le cœur ;
- voile latine : en rapport avec une hypertrophie du lobe droit. Les vaisseaux sont visibles au travers du thymus, ce qui permet de ne pas le confondre avec un foyer de pneumopathie du lobe supérieur droit ;
- extension du thymus jusqu’à la coupole diaphragmatique : elle peut créer une fausse impression de cardiomégalie. La visibilité de la vascularisation normale et la position normale des hiles pulmonaires permettent d’écarter le diagnostic de cardiomégalie.
Communication
En pédiatrie, jusqu’à 12 ans environ, l’interlocuteur principal est le (ou les) parent(s), ce qui n’empêche pas de s’adresser aussi directement à l’enfant. Lorsqu’un enfant est malade, l’inquiétude parentale est généralement vive, souvent sans proportion avec la gravité réelle de la maladie. Pour sécuriser l’enfant, il faut donc bien s’occuper des parents. Il est essentiel de tenir des propos clairs, honnêtes et adaptés à la compréhension des interlocuteurs. Les parents sont rassurés de savoir qu’ils peuvent accompagner leurs enfants, quand c’est possible, lors de la réalisation d’examens d’imagerie. Ils ont besoin d’être sûrs qu’il y a eu une réflexion préalable collégiale sur le rapport bénéfice/risque de l’examen, et qu’il y aura une prévention active de la douleur. Des documents écrits et des affiches dans le service permettent de compléter l’information, mais ils ne remplacent jamais des explications orales directes, qui doivent être cohérentes au sein du service.
À l’adolescence, l’interlocuteur principal devient le plus souvent le jeune concerné, en présence des parents. Il existe cependant des différences culturelles. Le discours du médecin reste bienveillant, clair, et ouvert sur des questions éventuelles.
La transmission des résultats diffère selon les services et la gravité de la maladie. Dans tous les cas, les examens d’imagerie doivent être envoyés au médecin demandeur, avec un compte-rendu complet et clair, dans des délais aussi brefs que possible. La communication (bilatérale) avec l’équipe clinique qui suit l’enfant est fondamentale et permet que les parents soient assurés de la prise en charge globale de leur enfant. Après l’examen, en cas de résultats montrant la persistance ou la récidive d’une maladie grave, un appel téléphonique au médecin référent, avant de parler à la famille, permet de préciser les modalités de prise en charge à court terme, ce qui est essentiel pour limiter le temps d’incertitude, souvent très difficile à vivre.
Essentiel à retenir
- La réalisation des examens d’imagerie chez l’enfant requiert une attention et un soin particuliers pour le choix de la technique (la moins irradiante possible en fonction de la question posée), l’optimisation des paramètres d’acquisition et la prise en charge de la douleur.
- Certains traits de fracture passant par le cartilage de croissance peuvent avoir une incidence sur la croissance d’un os long et entraîner une inégalité de longueur des membres ou une désaxation.
- L’échographie transfontanellaire et l’échographie médullaire sont des techniques spécifiques d’exploration du système nerveux central utilisées chez le nouveau-né.
- Le thymus peut être physiologiquement visible sur une radiographie thoracique jusqu’à 6 ans et ses différentes formes doivent être connues.
 |
Retour au sommaire |
