Les fondamentaux – Chapitre 5 – Médecine nucléaire
V. Lebon
Plan du chapitre
- Introduction
- Médicaments radiopharmaceutiques (MRP)
- Instrumentation
Objectifs
- Comprendre les spécificités de l’imagerie scintigraphique par rapport aux autres techniques d’imagerie.
- Comprendre la constitution d’un médicament radiopharmaceutique (MRP), en connaître les principales caractéristiques.
- Savoir quels sont les MRP les plus couramment utilisés en scintigraphie conventionnelle et en tomographie par émission de positons (TEP).
- Comprendre le principe de détection des photons γ par des cristaux scintillants couplés à des photomultiplicateurs.
- Comprendre le principe de localisation par collimation des gamma-caméras.
- Comprendre le principe de localisation par détection en coïncidence des caméras TEP.
- Connaître les principaux points communs et les différences entre une gamma-caméra et une caméra TEP.
Introduction
La médecine nucléaire regroupe l’ensemble des applications médicales reposant sur l’administration au patient d’une substance radioactive en source non scellée. Elle comprend des applications diagnostiques, principalement par imagerie et des applications thérapeutiques (radiothérapie interne vectorisée – voir chapitre 16).
Les images acquises en médecine nucléaire, en localisant un médicament radiopharmaceutique (MRP) préalablement administré au patient, sont le reflet de l’activité moléculaire, métabolique et fonctionnelle spécifique à certaines lésions ou structures de l’organisme. Les radionucléides le plus souvent utilisés sont émetteurs de photons gamma (γ). Ces photons traversent l’organisme en interagissant peu avec les tissus avant d’être détectés à l’extérieur du patient. La détection reposant sur un phénomène de scintillation, on parle de scintigraphie pour désigner l’imagerie effectuée en médecine nucléaire. On peut aussi utiliser des émetteurs β+ qui donnent secondairement naissance à des photons γ.
La scintigraphie appartient aux techniques d’imagerie d’émission (les photons sont émis par le patient), par opposition à l’imagerie de transmission dans laquelle les photons transmis sont ceux qui n’ont pas été absorbés par le patient et qui vont permettre de réaliser les images, rendant ainsi compte de la densité des milieux traversés. Il s’agit là des techniques de radiologie conventionnelle ou de la tomodensitométrie, plus communément appelée scanner.
En comparaison avec les images radiologiques, les images scintigraphiques ont une qualité morphologique médiocre, d’une part, car le MRP s’accumule spécifiquement sur certaines structures, si bien que la plupart des organes restent invisibles à la scintigraphie, d’autre part, car la résolution spatiale en médecine nucléaire est moins bonne qu’en radiologie. L’intérêt de l’imagerie scintigraphique tient à son caractère moléculaire, métabolique et fonctionnel ; elle apporte une information spécifique du MRP administré au patient. Pour illustrer cette particularité de la médecine nucléaire, il suffit de se représenter les images qu’on obtiendrait chez un patient en arrêt cardiorespiratoire : quel que soit le MRP utilisé, on obtiendrait une scintigraphie « blanche » correspondant à l’absence de signal.
Ce chapitre présente tout d’abord une description des MRP utilisés en médecine nucléaire. Les caractéristiques de ces molécules sont décrites et les principaux MRP utilisés pour l’imagerie sont présentés. L’utilisation de MRP pour la thérapie est également évoquée. La seconde partie de ce chapitre est consacrée à l’instrumentation en médecine nucléaire. Elle explique comment les rayonnements émis par les MRP sont détectés et localisés par les deux types de caméras utilisées en médecine nucléaire : les gamma-caméras et les caméras TEP.
Médicaments radiopharmaceutiques (MRP)
Généralités
L’imagerie scintigraphique repose sur l’administration d’un MRP, composé d’une très faible quantité de matière d’un principe actif (quantité nettement inférieure à la nanomole, le principe actif ne perturbant donc pas le métabolisme de l’organisme), dont le comportement ou la distribution dans l’organisme est similaire à une substance endogène (la substance tracée), marqué par un radionucléide artificiel (ce qui permet de le détecter).
Lorsque le MRP s’accumule localement, on parle d’hyperfixation (ou d’hypofixation lorsqu’il y a défaut d’accumulation). La terminologie d’hyper- et d’hypofixation est couramment utilisée en médecine nucléaire, même si elle ne correspond pas toujours à l’établissement d’une liaison irréversible : le MRP peut également être métabolisé ou transiter par un espace du corps (appelé compartiment).
La combinaison principe actif/radionucléide peut être déclinée pour explorer un grand nombre d’aspects du fonctionnement d’un même organe, ce qui explique la très grande diversité des examens de médecine nucléaire. On peut citer l’exemple du cerveau pour lequel la médecine nucléaire offre des molécules permettant de visualiser la perfusion cérébrale, le métabolisme glucidique, le métabolisme des acides aminés, la neurotransmission dopaminergique ou encore la concentration de plaques amyloïdes (voir chapitre 23).
Si la majorité des MRP sont utilisés à visée diagnostique (imagerie), certains sont utilisés en thérapie pour irradier des tissus ou des cellules pathologiques (voir chapitre 16).
Critères de choix du MRP pour l’imagerie
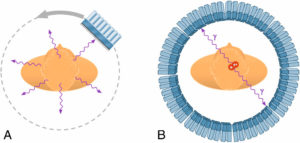
Le MRP est constitué d’un radionucléide lié à un vecteur (figure 5.1). La fonction du radionucléide est d’émettre un rayonnement détectable à l’extérieur du patient ; celle du vecteur est de se fixer sur une structure particulière de l’organisme qui peut être un organe ou tissu, un compartiment (espace de l’organisme comme le sang) ou une lésion. Pour l’imagerie, le MRP « idéal » doit posséder les trois caractéristiques suivantes : il doit pouvoir être suivi dans le temps, se comporter comme la substance tracée et il ne doit pas perturber le système dans lequel il est introduit.
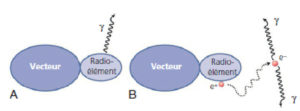
Les MRP utilisés en médecine nucléaire sont constitués d’un radionucléide lié à un vecteur : la scintigraphie conventionnelle utilise des émetteurs γ (A), la TEP utilise des émetteurs de positons qui s’annihilent avec un électron pour émettre une paire de photons γ (B).
Dessin : Cyrille Martinet.
Propriétés physiques du radionucléide
La médecine nucléaire propose deux techniques d’imagerie : la scintigraphie dite « conventionnelle » et la TEP.
La scintigraphie conventionnelle détecte les MRP émetteurs de photons gamma (γ). Les photons γ sont produits suite à la désintégration de certains noyaux atomiques. Comme les photons X, ils sont une forme de rayonnement électromagnétique mais en diffèrent par leur origine : les X viennent du réarrangement du cortège électronique des atomes, tandis que les γ viennent des transformations radioactives des noyaux ; ils présentent généralement une énergie plus élevée que celle des X (> 100 keV). Ces photons ont ainsi une faible probabilité d’interaction avec la matière et sont peu irradiants pour le patient. En revanche, du fait de leur masse, les rayonnements particulaires, du type β– ont une probabilité d’interaction forte et sont donc irradiants. En outre, les électrons ont un parcours trop limité dans les tissus pour être détectés en externe. Aussi, pour la scintigraphie conventionnelle et pour des raisons de radioprotection, il faut éviter d’utiliser des émetteurs γ associés à l’émission d’électrons (désintégration β–).
La TEP utilise, quant à elle, des MRP émetteurs de positons (désintégration β+). Les positons sont des électrons chargés positivement ; ils ne sont pas détectables en externe car ils s’annihilent avec un électron à proximité de leur site d’émission. Mais cette annihilation donne naissance à une paire de photons γ d’énergie 511 keV (ce qui correspond à l’équivalent énergétique de la masse d’un électron ou d’un positon) émis à l’opposé l’un de l’autre, qui sont détectés en TEP.
Les deux techniques d’imagerie de la médecine nucléaire diffèrent donc par la nature des radionucléides qu’elles utilisent. Les principaux critères de choix de ces radionucléides sont néanmoins communs aux deux techniques :
- le radionucléide doit posséder une période suffisamment courte pour limiter la durée d’exposition du patient. Elle doit cependant être suffisamment longue pour permettre la préparation du MRP, son administration au patient, sa répartition dans l’organisme via un processus métabolique parfois lent, puis l’acquisition des images. Une période de quelques heures à quelques jours est adaptée à la médecine nucléaire ;
- l’efficacité de marquage du vecteur par le radionucléide est un critère essentiel, ce marquage étant généralement réalisé juste avant l’administration au patient ;
- la facilité d’approvisionnement en radionucléide doit être prise en compte. Elle dépend du mode de production du radionucléide (réacteur nucléaire, cyclotron ou générateur) et de sa période radioactive.
Propriétés biochimiques du vecteur
Le vecteur utilisé en médecine nucléaire peut être de nature très variée. Il peut s’agir du radionucléide lui-même, comme l’iode (123I ou 131I), qui est capté directement par la thyroïde, ou le thallium (201Tl), qui présente la même cinétique de fixation myocardique que le potassium.
Le vecteur peut être une molécule plus complexe dont on veut mesurer le métabolisme ou la distribution dans l’organisme. Il peut s’agir d’un substrat énergétique (analogue du glucose 18F-FDG), d’un ligand (ligand des transporteurs dopaminergiques 123I-ioflupane), voire d’un élément figuré du sang (hématies marquées au 99mTc).
La stabilité de la liaison vecteur/radionucléide est un critère important pour le choix du vecteur. Il faut également s’assurer que la présence du radionucléide ne perturbe pas significativement le comportement biologique du vecteur. Ces critères de stabilité et de comportement biologiques du vecteur dépendent principalement de la nature métallique ou non des radionucléides :
- le marquage d’un vecteur par un radionucléide métallique (99mTc, 111In, 68Ga) nécessite un grand nombre de liaisons vecteur/métal. En effet, les vecteurs sont des molécules organiques qui se lient difficilement avec les atomes métalliques : la liaison métal/molécule organique est intrinsèquement faible, si bien qu’une liaison unique serait trop instable. La fixation se fait via un complexe de plusieurs liaisons formant une pince – appelée chélate2 – autour du radionucléide métallique. L’inconvénient principal de cette chimie de chélation tient à l’encombrement du site de liaison vecteur/radionucléide. Le choix du chélate est le résultat d’un compromis entre la stabilité de la liaison vecteur/métal et son encombrement : plus le complexe contient un nombre élevé de liaisons, plus le MRP est stable, mais plus son encombrement perturbe le comportement biologique du vecteur ;
- pour les radionucléides non métalliques (123I, 131I, 18F, 11C), le marquage repose sur la chimie de l’élément considéré (carbone, iode, etc.) : une simple liaison covalente suffit à synthétiser un MRP stable dont le comportement biologique est peu modifié par le radionucléide.
Principaux MRP utilisés en scintigraphie conventionnelle
Le tableau 5.1 présente les principaux MRP (radionucléides et vecteurs) utilisés en scintigraphie conventionnelle et les fonctions physiologiques ou les tissus explorés par ces radiopharmaceutiques.
Tableau 5.1 – Radiopharmaceutiques les plus utilisés en scintigraphie conventionnelle
|
Radiopharmaceutique |
Fonction/tissu explorés |
|||
|
Radionucléide |
Vecteur |
|||
|
Isotope |
Énergie |
Période |
||
|
Technétium 99mTc |
140 keV |
6,0 h |
HMDP |
Accrétion osseuse (ostéoblastes) |
|
Sestamibi Tétrofosmine |
Perfusion myocardique, parathyroïdes |
|||
|
Hématies |
Fraction d’éjection ventriculaire Recherche d’hémorragie |
|||
|
Pertechnétate (TcO4−) |
Fonction thyroïdienne |
|||
|
HMPAO |
Perfusion cérébrale |
|||
|
Acide iminodiacétique (IDA) |
Fonction hépatobiliaire |
|||
|
Macro-agrégats d’albumine |
Perfusion pulmonaire |
|||
|
Microparticules de carbone (Technegas®) |
Ventilation pulmonaire |
|||
|
Acide dimercaptosuccinique (DMSA) |
Masse rénale fonctionnelle |
|||
|
DTPA |
Filtration rénale |
|||
|
MAG3®, Nephromag® |
Perfusion rénale, sécrétion, drainage urinaire |
|||
|
Leucocytes marqués à l’hexaméthyl propylène amine oxime (HMPAO) |
||||
|
Thallium 201Tl |
69 keV, 71 keV, 80 keV |
3,1 j |
– |
Perfusion myocardique |
|
Krypton(81mKr) |
190 keV |
13 s |
– |
Ventilation pulmonaire |
|
Iode 123I |
159 keV |
13 h |
– |
Fonction thyroïdienne |
|
Ioflupane |
Ioflupane |
|||
|
MIBG |
Médullosurrénale (phéochromocytome, neuroblastome) |
|||
|
131I |
364 keV |
8 j |
Noriodocholestérol |
Corticosurrénale |
|
Indium(111In) |
171 keV, 245 keV |
2,8 j |
Pentétréotide |
Récepteurs à la somatostatine (tumeur neuroendocrine) |
Pour chaque radionucléide, le tableau ne mentionne que l’énergie du ou des rayonnements γ utilisés pour la détection scintigraphique. Il faut savoir que les radionucléides ne se désintègrent presque jamais selon une transition unique vers leur état stable : leur désintégration s’effectue selon un schéma complexe impliquant de nombreux intermédiaires et de nombreuses émissions γ d’énergies différentes. La scintigraphie ne détecte que les émissions les plus abondantes dont l’énergie est adaptée à la sensibilité des détecteurs (entre 70 et 360 keV).
Le radionucléide de loin le plus utilisé en scintigraphie conventionnelle est le 99mTc métastable. Sa désintégration est associée à l’émission très majoritaire de photons γ de 140 keV (énergie bien adaptée aux gamma-caméras) ; sa période est de 6 heures. Il peut être utilisé en solution directe ou pour marquer différents vecteurs, préconditionnés pour le radiomarquage sous forme de précurseurs dans des flacons (appelés « trousses » ou « kits ») ; enfin, il ne pose pas de problème d’approvisionnement puisqu’il est produit dans le service de médecine nucléaire à partir d’un générateur qui doit être renouvelé toutes les semaines.
Les MRP utilisant d’autres radionucléides que le 99mTc doivent être livrés quotidiennement (à l’exception du 81mKr, produit sur place par un générateur). Comme le montre le tableau 5.1, certains examens peuvent être effectués au moyen de différents MRP. C’est le cas de l’évaluation de la perfusion myocardique (visualisée après injection de 201Tl ou de 99mTc-sestamibi) ou de la fonction thyroïdienne (visualisée après injection d’123I ou de 99mTcO4–). Les MRP technétiés sont en général plus disponibles et moins coûteux que leurs équivalents non métalliques, mais ils ont tendance à être un peu moins spécifiques de la fonction étudiée.
Principaux MRP utilisés en TEP
Généralités
La désintégration β+ se traduit par l’émission de deux photons γ de 511 keV chacun, quel que soit le radionucléide. Cette énergie correspond en effet à l’énergie d’annihilation entre un positon et un électron, grandeur indépendante du radionucléide. Les principaux radionucléides utilisables en TEP (18F, 11C, 15O et 13N) ont des périodes courtes, inférieures à 20 minutes pour le 11C, 15O et le 13N (tableau 5.2) ; ils ne peuvent donc être réalisés que dans les rares centres de recherche produisant ces nucléides sur place au moyen d’un cyclotron. Seul le 18F possède une période de 110 minutes compatible avec une utilisation en routine clinique. Cela nécessite de livrer le service de médecine nucléaire plusieurs fois par jour en MRP marqués au 18F. Le tableau 5.3 présente les MRP couramment utilisés en TEP.
Tableau 5.2 – Période des principaux radionucléides utilisables en TEP
|
Radionucléide |
Période |
|
18F |
110 min |
|
68Ga |
68 min |
|
82Rb |
75 s |
|
11C |
20 min |
|
13N |
10 min |
|
15O |
2 min |
Tableau 5.3 – Radiopharmaceutiques les plus utilisés en TEP
|
Radiopharmaceutique |
Fonction explorée |
|
18F-FDG (fluorodésoxyglucose) |
Métabolisme glucidique |
|
18F-FCH (fluorocholine) |
Métabolisme lipidique membranaire |
|
18F-(fluorure ou FNa) |
Accrétion osseuse |
|
18F-FDOPA |
Métabolisme des acides aminés Neurotransmission dopaminergique |
Intérêt du 18F-FDG
Le radiopharmaceutique de loin le plus utilisé est un analogue du glucose : le 18F-FDG. Il diffère du glucose par la substitution d’un groupe hydroxyle par un 18F. Le 18F-FDG est transporté vers le milieu intracellulaire par les transporteurs membranaires du glucose (GLUT). Il est phosphorylé en 18F-FDG-6-P par l’hexokinase comme le glucose (première étape de la glycolyse). À la différence du glucose, le 18F-FDG n’est pas davantage transformé car la présence du 18F empêche le 18F-FDG-6-P d’intégrer la deuxième étape de la glycolyse (isomérisation en fructose-6P). Le MRP s’accumule ainsi dans les cellules sous forme de 18F-FDG-6-P, sa concentration reflétant le métabolisme glucidique. Le succès de la TEP au 18F-FDG tient à sa grande sensibilité pour la détection de nombreux cancers et de certaines maladies inflammatoires ou infectieuses. Ces maladies sont en effet caractérisées par un métabolisme glucidique souvent très élevé.
Fixations physiologiques du 18F-FDG
L’avidité pour le 18F-FDG n’est toutefois pas spécifique des processus pathologiques : de nombreux tissus accumulent physiologiquement ce MRP. Ainsi, le 18F-FDG se concentre fortement au niveau cérébral, le glucose étant le principal substrat énergétique neuronal. Le tissu lymphoïde de l’anneau tonsillaire du pharynx (anciennement anneau de Waldeyer : tonsilles pharyngées, tubaires, palatines et linguales) est fréquemment hyperfixant, surtout chez l’enfant et au décours de processus infectieux ; cette fixation est d’intensité variable mais bilatérale et globalement symétrique. Il existe une très faible excrétion salivaire du traceur 18F-FDG, entraînant une fixation diffuse des glandes parotides, submandibulaires et sublinguales ; cette fixation est peu intense, bilatérale et symétrique. Les hyperfixations dites « de réactivation de graisse brune » sont fréquentes chez l’adulte jeune. Elles sont liées en général au froid et au stress ; elles sont souvent très intenses, bilatérales, symétriques, et intéressent les espaces graisseux cervicaux et thoraciques. Une hyperfixation diffuse en regard du reliquat thymique du médiastin antérieur est fréquente chez l’enfant et le sujet jeune. Elle peut également se voir chez l’adulte au décours d’un traitement par chimiothérapie. La fixation myocardique peut être intense, mais elle est très variable et dépend du régime alimentaire du patient. Le 18F-FDG peut également s’accumuler dans l’intestin grêle en conditions physiologiques normales. Le côlon présente plus fréquemment une accumulation intense de topographie très variable (diffuse ou plus segmentaire). Les ovaires et l’utérus des femmes non ménopausées présentent parfois un hypermétabolisme glucidique, qui varie selon les phases du cycle menstruel. La fixation musculaire est variable et dépend du degré d’activité des muscles, en particulier en cas d’effort ou de tension musculaire accrue pendant la période suivant l’injection. Enfin, contrairement au glucose, le 18F-FDG n’est pas réabsorbé par le tubule rénal ; il est ainsi éliminé par voie urinaire et s’accumule dans les cavités pyélocalicielles, les uretères et la vessie.
MRP pour la thérapie
La médecine nucléaire comprend également des applications thérapeutiques qui consistent à administrer des MRP fortement irradiants pour détruire un tissu cible. Il s’agit de la radiothérapie interne vectorisée (RIV) (voir chapitre 16). Les critères de choix du radionucléide sont différents des critères retenus pour l’imagerie diagnostique : pour la RIV, on utilise classiquement des émetteurs β– dont la désintégration s’accompagne de l’émission d’un électron. Contrairement aux photons γ, les électrons interagissent fortement avec les tissus biologiques et ne parcourent que quelques millimètres avant de céder leur énergie au tissu. Ce principe est couramment mis en œuvre pour le traitement des hyperthyroïdies ou des cancers différenciés de la thyroïde. Le MRP utilisé est alors l’131I. À noter que la désintégration de l’131I se traduit par une émission β– et une émission γ associée, cette dernière étant mise à profit pour acquérir des images au décours du traitement des cancers thyroïdiens.
Évolutions récentes
La TEP est une technique d’imagerie relativement récente pour laquelle de nombreux MRP ont été récemment développés.
Pour la cancérologie, on peut citer les analogues de la somatostatine (de type pentétréotide) marqués au gallium 68 (68Ga), l’avantage du 68Ga étant qu’il peut être produit dans le service de médecine nucléaire à partir d’un générateur dont la durée de vie est de plusieurs mois. Le 68Ga-DOTATATE a ainsi démontré son efficacité pour la détection des tumeurs neuroendocrines intestinales. Les ligands du prostate-specific membrane antigen (PSMA) sont une autre piste prometteuse en oncologie. Ces ligands peuvent être marqués au 68Ga ou au 18F. Ils présentent une excellente spécificité pour les adénocarcinomes prostatiques.
En neurologie, des autorisations de mise sur le marché (AMM) ont été accordées récemment pour les ligands de la plaque amyloïde marqués au 18F (18F-PIB, 18F-AV45 ou 18F-AV1). Ces MRP peuvent être utiles pour le diagnostic de certaines formes de la maladie d’Alzheimer.
En cardiologie, la TEP au rubidium 82 (82Rb), analogue du potassium, fournit des images quantitatives de la perfusion myocardique de meilleure résolution spatiale que la tomoscintigraphie des gamma-caméras conventionnelles. Le 82Rb présente l’avantage de pouvoir être produit dans le service par un générateur, tout comme le 68Ga.
Sur le versant thérapeutique, la RIV fait également l’objet de nombreux travaux de recherche. On peut citer le développement d’émetteurs α (noyaux d’hélium) qui interagissent plus fortement que les particules β– avec les tissus biologiques ; ils libèrent leur énergie en quelques dizaines de micromètres seulement. On passe ainsi d’une radiothérapie tissulaire à une radiothérapie cellulaire. La RIV avec émetteur α a été récemment proposée pour le traitement des métastases osseuses des adénocarcinomes prostatiques. Le MRP utilisé est le 223Ra, dont le comportement biologique est analogue à celui du calcium.
Ces dernières années, la RIV a connu des développements spectaculaires fondés sur l’utilisation du lutécium 177 (émetteur β–). Le 177Lu-DOTATATE, ligand des récepteurs de la somatostatine, a obtenu l’AMM pour le traitement des tumeurs neuroendocrines intestinales métastatiques. En outre, des essais cliniques prometteurs sont en cours sur le 177Lu-PSMA dans le traitement des cancers de la prostate résistants à la castration.
L’utilisation de MRP émettant à la fois des β– ou des α (utilisés pour la thérapie) et des γ ou β+ (utilisés pour l’imagerie) est à l’origine du concept de « théranostique », contraction de thérapie-diagnostique : en injectant un MRP diagnostique, on peut prédire de manière quantifiée la biodistribution du MRP thérapeutique et donc mieux planifier l’irradiation. Le couple 68Ga-DOTATATE/177Lu-DOTATATE permet ainsi une approche théranostique des tumeurs neuroendocrines métastatiques.
Instrumentation
La scintigraphie conventionnelle est réalisée au moyen d’une gamma-caméra et la TEP au moyen d’une caméra TEP. Ces appareils sont deux variantes de caméras à scintillation ; ils partagent les mêmes principes de détection des photons γ, mais ils reposent sur deux principes différents de localisation du MRP émetteur :
- la gamma-caméra localise l’émetteur γ par un principe de collimation qui consiste à détecter uniquement les photons γ émis dans une direction particulière ;
- en TEP, la localisation repose sur la détection des deux photons γ émis à 180° l’un de l’autre après annihilation du positon, sans besoin de collimateurs.
Détection des photons γ
Interaction avec le cristal scintillant
Les photons γ sont faiblement atténués par les tissus biologiques. Leur détection externe est effectuée au moyen d’un cristal dense constitué d’atomes très massiques qui absorbe leur énergie. L’utilisation de cristaux scintillants permet de convertir l’énergie cédée par les photons γ en photons visibles. L’énergie des γ est cédée aux électrons du cristal qui quittent alors leur orbite ; le retour à l’état fondamental des électrons se traduit par un phénomène de scintillation, c’est-à-dire par l’émission de multiples photons dont l’énergie est beaucoup plus faible que celle du photon γ incident, mais dont la longueur d’onde est dans le domaine du visible (photons lumineux), et pour lesquels le cristal est transparent. La détection de chaque photon γ entraîne l’émission de 103 à 104 photons lumineux (figure 5.2) qui vont traverser le cristal sans interagir.
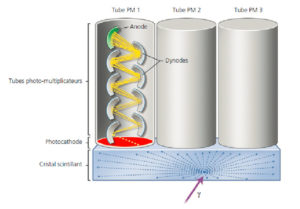
Détection des photons γ par un cristal scintillant couplé à des tubes PM.
L’interaction d’un photon γ avec le cristal se traduit par l’émission de 103 à 104 photons lumineux (flèches bleues) qui traversent le cristal sans interagir avec lui. Le principe du tube PM est illustré pour le tube PM1. Sous l’impact d’un photon lumineux, la photocathode (rouge) libère un électron (flèche jaune) qui est ensuite accéléré par la différence de potentiel photocathode/dynode et vient frapper la première dynode. Chaque électron incident arrache plusieurs électrons secondaires à la dynode, qui sont à leur tour accélérés puis démultipliés sur une dizaine de dynodes successives avant de frapper l’anode (vert).
Dessin : Cyrille Martinet.
Photomultiplication
L’étape suivante consiste à transformer les photons lumineux en un signal électrique et à l’amplifier suffisamment pour qu’il puisse être mesuré sous forme d’une tension électrique. C’est le rôle du tube photomultiplicateur (PM) constitué d’une photocathode (face d’entrée des photons lumineux), d’une série de dynodes (électrodes portées à des potentiels croissants) et d’une anode (figure 5.2). Sous l’impact des photons lumineux, la photocathode libère des électrons qui sont ensuite accélérés par la différence de potentiel photocathode/dynode et viennent frapper la première dynode. Chaque électron incident arrache plusieurs électrons secondaires à la dynode, qui sont à leur tour accélérés puis démultipliés sur une dizaine de dynodes successives avant de frapper l’anode. Les démultiplications successives se traduisent par un gain d’amplification considérable, de l’ordre de 109, conduisant à un signal mesurable sous la forme d’une impulsion électrique.
À noter que le nombre d’électrons frappant l’anode est proportionnel au nombre de photons lumineux en entrée du PM, lui-même proportionnel à l’énergie du photon γ détecté. Ainsi, ces étapes de détection conservent la proportionnalité entre l’énergie du photon γ et l’amplitude du signal (impulsion de tension à l’anode).
Sélection par l’énergie
Pour un MRP dont la désintégration entraîne une émission γ d’énergie donnée, on pourrait s’attendre à mesurer des impulsions de tension d’amplitudes identiques. Ce serait le cas si les photons γ n’interagissaient pas avec les tissus biologiques. Or, une partie des photons γ interagit avec la matière organique, principalement sous forme de diffusion Compton. Au cours de cette interaction, le photon γ d’origine disparaît au profit d’un nouveau photon γ (le photon diffusé) qui est émis dans une direction différente de celle du γ d’origine et possède une énergie plus faible. En scintigraphie conventionnelle comme en TEP, les photons diffusés peuvent représenter une part importante – parfois majoritaire – des photons détectés. L’interaction Compton pouvant se dérouler à distance du site d’émission du photon γ d’origine, la détection des photons diffusés est source d’erreur de localisation du MRP. Il convient donc d’éliminer du comptage le signal issu des photons diffusés. Pour ce faire, il suffit de conserver uniquement les impulsions dont l’amplitude correspond à l’énergie des photons émis par le MRP. On effectue ainsi une sélection par l’énergie. Outre qu’elle permet de s’affranchir des erreurs de localisation liées à la diffusion Compton, cette méthode de sélection par l’énergie permet de détecter simultanément les photons γ issus de deux radionucléides différents administrés à un patient. Cette technique de double marquage permet ainsi de suivre simultanément deux processus physiologiques. On peut citer l’exemple de la ventilation pulmonaire mesurée par du 81mKr (190 keV) et de la perfusion pulmonaire mesurée par des agrégats d’albumine marqués au 99mTc (140 keV).
Localisation de l’impact du photon γ sur le cristal
L’absorption d’un photon gamma sur le cristal entraîne l’émission de 103 à 104 photons lumineux dans des directions aléatoires. Pour localiser ce point d’impact, on utilise la logique d’Anger, du nom de l’inventeur de la gamma-caméra. Cette approche consiste à « tapisser » la surface du cristal d’une batterie de PM. Le nombre de photons lumineux captés par un PM est inversement proportionnel à la distance entre le PM considéré et le point d’impact du photon γ. La détection d’un photon γ est donc associée à la réception par plusieurs PM d’impulsions électriques dont les amplitudes respectives permettront de remonter au lieu exact de l’impact. La figure 5.2 illustre cette logique de localisation : le tube PM2 reçoit davantage de photons lumineux que le tube PM3 qui en reçoit davantage encore que le PM1. La comparaison entre les nombres de photons lumineux détectés par chaque PM permet de déterminer la position du point d’impact sur le cristal. À noter que la répartition des photons scintillants sur plusieurs PM n’entraîne pas la perte de l’information sur l’énergie du photon γ détecté. Il suffit pour recouvrer cette information de sommer les impulsions de tension générées par tous les PM à un instant donné. On arrive ainsi à localiser le point d’impact tout en gardant la possibilité de faire une sélection par l’énergie.
Types d’enregistrement des données
Les coordonnées du point d’impact du photon γ sont transformées en une position numérique traitée informatiquement pour former l’image. Au cours de l’examen d’imagerie, le nombre d’impacts photoniques peut être considérable (plusieurs millions). Ces données peuvent être stockées de plusieurs manières, selon la capacité de stockage de l’imageur et la résolution temporelle souhaitée :
- le mode intégratif (ou incrémental) consiste à sommer les impacts successifs détectés pour chaque adresse numérique ;
- le mode liste consiste à enregistrer, pour tous les photons γ détectés, leur temps d’impact et leur position. Les images ne sont disponibles qu’à la fin de l’acquisition, mais on peut choisir a posteriori le temps d’accumulation des images. Par exemple, une acquisition de 2 minutes pourra être reconstruite sous la forme de 20 images d’une minute ou d’une image de 20 minutes ;
- le mode liste peut être combiné avec l’enregistrement indépendant d’un mouvement physiologique périodique comme le cycle cardiaque. Cela permet de synchroniser a posteriori le signal d’imagerie (constitué des impacts photoniques) et le signal physiologique. On peut alors reconstruire séparément les images correspondant à différentes phases du cycle. Ce mode d’acquisition synchronisé est couramment utilisé en médecine nucléaire cardiologique ;
- il est également possible d’acquérir des images à divers temps après l’injection (par exemple 5 minutes, 3 heures, 24 heures) pour apprécier l’évolution de la distribution du MRP.
L’enregistrement des points d’impact des photons γ tel que décrit ci-dessus ne suffit pas à déterminer la position spatiale du MRP. Pour ce faire, il faut utiliser un système de collimation. C’est sur ce point que les gamma-caméras et les caméras TEP diffèrent fondamentalement, la scintigraphie conventionnelle utilisant une collimation physique tandis que la TEP utilise une collimation électronique.
Gamma-caméra
Collimation physique
En l’absence de collimation, les photons γ seraient détectés de façon identique quelle que soit l’incidence avec laquelle ils atteignent le cristal. Ainsi, la seule connaissance de leur point d’impact ne permettrait pas de déterminer leur origine, et donc de localiser leur source.
Les collimateurs des gamma-caméras sont des plaques de plomb percées de canaux séparés par des cloisons, les septums (figure 5.3). Les collimateurs à canaux parallèles, orientés perpendiculairement à la surface du cristal, sont les plus utilisés. Ils permettent de détecter uniquement les photons ayant une incidence perpendiculaire au cristal, les photons obliques étant arrêtés par les septums de plomb. Le point d’impact du photon γ dans le cristal correspond ainsi à la position spatiale du MRP ; le collimateur à canaux parallèles fournit une image en projection de la distribution du MRP.
D’autres géométries de collimateurs peuvent être utilisées, comme le collimateur sténopé (pinhole en anglais) qui se présente sous la forme d’un cône de plomb percé à son sommet (figure 5.3). Il permet une excellente résolution spatiale par effet de grandissement, aux dépens d’une sensibilité médiocre liée à la petite taille du trou. Il est principalement utilisé pour la scintigraphie de la thyroïde, organe de petite taille.
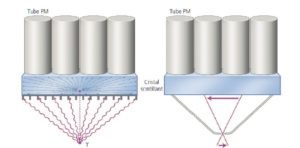
Collimateurs parallèle (gauche) et sténopé (droite) installés devant le cristal plan d’une gamma-caméra.
Dessin : Cyrille Martinet.
Détecteurs plans de grande dimension
La plupart des gamma-caméras actuelles sont constituées de deux détecteurs plans de grande taille mesurant typiquement 40 × 60 cm2 (figure 5.4A). Chaque détecteur est constitué d’une dalle de cristal d’iodure de sodium dopé au thallium NaI(Tl) d’environ 2 cm d’épaisseur couplée à une centaine de PM. Le NaI est suffisamment dense et de nombre de masse suffisamment élevé pour qu’une épaisseur de 2 cm interagisse efficacement avec les photons γ. L’efficacité d’interaction varie cependant avec l’énergie des photons γ : elle est plus élevée pour les photons peu énergétiques comme ceux émis par le 201Tl (80 keV) que pour ceux émis par l’131I (364 keV).
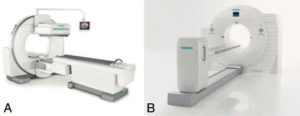
Gamma-caméra (A) et caméra TEP (B).
Source : avec l’aimable autorisation de la société Siemens.
Les deux détecteurs sont montés sur un statif, dispositif permettant leur rotation autour du patient pour un positionnement adapté à chaque type d’examen.
Résolution spatiale et sensibilité
La résolution spatiale d’une gamma-caméra dépend principalement de la géométrie du collimateur (épaisseur des septums, diamètre et profondeur des canaux). Cette géométrie est le fruit d’un compromis entre résolution spatiale et sensibilité : des canaux très étroits séparés par des septums épais améliorent la résolution spatiale aux dépens du nombre de coups détecté par canal.
Ce compromis n’est pas le même pour des photons γ incidents de basse et de haute énergie, si bien qu’une gamma-caméra dispose en général de plusieurs collimateurs adaptés aux différents niveaux d’énergie des radionucléides utilisés.
Quelle que soit la géométrie du collimateur, son rôle est d’arrêter tous les photons γ qui ne sont pas émis dans la direction souhaitée, si bien qu’une très faible fraction des photons émis – de l’ordre de 1/10 000 – atteint le cristal. Cette faible sensibilité de détection limite la résolution spatiale des gamma-caméras à environ 10 mm.
Images planaires
La détection avec collimation physique fournit une projection de la distribution du MRP sur le plan du détecteur. Cette image planaire peut être acquise de manière statique, dynamique ou par balayage.
Pour une acquisition statique, les détecteurs sont placés en regard de la région du corps à explorer et conservent une position fixe pendant la durée de l’acquisition, typiquement une dizaine de minutes.
L’acquisition dynamique procède de la même manière, à cela près que plusieurs images sont acquises successivement en mode cinéma, ou à différents instants après l’administration du MRP. On peut citer l’exemple de la scintigraphie rénale qui permet l’évaluation de l’excrétion par mesure de la cinétique d’élimination rénale du MRP.
La taille limitée des détecteurs plans (environ 40 × 60 cm2) ne permet pas d’acquérir des images du corps entier en mode statique. Pour ce faire, on effectue une acquisition par balayage qui consiste à déplacer le détecteur le long du patient au cours de l’acquisition, de sorte que l’ensemble du corps passe devant le détecteur. En pratique, le balayage est le plus souvent effectué en déplaçant le lit du patient par rapport au détecteur, ce qui revient strictement au même pour les images.
Tomoscintigraphie
Les images planaires sont une superposition des plans situés à différentes profondeurs du sujet par rapport au détecteur. Ces images sont souvent suffisantes pour obtenir l’information clinique recherchée. Cependant, elles ne permettent pas de différencier les fixations du MRP situées à différentes profondeurs. S’il est possible d’acquérir des images planaires selon différentes incidences pour lever certaines ambiguïtés, l’acquisition planaire reste limitée par une localisation anatomique imprécise et un contraste médiocre (l’intensité de fixation est moyennée sur toute la profondeur du sujet).
Lorsque la question médicale nécessite une localisation précise, on utilise un mode d’acquisition similaire aux techniques d’imagerie en coupe de type TDM : la tomographie d’émission monophotonique (TEMP) ou tomoscintigraphie (single photon emission tomography [SPECT]). Le principe consiste à faire pivoter le détecteur autour du patient pendant l’acquisition, ce qui revient à acquérir des projections de l’activité selon un grand nombre d’incidences (figure 5.5A). À partir de ces projections, on peut reconstruire la distribution tridimensionnelle du MRP par rétroprojection filtrée ou par méthode itérative (voir chapitre 9).
Tomographie d’émission monophotonique (A) et TEP (B).
Dessin : V. Lebon.
La tomoscintigraphie est d’utilisation courante et permet d’explorer les patients sur une hauteur d’environ 40 cm correspondant à la taille du détecteur. La durée d’acquisition relativement longue – typiquement 15 minutes – fait que l’acquisition tomoscintigraphique est généralement ciblée sur une zone spécifique, sans être répétée pour couvrir l’ensemble du corps. Il n’est généralement pas non plus possible de réaliser des acquisitions dynamiques en mode tomographique. Parmi les applications les plus courantes de la tomoscintigraphie, on peut citer la cardiologie (figure 5.6), les explorations ostéoarticulaires (figure 5.7) ou neurologiques (scintigraphie cérébrale de perfusion ou des transporteurs dopaminergiques).
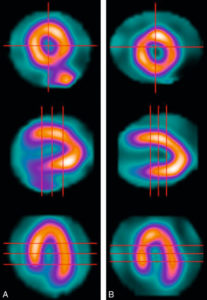
Tomoscintigraphie de perfusion myocardique chez un patient au repos.
Coupes petit axe (haut), grand axe verticale (milieu) et grand axe horizontale (bas) acquises en 18 minutes sur une gamma-caméra conventionnelle NaI (A). Mêmes coupes acquises en 4 minutes sur une gamma-caméra CdZnTe cardiologique General Electric (B).
Source : avec l’aimable autorisation du Dr Gimelli, Fondazione Toscana/CNR G. Monasterio, Pise, Italie.
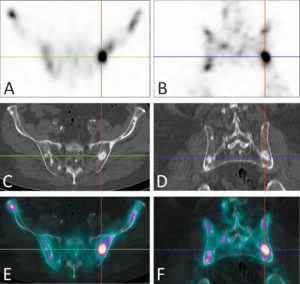
Tomoscintigraphie osseuse acquise sur une caméra hybride gamma-caméra/TDM chez un patient présentant des métastases de cancer de la prostate.
La tomoscintigraphie dans les plans axial (A) et coronal (B) révèle plusieurs foyers d’hyperfixation osseuse au niveau du bassin. La TDM acquise dans les mêmes plans retrouve des lésions condensantes en regard de ces foyers (C, D). La fusion des deux modalités conforte le diagnostic de métastases osseuses (E, F).
Source : Université Paris-Saclay/CEA-SHFJ, Orsay, France.
Caméra TEP
Collimation électronique
La TEP détecte les photons d’annihilation des positons produits par la désintégration d’émetteurs β+. Si le principe de détection des photons γ par cristal scintillant couplé aux PM est identique à celui utilisé dans les gamma-caméras, le principe de collimation est fondamentalement différent en TEP. L’annihilation d’un positon produit en effet deux photons γ de 511 keV émis simultanément (en coïncidence) à 180° l’un de l’autre. En utilisant une couronne de détecteurs placés autour du corps, la TEP permet de détecter les deux photons d’annihilation (figure 5.5B). La détection simultanée de deux photons de 511 keV en deux points de la couronne implique que l’annihilation du positon se situe sur la ligne reliant ces deux points qu’on appellera « ligne de réponse ». En enregistrant les détections en coïncidence selon toutes les directions, on obtient des projections selon un grand nombre d’incidences. La reconstruction d’images en coupes se fait ensuite selon le même principe que pour la tomoscintigraphie. En pratique, on enregistre les détections intervenant quasi simultanément, dans une fenêtre temporelle appelée « fenêtre de coïncidence ». L’utilisation d’une fenêtre suffisamment large – environ 10 ns – est nécessaire car les deux photons d’annihilation se déplacent à la vitesse de la lumière et n’atteignent pas strictement simultanément leur détecteur (la désintégration se produit nécessairement plus près d’un détecteur que de l’autre). Ainsi, la détermination de l’incidence des photons γ en TEP ne nécessite pas de collimateur physique : elle repose sur le réglage de la fenêtre temporelle de mesure du signal, d’où la terminologie « collimation électronique ».
Blocs détecteurs arrangés en couronne
Les caméras TEP (voir figure 5.4B) actuellement commercialisées sont constituées d’une centaine de blocs détecteurs parallélépipédiques disposés en couronne. La détection au sein de chaque bloc s’effectue de la même manière que dans le détecteur plan d’une gamma-caméra : par interaction avec un cristal scintillant couplé à des PM, puis détermination du point d’impact par la logique d’Anger à l’échelle du bloc. Une différence notable tient à la pixellisation du cristal : chaque bloc ne contient pas une dalle de cristal unique, mais une matrice de cristaux (typiquement 8 × 8) séparés les uns des autres par un matériau réfléchissant.
Contrairement à la scintigraphie conventionnelle, la TEP détecte des photons γ de même énergie quel que soit le MRP utilisé. Cette énergie (511 keV) est par ailleurs supérieure à celle des photons γ détectés en scintigraphie conventionnelle (70-360 keV). Cela impose l’utilisation de cristaux plus denses constitués d’atomes plus massiques (de type germanate de bismuth [BGO], orthosilicate de lutétium [LSO], oxyorthosilicate d’yttrium [YSO], YSO couplé au LSO [LYSO]).
Résolution spatiale et sensibilité
L’absence de collimateur physique confère à la TEP :
- une sensibilité (capacité à détecter une faible quantité de MRP) supérieure à la scintigraphie conventionnelle de plusieurs ordres de grandeur (puisque le rôle du collimateur est d’arrêter une grande majorité des rayons) ;
- une meilleure résolution spatiale (puisque le collimateur est le facteur qui limite la résolution des gamma-caméras). Cette résolution dépend principalement des dimensions des cristaux scintillants. Elle est d’environ 4 mm sur les caméras TEP commercialisées actuellement.
Nous avons vu précédemment que l’annihilation du positon ne se produit pas exactement à l’endroit où se désintègre le MRP. Cependant, la distance parcourue par le positon avant annihilation est en général inférieure à la résolution spatiale des caméras TEP, si bien que ce phénomène n’affecte pas significativement la localisation du MRP.
La sensibilité de détection de la TEP peut être améliorée par la technique du temps de vol, qui consiste à mesurer la différence entre les temps d’arrivée des deux photons sur leur détecteur. Le premier détecteur à interagir avec un photon est situé plus près du MRP que le détecteur qui interagit plus tard avec le second photon. Les caméras peuvent distinguer les temps d’arrivée des photons avec une précision de l’ordre de 300 ps. Compte tenu de la vitesse de la lumière, cela correspond à une localisation spatiale à une précision de l’ordre de :
δx = c × δt = 3.108 m ⋅ s-1 × 3.10-10 s = 9.10-2 m ≈10 cm
Cela n’est possible que pour les cristaux possédant une très bonne résolution temporelle (les photons de scintillation ne sont émis que très brièvement après l’absorption du photon γ) : seuls les cristaux d’oxyorthosilicate de germanium (GSO), de LSO ou d’YSO présentent une résolution temporelle suffisante. Le temps de vol n’améliore pas la résolution spatiale des images TEP, mais il améliore la sensibilité de détection car l’information temps de vol permet de réduire le bruit statistique dans l’image reconstruite. Cette technique est désormais proposée sur la quasi-totalité des caméras TEP.
La sensibilité élevée de la TEP permet de réaliser des tomographies dynamiques (3D + t), ce qui n’est généralement pas possible en tomoscintigraphie compte tenu de la durée d’acquisition élevée. Cela est couramment utilisé pour la recherche de métastases des cancers de la prostate en TEP à la 18F-fluorocholine (FCH) : l’acquisition d’images dynamiques précoces permet d’étudier la région pelvienne avant l’élimination urinaire du MRP susceptible de masquer les lésions. Les autres régions du corps sont analysées sur une acquisition plus tardive.
Caméras hybrides et dosimétrie
La plupart des caméras de médecine nucléaire combinent un système de détection des photons γ ou β+ et une TDM ; ce sont des appareils hybrides « gamma-caméra-TDM » ou « TEP-TDM » dont l’intérêt est double :
- ils permettent de combiner les données fonctionnelles de la médecine nucléaire (tomoscintigraphie ou TEP) aux données morphologiques de la TDM. Les images fonctionnelles (représentées en couleur) et les images morphologiques (représentées en noir et blanc) sont fusionnées, permettant une localisation anatomique précise des sites de fixation du MRP (figures 5.7 et 5.8) ;
- la TDM permet en outre de corriger les images de médecine nucléaire de l’atténuation des photons. Les photons γ sont en effet atténués par diffusion Compton dans les tissus mous et par effet photoélectrique dans l’os, ce phénomène étant d’autant plus important que les photons sont émis dans des régions profondes ou très atténuantes comme le tissu osseux. Pour éviter de sous-estimer la fixation de ces régions, il faut corriger l’activité mesurée en chaque point du corps en estimant l’atténuation des photons γ émis depuis ce point. Or, la TDM, par construction, représente l’atténuation des photons X en chaque point du corps. On peut facilement en extrapoler l’atténuation des photons γ et effectuer une correction d’atténuation des images de tomoscintigraphie ou de TEP.
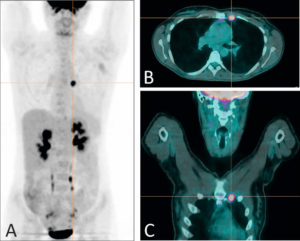
TEP au 18F-FDG chez une patiente présentant une atteinte métastatique de cancer du sein.
La représentation en mode maximum intensity projection (A) permet une visualisation de tous les sites d’accumulation du 18F-FDG ; outre les sites physiologiques (cerveau, reins, urètres, vessie), la TEP révèle un foyer hypermétabolique pathologique au niveau thoracique. La fusion avec la TDM dans les plans axial (B) et coronal (C) permet d’attribuer ce foyer à une métastase lymphatique mammaire interne gauche.
Source : Université Paris-Saclay/CEA-SHFJ, Orsay, France.
Pour limiter l’exposition des patients, les images TDM acquises sur les caméras hybrides utilisent en général un flux relativement faible de photons X. L’objectif de la TDM couplée à la médecine nucléaire étant la localisation des fixations et la correction d’atténuation, des images de moins bonne qualité qu’en TDM diagnostique suffisent. En pratique, la diminution du flux de photons X permet de diminuer la dose efficace de la TDM d’environ 50 %, à environ 8 mSv pour un corps entier. Ce niveau est similaire à celui d’une TEP au 18F-FDG, légèrement supérieur à celui d’une scintigraphie osseuse au 99mTc- hydroxyméthylène diphosphonate (HMDP) (environ 5 mSv).
Quantification de la fixation
Les images de médecine nucléaire peuvent être interprétées de manière visuelle qualitative, c’est-à-dire en décrivant la topographie des fixations anormales (hyperfixations ou hypofixations). Il est parfois possible de les interpréter de manière quantitative en estimant l’activité dans une région du corps (en kBq/mL), c’est-à-dire la quantité de MRP fixé dans cette région. Une telle quantification absolue n’est possible que pour les acquisitions tomographiques (TEP ou tomoscintigraphie).
La quantification est particulièrement utile pour l’évaluation thérapeutique des patients (comparaison de la fixation entre deux examens successifs). Elle peut apporter une information diagnostique (une fixation supérieure à un seuil donné peut orienter vers une maladie) ou pronostique (l’intensité de fixation de certaines tumeurs est corrélée à la survie des patients). Elle peut également contribuer à affiner la stratégie thérapeutique en permettant de délimiter des champs de radiothérapie.
Pour quantifier la fixation d’un MRP, il faut au préalable corriger les images de nombreux biais :
- l’atténuation des photons γ par les tissus biologiques (corrigée grâce aux images TDM) (voir plus loin) ;
- la diffusion Compton : la sélection par l’énergie ne permet pas d’éliminer les photons diffusés qui possèdent une énergie très proche de celle des photons de désintégration mais dont la direction a changé (ces photons sont donc mal localisés). Certaines techniques de traitement d’image permettent de corriger cet effet ;
- les coïncidences fortuites en TEP : deux photons issus de l’annihilation de deux positons différents peuvent en effet être détectés simultanément (dans la fenêtre de coïncidence). Ce phénomène n’est pas rare compte tenu du taux très élevé de désintégrations dans l’anneau de la caméra TEP. La détection de coïncidences fortuites peut être limitée par la réduction de la largeur de la fenêtre de coïncidence. Les signaux fortuits détectés peuvent aussi être estimés et un traitement des données permet de les soustraire.
En pratique, la correction des biais de quantification en tomoscintigraphie est imprécise. Elle souffre principalement d’une correction d’atténuation approximative et d’une résolution spatiale médiocre. Cela n’empêche pas de corriger les images de leurs biais pour en améliorer l’aspect et faciliter l’interprétation visuelle.
La correction des biais de quantification en TEP est beaucoup plus précise (la correction d’atténuation en TEP est exacte et la résolution spatiale très supérieure à la tomoscintigraphie). Les images de TEP se prêtent donc à une analyse quantitative. L’accumulation locale du MRP est mesurée par la valeur de fixation normalisée standard uptake value (SUV). La SUV peut se définir comme le rapport C/C0 où C est la concentration du MRP dans le voxel et C0 la concentration de dilution homogène dans le volume du corps (concentration théorique obtenue si le MRP se répartissait de façon homogène dans le patient) :
C0 = q / ( m/ρ) donc SUV = (C × m) / (q × ρ)
où q est l’activité injectée, m la masse du patient et ρ sa masse volumique estimée à 1 kg/L.
Évolutions technologiques récentes
Gamma-caméras à cristaux semi-conducteurs
Les principales limitations des gamma-caméras tenant à leur faible résolution spatiale et leur faible sensibilité, la recherche s’est portée sur le développement de cristaux plus sensibles. La principale voie d’amélioration réside dans le remplacement des cristaux scintillants par des cristaux semi-conducteurs de la famille du tellure de cadmium (CdTe ou CdZnTe ou CZT). Ces derniers convertissent directement l’énergie du photon γ absorbé en impulsion électrique, sans l’intermédiaire de photons lumineux, ce qui permet de s’affranchir des PM. Ils permettent aussi de mesurer la profondeur d’interaction du photon γ dans le cristal, ce qui améliore la localisation de la source radioactive. Ces cristaux peuvent être pixellisés (comme ceux des blocs de détection de la TEP), chaque cristal individuel pouvant posséder sa propre électronique de détection. Le couplage direct entre le cristal et l’électronique permet de s’affranchir de la logique d’Anger. Cette nouvelle génération de détecteurs est plus compacte que la précédente. Cela permet de disposer les détecteurs au plus près du patient et d’augmenter ainsi la sensibilité de détection et la résolution spatiale.
Les premières gamma-caméras à cristaux semi-conducteurs ont été développées pour la cardiologie. Elles sont constituées d’une dizaine de blocs de détection disposés en arc de cercle autour du thorax, chaque bloc comprenant un cristal pixellisé couplé à un collimateur sténopé. Comparativement à une gamma-caméra conventionnelle, le gain peut atteindre un facteur 5 à 10 pour la sensibilité et un facteur 2 à 3 pour la résolution spatiale (voir figure 5.6B). Une partie importante de ces gains s’explique par la géométrie optimisée de la caméra, les détecteurs se trouvant presque au contact de la paroi thoracique. Depuis peu, les gamma-caméras à cristaux semi-conducteurs permettent des explorations corps entier ; on parle alors de caméras CZT « grand champ ». Les modèles les plus récents utilisent une douzaine de détecteurs mobiles répartis autour du sujet sur un anneau de 360° ; chaque détecteur se positionne automatiquement au plus près du sujet, maximisant ainsi la sensibilité de détection quel que soit l’étage imagé (figure 5.9A).
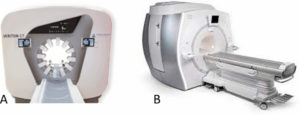
Gamma-caméra CZT « grand champ » à détecteurs mobiles (A) et imageur hybride TEP-IRM (B).
Source : avec l’aimable autorisation des sociétés Spectrum Dynamics et General Electric.
Caméras TEP « numériques » et TEP-IRM
Les évolutions récentes en TEP portent sur le remplacement des tubes PM (très encombrants) par des photodiodes plus compactes. Cela permet d’associer à chaque cristal « pixellisé » (de quelques millimètres de côté) sa propre diode photomultiplicatrice, alors que dans les caméras TEP « classiques », chaque tube PM est couplé à un ensemble de quatre ou neuf cristaux. La sensibilité est ainsi améliorée par le couplage de chaque cristal à sa propre électronique de détection. Ce couplage permet en outre de s’affranchir de la logique d’Anger. Les caméras TEP équipées de photodiodes au silicium sont parfois appelées « TEP numériques ».
Un autre avantage des photodiodes au silicium est leur compatibilité avec les champs magnétiques. Leur développement a permis de lever le principal obstacle à la réalisation de caméras hybrides TEP-IRM (figure 5.9B). Ces caméras sont installées depuis peu. Leur intérêt diagnostique est en cours d’évaluation.
Essentiel à retenir
- L’imagerie de la médecine nucléaire repose sur la localisation d’un médicament radiopharmaceutique (MRP) préalablement administré au patient.
- La spécificité des images scintigraphiques tient à leur caractère fonctionnel : elles reflètent le comportement cinétique ou métabolique du MRP administré.
- La médecine nucléaire propose deux techniques d’imagerie : la scintigraphie dite « conventionnelle » et la TEP. La scintigraphie conventionnelle est effectuée au moyen d’une gamma-caméra et de MRP émetteurs de photons γ. La TEP utilise des MRP émetteurs de positons (désintégration β+). Les positons s’annihilent avec un électron à proximité de leur site d’émission, donnant naissance à une paire de photons γ qui sont détectés en TEP.
- Les MRP utilisés pour l’imagerie sont constitués d’un radionucléide (qui émet un rayonnement γ ou β+) lié à un vecteur (qui se fixe sur une structure particulière de l’organisme). Les MRP sont administrés à des concentrations extrêmement faibles (très inférieures à la nanomole), ce qui distingue la médecine nucléaire des autres techniques d’imagerie fonctionnelle.
- La scintigraphie conventionnelle dispose d’une grande variété de MRP différents, adaptés aux différentes questions diagnostiques. Le 99mTc est le radionucléide le plus couramment utilisé pour ces MRP.
- En routine clinique, la TEP utilise des MRP marqués au 18F, au sein desquels le 18F-FDG, marqueur de métabolisme glucidique, occupe une place prépondérante.
- Les gamma-caméras et les caméras TEP sont deux variantes de caméras à scintillation ; elles partagent le même principe de détection des photons γ, mais elles utilisent deux principes différents de localisation du MRP émetteur.
- La détection des photons γ en scintigraphie conventionnelle comme en TEP repose sur l’utilisation de cristaux scintillants couplés à des PM.
- Les gamma-caméras localisent le MRP au moyen de collimateurs placés entre le patient et le cristal scintillant.
- Les caméras TEP localisent le MRP en détectant les deux photons γ émis simultanément à 180° l’un de l’autre lors de l’annihilation du positon dans le patient.
- Les caméras TEP présentent une sensibilité et une résolution spatiale meilleures que celles des gamma-caméras.
 |
Chapitre suivant |
 |
Retour au sommaire |
