Les fondamentaux – Chapitre 8 – Imagerie par résonance magnétique
T. Tourdias et V. Lebon
Plan du chapitre
- Le phénomène de résonance magnétique nucléaire
- Principes de localisation du signal en IRM
- Les principales séquences d’IRM
- Agents de contraste en IRM
- Réalisation pratique d’un examen IRM
Objectifs
- Connaître les bases du phénomène de résonance magnétique nucléaire.
- Connaître les principes généraux permettant la localisation spatiale du signal en IRM.
- Connaître le principe général des principales séquences d’IRM.
- Connaître les règles d’utilisation des agents de contraste pour l’IRM.
- Savoir expliquer à un patient la conduite pratique d’un examen IRM.
Le phénomène de résonance magnétique nucléaire
Apparue à l’hôpital dans les années 1980, l’imagerie par résonance magnétique (IRM) exploite le phénomène de résonance magnétique nucléaire (RMN). Ce phénomène, qui met en jeu les particules élémentaires du noyau atomique, peut être décrit en toute rigueur par la mécanique quantique. Cependant, les phénomènes macroscopiques observés lors d’une expérience d’IRM peuvent être décrits à l’aide d’outils vectoriels plus simples. Cette description phénoménologique, qui repose sur un formalisme mathématique adapté au diplôme de formation générale en sciences médicales (DFGSM), sera utilisée dans ce chapitre.
Notions de source magnétique, de champ magnétique et d’aimantation
Une source magnétique est un système qui génère un champ magnétique , dont la valeur s’exprime en teslas (T). C’est par exemple une boucle de courant (courant électrique dans un circuit en forme de cercle : électro-aimant), ou bien une tige de métal aimantée comme l’aiguille d’une boussole (figure 8.1).
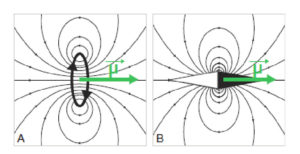
Exemples de sources magnétiques.
Une boucle de courant (A) ou une aiguille aimantée (B) génèrent un champ magnétique, représenté par les lignes de champ ; le moment magnétique µ est une représentation vectorielle de la source magnétique.
Cette source génère un champ magnétique, champ vectoriel qu’on peut représenter sous forme de lignes d’isochamp dans un plan particulier de l’espace. Une façon plus simple de représenter la source magnétique consiste à utiliser un vecteur, qu’on appelle « moment magnétique » et qu’on note . La norme du vecteur traduit l’intensité de la source magnétique et les coordonnées du vecteur traduisent l’orientation de cette source. La densité de moment magnétique (moment magnétique par unité de volume) est appelée « aimantation » et notée M.
Deux moments magnétiques interagissent entre eux via leurs champs magnétiques. Le champ magnétique B0 résultant d’un premier moment magnétique exerce un couple sur le second moment, c’est-à-dire qu’il tend à le faire tourner pour l’aligner dans la direction du champ magnétique (figure 8.2). La position d’équilibre d’une aimantation dans un champ magnétique est donc la position alignée par rapport à ce champ. C’est ainsi que le champ magnétique terrestre oriente l’aiguille des boussoles.
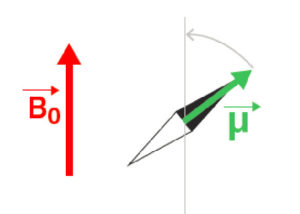
Interaction entre une aimantation μ et un champ magnétique statique B0: µ s’aligne parallèlement à B0.
Aimantation nucléaire
Les noyaux de certains atomes possèdent une aimantation intrinsèque. Par analogie avec la boucle de courant, on considère cette aimantation comme résultant du déplacement des particules élémentaires chargées qui tournent sur elles-mêmes ou en orbite. Le terme « spin » (qui signifie tourner en anglais) est parfois utilisé pour désigner l’aimantation d’une particule élémentaire qui tourne sur elle-même. En toute rigueur, le spin désigne un observable quantique dont la manipulation dépasse le cadre de cet ouvrage.
Les noyaux d’hydrogène – qui sont constitués d’un simple proton – font partie des noyaux possédant une aimantation intrinsèque. Ils présentent un intérêt majeur pour l’exploration du corps humain dans lequel l’hydrogène est très abondant, puisque les tissus biologiques sont principalement constitués d’eau et de triglycérides (graisse sous-cutanée et viscérale). L’IRM consiste à détecter l’aimantation des noyaux d’hydrogène et à la localiser pour reconstruire des images qui, en première approximation, sont des cartes de distribution de l’eau et de la graisse du corps humain.
Détecter les aimantations nucléaires n’a rien d’évident, pour deux raisons :
- en l’absence de champ magnétique, les aimantations microscopiques sont orientées aléatoirement (figure 8.3A), si bien que leur somme vectorielle est nulle. Cela reste vrai dans le champ magnétique terrestre dont l’intensité est trop faible pour modifier significativement l’orientation des aimantations microscopiques. Il faudra donc au préalable « polariser » ces aimantations, c’est-à-dire les orienter dans une direction privilégiée ;
- on ne sait détecter efficacement une aimantation peu intense (ce qui est le cas de l’aimantation nucléaire) qu’en la mettant en mouvement. Il faudra pour cela la mettre en résonance.
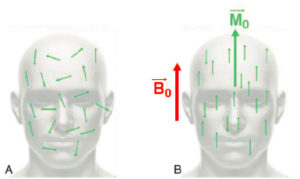
A, B. Polarisation des aimantations nucléaires.
En l’absence de champ magnétique, les aimantations des noyaux d’hydrogène sont orientées de manière aléatoire : leur somme vectorielle est nulle (A) ; en présence d’un champ B0, elles s’orientent le long du champ B0, en position parallèle ou antiparallèle. L’orientation parallèle étant majoritaire, il en résulte une aimantation macroscopique M0 parallèle à B0(B).
Les noyaux d’hydrogène sont donc porteurs d’une aimantation qui tend spontanément à s’aligner avec le champ magnétique B0.
Polarisation de l’aimantation par un champ magnétique B0
En présence d’un champ magnétique B0, les aimantations des noyaux d’hydrogène adoptent une orientation privilégiée. Par analogie avec les aimantations macroscopiques, on peut les représenter comme des vecteurs tendant à s’aligner parallèlement à B0. Mais, à l’échelle atomique, l’énergie d’interaction entre l’aimantation d’un noyau d’hydrogène et le champ B0 est quantifiée : elle ne peut prendre que deux valeurs discrètes. Cela implique que l’aimantation nucléaire ne peut adopter que deux orientations dans le champ magnétique B0: « parallèle » et « antiparallèle » (figure 8.3B). L’état parallèle est plus peuplé que l’état antiparallèle. Le surplus d’aimantations microscopiques orientées dans la même direction que B0 donne naissance à une aimantation nucléaire macroscopique M0.
M0 est reliée à B0 par la relation : M0 = x * B0. Le coefficient de proportionnalité χ est la susceptibilité magnétique qui caractérise la capacité d’un milieu de s’aimanter sous l’effet d’un champ magnétique externe. Dans un milieu homogène infini de susceptibilité χ, si l’on applique un champ magnétique B0, le milieu va s’aimanter et le champ magnétique résultant sera (1 + χ).. Selon le cas, on peut avoir :
- χ < 0 : le champ magnétique est diminué en présence du matériau qui est dit « diamagnétique » ;
- χ > 0 de faible valeur : le champ magnétique est renforcé en présence du matériau qui est dit paramagnétique ;
- χ > 0 de forte valeur : le champ magnétique est très renforcé en présence du matériau qui est dit ferromagnétique.
Une fois l’aimantation macroscopique M0 créée, il faut la mettre en mouvement pour la détecter.
Dans un fort champ magnétique, les aimantations des noyaux d’hydrogène s’alignent entre elles. La résultante est une aimantation globale de la matière alignée sur B0 qui va être à l’origine du phénomène de RMN.
Mise en résonance de l’aimantation par une excitation radiofréquence
En physique, la résonance désigne un phénomène physique qui permet de transférer de l’énergie à un système par un phénomène oscillatoire. Le transfert d’énergie n’est possible que s’il s’effectue à une fréquence propre au système dite fréquence de résonance. Si on soumet un système résonant à une excitation ponctuelle (impulsion), alors le système sera le siège d’oscillations amorties, sur une fréquence proche de sa fréquence propre, et retournera progressivement à son état stable. Ce phénomène existe dans de très nombreux domaines de la physique : en acoustique, en électricité ou en mécanique.
C’est ce principe de résonance qu’on utilise pour mettre en mouvement l’aimantation macroscopique M0. Pour transférer de l’énergie à une aimantation placée dans un champ magnétique B0, il faut lui appliquer une onde électromagnétique dont la fréquence f0 est donnée par la relation de Larmor : f0 = γ/(2π). La fréquence propre de l’aimantation f0 est appelée fréquence de Larmor. La constante γ est appelée rapport gyromagnétique. C’est une constante caractéristique de chaque noyau possédant une aimantation. Pour le noyau d’hydrogène, γ/(2π) = 42,57 mégahertz par tesla (MHz/T). Pour les champs magnétiques utilisés en IRM, l’ordre de grandeur de f0 est 100 MHz, ce qui correspond aux fréquences de la bande FM, d’où l’appellation « ondes radiofréquence » (RF). L’émetteur utilisé en IRM fonctionne selon les mêmes principes qu’un émetteur radio. Il s’agit d’une antenne d’émission de forme généralement cylindrique qui est intégrée dans le tunnel de l’IRM.
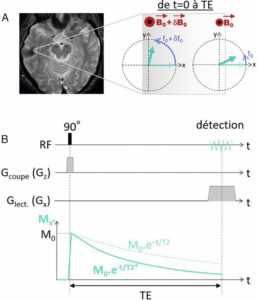
L’énergie transférée par l’onde RF se traduit par le basculement de l’aimantation qui s’écarte de sa position d’équilibre le long de B0 (figure 8.4A). Cela correspond à l’excitation radiofréquence. Pour décrire l’évolution temporelle de l’aimantation, on se place dans un repère (O,x,y,z) centré sur l’aimantation, dont la direction z est celle du champ magnétique B0 (direction du tunnel de l’IRM), qui est également la direction de l’aimantation à l’équilibre M0. On désigne z comme la direction longitudinale et le plan (x, y) comme le plan transverse. Le vecteur aimantation M peut se décomposer en une composante longitudinale (dont la projection sur z vaut Mz) et une composante transversale de norme Mxy (figure 8.4B). Ainsi, lorsque l’aimantation est à l’équilibre avec B0, à distance de toute excitation RF, on a : Mz = M0 et Mxy = 0. Juste après une excitation basculant l’aimantation de 90°, on a : Mz = 0 et Mxy = M0.
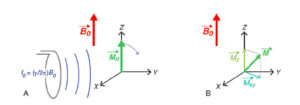
Excitation radiofréquence.
L’application d’une onde électromagnétique à la fréquence de Larmor f0 bascule l’aimantation vers le plan transverse (A) ; l’aimantation écartée de sa position d’équilibre peut être décrite par ses composantes transversale Mxy et longitudinale Mz (B).
L’excitation RF peut être caractérisée par l’angle dont l’aimantation bascule, qui est proportionnel à la durée d’application de l’onde RF et à l’intensité de cette onde. L’angle de bascule peut donc être choisi librement en jouant sur ces deux paramètres. En IRM, on utilise des émissions très courtes, de l’ordre de la milliseconde : on parle d’impulsions radiofréquences.
Sous l’influence d’une onde radio à une fréquence caractéristique (fréquence de Larmor), l’aimantation des noyaux d’hydrogène pivote et se retrouve perpendiculaire à B0. Initialement portée par l’axe longitudinal (parallèle à B0), l’aimantation se retrouve donc dans le plan transversal (perpendiculaire à B0)
Retour à l’équilibre de l’aimantation
Suite à l’impulsion RF, l’aimantation retourne à sa position d’équilibre le long de z, de la même manière que l’aiguille d’une boussole s’aligne sur le champ magnétique terrestre. Toutefois, le retour à l’équilibre de l’aimantation ne s’effectue pas selon une rotation vers l’axe z, mais selon une dynamique complexe combinant trois processus :
- la rotation de M autour de la direction de B0 (axe z) à la fréquence de Larmor f0 (figure 8.5A). Ce mouvement de rotation est désigné par le terme de précession libre, parce qu’il s’effectue en l’absence de toute excitation RF. Il faut noter que la précession s’effectue à une vitesse remarquablement élevée : dans un champ magnétique de 1,5 tesla, f0 vaut 63,9 MHz, ce qui signifie que M effectue 63 900 000 tours en une seconde. Ce mouvement de rotation correspond au signal d’IRM ;
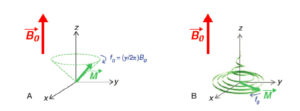
Retour à l’équilibre.
Après l’excitation RF, l’aimantation retourne à sa position d’équilibre selon un mouvement combinant une précession autour de l’axe z à la fréquence f0 (A), une décroissance exponentielle en T2 de la composante transversale Mxy et une récupération exponentielle en T1 de la composante longitudinale Mz ; la trajectoire parcourue par l’extrémité du vecteur M dessine une forme de « chapeau pointu » (B).
- la disparition de la composante transversale Mxy qu’on appelle la relaxation transversale : dès la fin de l’excitation RF, l’intensité de l’aimantation transversale décroît selon un processus exponentiel caractérisé par la constante de temps T2, décrit par l’équation : dMxy/dt = –1/T2 Mxy(t). Pour une impulsion RF de 90°, cette équation admet pour solution : Mxy(t) = M0 exp(–t/T2). La constante T2 est le temps de relaxation transversale. Il caractérise la persistance transversale de l’aimantation. Dans les tissus mous, le T2 de l’eau est de l’ordre de 0,1 seconde. Cette relaxation transversale correspond à l’épuisement du signal IRM ;
- la récupération de la composante longitudinale qu’on appelle la relaxation longitudinale : dès la fin de l’excitation RF, l’intensité de l’aimantation longitudinale croît selon un processus exponentiel caractérisé par la constante de temps T1, décrit par l’équation : dMz/dt = 1/T1 [M0–Mz(t)]. Pour une impulsion RF de 90°, cette équation admet pour solution : Mz(t) = M0.[1-exp(–t/T1)]. La constante T1 est le temps de relaxation longitudinale. Il caractérise la vitesse à laquelle l’aimantation retourne à sa valeur d’équilibre M0. Dans les tissus mous, T1 est de l’ordre de 1 seconde (aux valeurs de B0 utilisées pour l’IRM). Cette relaxation longitudinale correspond à la régénération de la réserve de signal.
Lors de la relaxation, les composantes transversale et longitudinale évoluent donc chacune selon leur propre dynamique, indépendamment l’une de l’autre. Cela traduit le fait que la relaxation n’est pas une rotation de M depuis le plan transversal vers l’axe z : ce n’est pas une « excitation à l’envers ». Ainsi, le module de M n’est pas conservé lors du retour à l’équilibre : le T2 de l’eau étant sensiblement plus court que le T1 dans les tissus biologiques, Mxy disparaît avant que Mz retrouve sa valeur d’équilibre M0. Ce phénomène est illustré sur la figure 8.5B où la trajectoire de l’extrémité du vecteur aimantation est tracée. La trajectoire représentée tient compte des trois processus participant au retour à l’équilibre de l’aimantation : la précession libre, la relaxation transversale et la relaxation longitudinale. L’enveloppe de cette trajectoire présente la forme d’un « chapeau pointu ». Plus le T2 est court par rapport au T1, plus les bords du chapeau apparaîtront plats et la pointe étroite. Le fait que T1 et T2 soient deux constantes indépendantes a une conséquence majeure en IRM : les images pondérées en T1 et en T2 ne sont pas redondantes et apportent des informations complémentaires sur les tissus biologiques.
La figure 8.6 représente l’évolution temporelle des projections de M sur z (composante longitudinale) et sur x (composante transversale) après une excitation de 90°. La composante longitudinale Mz évolue selon une exponentielle croissante en T1. Mz est insensible au mouvement de précession puisqu’il s’effectue autour de z. Ce n’est évidemment pas le cas de Mx qui est la projection du vecteur tournant Mxy. À la relaxation transversale en T2 s’ajoute donc une oscillation de Mx à la fréquence f0. Pour simplifier la représentation de la composante transversale, on la représente couramment dans un repère (O,x′,y′,z) tournant autour de z à f0, qu’on appelle repère de Larmor. Dans ce repère, Mx′ évolue selon une simple exponentielle décroissante en T2.
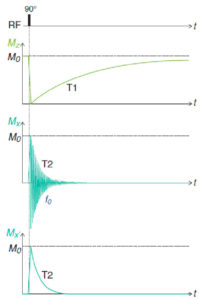
Évolution temporelle des projections de M sur z (composante longitudinale) et sur x (composante transversale) pendant et après une excitation RF de 90°.
Mx′ est la projection sur l’axe x′ du repère de Larmor qui tourne autour de z à la fréquence f0.
Nous verrons que, pour acquérir une image par résonance magnétique, il faut répéter un grand nombre d’excitations RF relativement rapidement. Le délai entre deux excitations RF successives est appelé temps de répétition (TR). La question se pose donc de savoir comment l’aimantation évolue lorsqu’on applique une seconde impulsion RF après un délai TR :
- court par rapport à T1, si bien que Mz est encore éloignée de sa valeur d’équilibre M0 après TR ;
- long par rapport à T2, si bien que Mx′ peut être considérée comme nulle après TR.
La figure 8.7A illustre le retour à l’équilibre de M dans cette configuration. Juste avant cette 2e impulsion :
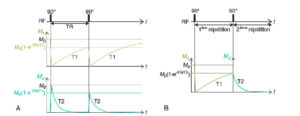
Évolution temporelle des composantes Mz et Mx′ lorsqu’une 2e excitation de 90° est appliquée après un délai TR.
Juste après la 2e excitation, Mx′ décroît selon une exponentielle en T2 à partir de la valeur M0(1-e(-TR/T1)) (A) ; la relaxation transversale d’une répétition dépend donc de la relaxation longitudinale de la répétition précédente (B).
Mz = M0.[1–exp(–TR/T1)] et Mx′ = 0 ; l’aimantation est alignée sur z. La 2e impulsion de 90° la bascule vers le plan transverse (x′,y′). Juste après la 2e impulsion :Mz = 0 et Mx’ = M0.[1–exp(–TR/T1)]. Mz relaxe ensuite en T1 : Mz(t) = M0.[1–exp(–t/T1)]. Mx′ relaxe en T2, mais à partir de la valeur initiale M0.[1–exp(–TR/T1)], ce qui donne : Mx′(t) = M0.[1–exp(–TR/T1)].exp(–t/T2). Ainsi, la composante transversale décroît exponentiellement en T2, mais son intensité dépend de T1.
La figure 8.7B représente Mz(t) pendant la 1re répétition et Mx′(t) pendant la 2e répétition. Cette représentation illustre plus directement le fait que la relaxation transversale d’une répétition dépend de la relaxation longitudinale de la répétition précédente.
Après l’excitation RF, l’aimantation retourne à son état d’équilibre avec un mouvement complexe : précession (rotation) autour de B0 qui est source du signal d’IRM et relaxation (disparition de la composante transversale et régénération de la composante longitudinale).
Détection de l’aimantation lors de son retour à l’équilibre
Lorsqu’une aimantation se déplace à proximité d’un circuit électrique en boucle, les lignes de champ qui traversent le circuit varient dans le temps : il y a variation du flux magnétique à travers le circuit. La loi de Faraday énonce que toute variation du flux magnétique traversant un circuit électrique induit une tension – aussi appelée force électromotrice – aux bornes du circuit. Ce phénomène d’induction électromagnétique est exploité dans de très nombreuses applications industrielles (production d’électricité, moteurs électriques, plaques à induction, recharge de téléphones sans fil, etc.).
En IRM, on place la boucle de circuit électrique à proximité du sujet pour détecter la tension induite par la précession de l’aimantation pendant son retour à l’équilibre (figure 8.8). En théorie, ce circuit peut être le même que celui utilisé pour l’excitation RF. En pratique, on utilise des circuits de plus petite taille placés près de la région anatomique à examiner, ce qui maximise le flux magnétique à travers le circuit et augmente la sensibilité de détection. On parle pour ces circuits d’antennes de réception (antenne tête, antenne rachis, antenne genou, etc.).
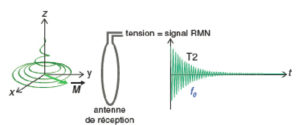
Le signal détecté en RMN est la tension induite aux bornes de l’antenne de réception par la précession de l’aimantation.
Signal RMN
Le signal détecté en RMN est la tension générée aux bornes de l’antenne de réception par la précession de l’aimantation. La loi de Faraday énonce que cette tension est proportionnelle à la vitesse à laquelle l’aimantation change. Comme illustré sur la figure 8.6, Mz et Mxy présentent des dynamiques temporelles très différentes lors du retour à l’équilibre : Mz passe de 0 à M0 en quelques secondes tandis que Mx passe de + M0 à –M0 plusieurs dizaines de millions de fois par seconde (63 millions de fois à 1,5 tesla). C’est donc la composante transversale Mxy qui génère le signal détecté. Ce signal est proportionnel à Mxy.
Après une impulsion de 90°, le signal détecté s’exprime donc sous la forme S(t) = S0·exp(–t/T2). Le terme S0 est proportionnel à M0 et dépend de nombreux facteurs instrumentaux (géométrie de l’antenne de réception, chaîne électronique de détection, etc.). Après une 2e impulsion de 90° appliquée au temps TR, on a :S(t) = S0·[1–exp(–TR/T1)]·exp(–t/T2).
Principes de localisation du signal en IRM
À ce stade, nous avons vu comment détecter les aimantations de l’eau et de la graisse des tissus biologiques : nous sommes capables de déterminer s’il existe de l’eau et de la graisse chez un sujet placé dans une IRM. Reste à localiser ces molécules au sein du corps humain, c’est-à-dire à obtenir une image par résonance magnétique.
Il est admis que la précision de localisation d’une onde électromagnétique est donnée par sa longueur d’onde. Cela explique que les rayonnements utilisés en imagerie médicale peuvent généralement être localisés avec une grande précision, comme les rayons X ou γ qu’on peut facilement focaliser ou collimater, alors que la résolution de la microscopie optique est limitée à une fraction de micromètre. Cependant, la longueur d’onde des impulsions RF utilisées en RMN est de l’ordre du mètre. On ne peut donc pas focaliser l’onde RF émise par l’antenne d’émission sur un point précis du corps humain : cette onde excite l’ensemble du volume de l’antenne d’émission. De même, le signal détecté par l’antenne de réception provient de l’ensemble du volume vu par l’antenne.
Le principe de localisation utilisé en IRM repose sur l’équivalence entre la fréquence de Larmor f0 et la position spatiale des aimantations. Dans le champ B0 de l’IRM, les aimantations ont toutes la même fréquence de Larmor. Pour introduire une dépendance entre la position spatiale et f0, il suffit de faire varier le champ B0 dans l’espace au moyen de gradients de champ magnétique.
Pour se repérer dans l’espace en IRM, on utilise un gradient de champ magnétique qui établit une relation linéaire entre espace et champ magnétique. Comme la fréquence de résonance est elle-même proportionnelle au champ magnétique, cela induit une relation linéaire entre fréquence de résonance et coordonnée d’espace. On repérera donc la position d’un objet par sa fréquence de résonance.
Notion de gradient de champ magnétique
Par définition, un gradient de champ magnétique G est une variation linéaire du champ selon une direction de l’espace. Par exemple, un gradient Gz appliqué selon z génère un champ magnétique Gz·z. Il en va de même pour x et y, comme illustré à la figure 8.9. En pratique, les gradients sont générés par des bobines enroulées dans le tunnel de l’IRM, dans lesquelles on fait circuler du courant pour établir le gradient.
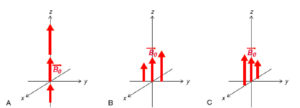
Gradients de champ magnétique selon z (A), y (B) et x (C).
Principe de la sélection de coupe
La sélection de coupe consiste à exciter les aimantations d’un plan de coupe particulier du sujet placé dans l’IRM. Pour ce faire, il faut que l’onde RF d’excitation, qui se propage dans tout le sujet, ne bascule les aimantations que d’un plan de coupe. Dans le cas d’une coupe orthogonale à z (figure 8.10), cela est obtenu en appliquant un gradient Gz simultanément à l’excitation RF. En présence du gradient, le champ magnétique s’écrit : B0(z) = B0 + Gz · z. La fréquence de Larmor dépend ainsi de la position selon z : f0(z) = f0(0) + γ / (2π) · Gz · z . L’émission d’une onde à une fréquence donnée n’affectera que les aimantations résonant à cette fréquence : une onde de fréquence f0 basculera les aimantations situées à z = 0 (figure 8.10A), tandis qu’une onde de de fréquence f0(z1) = f0(0) + γ / (2π) · Gz · z1 basculera les aimantations situées à z = z1 (figure 8.10B).
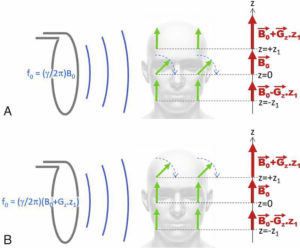
Principe de la sélection de coupe en IRM.
L’application simultanée d’un gradient de champ Gz et d’une excitation RF permet d’exciter sélectivement un plan situé à z = 0 (A) ou z = z1 (B) selon la fréquence d’excitation utilisée.
La sélection de coupe consiste donc à appliquer un gradient de champ magnétique simultanément à l’émission RF pour exciter une coupe orthogonale à la direction du gradient. Le gradient appliqué est appelé gradient de sélection de coupe.
Lors de l’émission RF, l’application d’un gradient « de sélection » permet de sélectionner une coupe du corps qui sera la seule à émettre du signal.
Principe du codage par la fréquence
Après sélection de la coupe d’intérêt, il reste à déterminer la position des aimantations dans le plan de coupe pour obtenir une image. Une fois le gradient Gz et l’excitation RF éteintes, les aimantations du plan de coupe se retrouvent basculées dans le plan (x,y). Elles entament leur retour à l’équilibre selon la précession amortie décrite précédemment. L’application d’un gradient Gx pendant la précession permet de déterminer la position des aimantations selon x. Cette technique de localisation est appelée codage par la fréquence. Pour en expliquer le principe, prenons l’exemple d’un sujet dont la tête est globalement vide mais contient de l’eau au voisinage de l’oreille droite (à l’abscisse x1) et de l’oreille gauche (à l’abscisse x2). Dans cet exemple, on considère qu’il y a davantage d’eau en x1 qu’en x2 et on se place juste après l’excitation RF de 90° (figure 8.11B). On souhaite déterminer la distribution des aimantations M selon x (figure 8.11C). Pour ce faire, on applique un gradient Gx pendant la précession. En présence du gradient Gx, le champ magnétique s’écrit : B0(x) = B0 + Gx · x (figure 8.11A). La fréquence de Larmor dépend ainsi de la position x : F0(x) = f0(0) + γ / (2π) · Gx · x. Cela est mieux visualisé dans le plan transverse (figure 8.11D, E) : l’aimantation située en x2 précesse à une fréquence supérieure à celle de l’aimantation située en x1. Le signal S détecté en présence de Gx est la somme du signal basse fréquence généré par l’aimantation située en x1 et du signal haute fréquence généré par l’aimantation située en x2. On notera que le signal issu de x1 est plus intense que celui issu de x2 car il y a davantage d’eau en x1 qu’en x2. Après enregistrement du signal global, on lui applique une transformation de Fourier (TF). Cette opération mathématique permet de passer du domaine temporel au domaine fréquentiel. La TF représente les composantes fréquentielles du signal (figure 8.11F) : un signal intense à la fréquence f0(x1) et un signal moins intense à la fréquence f0(x2). On constate que la TF du signal représentée à la figure 8.11F est parfaitement superposable à la distribution des aimantations selon x (figure 8.11C) : la TF du signal détecté en présence du gradient Gx fournit la distribution des aimantations le long de x.
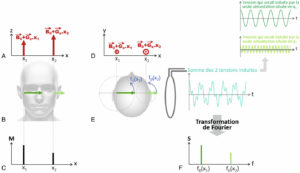
Principe du codage par la fréquence en IRM.
L’application d’un gradient Gx pendant le retour à l’équilibre de l’aimantation crée une équivalence entre la position x et la fréquence de précession f0 (A–E) ; la transformée de Fourier du signal enregistré en présence de Gx fournit la distribution fréquentielle des aimantations (F) qui correspond à leur distribution spatiale selon x (C).
Le codage par la fréquence consiste donc à appliquer un gradient simultanément à l’enregistrement du signal de précession pour localiser l’aimantation le long de la direction du gradient. Le gradient appliqué est appelé gradient de codage par la fréquence ou gradient de lecture.
Le codage par la fréquence fournit ainsi la projection des aimantations selon une direction du plan de coupe. Si on remplace Gx par un gradient Gy, on obtient la projection des aimantations selon y. En combinant les gradients Gx et Gy, on peut obtenir la projection des aimantations selon toute direction du plan (x,y). À partir de ces projections, il est possible de reconstruire l’image de la coupe par les méthodes de reconstruction tomographique classiques de type rétroprojection comme en TDM ou en tomoscintigraphie (voir chapitre 9). En pratique, on n’utilise plus que rarement cette approche en IRM mais un codage « par la phase ». Les principes sous-jacents au codage par la phase dépassent le cadre du DFGSM et ne seront pas détaillés ici, ce qui ne nuit en rien à la compréhension de l’IRM et de son utilisation pour la médecine (les images sont reconstruites par transformée de Fourier bidimensionnelle après double codage du plan de coupe par la fréquence et par la phase).
Pendant l’enregistrement du signal IRM, l’utilisation d’un gradient « de lecture » dans une autre direction permet de localiser le signal selon cette seconde direction. Différentes stratégies sont ensuite utilisables pour localiser le signal selon la troisième direction qui débordent le cadre de cet ouvrage.
Les principales séquences d’IRM
Une séquence d’IRM est une description chronologique des manipulations appliquées à l’aimantation (émission radiofréquence et gradients) et de la détection de l’aimantation (mesure du signal RMN).
Séquence d’écho de gradient
La figure 8.12 représente la séquence élémentaire de l’IRM – équivalente à la séquence d’écho de gradient – qui comprend la sélection de coupe et le codage par la fréquence. Le délai séparant l’excitation RF de la détection est appelé temps d’écho (TE). Cette séquence est couramment utilisée en IRM, mais présente un défaut majeur : les images qu’elle fournit peuvent être artefactées dans les régions où le champ B0 n’est pas parfaitement homogène.
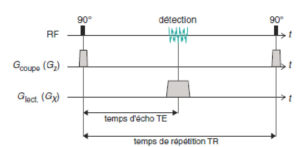
Séquence d’IRM décrivant la chronologie de l’excitation sélective et le codage par la fréquence ; cette séquence comprend les éléments de base de la séquence d’écho de gradient.
Artefacts liés aux inhomogénéités de B0
Inhomogénéités de B0
En l’absence de patient dans l’IRM, le champ magnétique B0 est homogène, c’est-à-dire que l’ensemble du volume d’air situé dans l’IRM est soumis à la même valeur de B0 (1,5 T ou 3 T sur les IRM cliniques). Dès qu’on place un patient dans l’IRM, ce n’est plus vrai : le champ magnétique à l’intérieur des tissus biologiques n’est pas le même que celui dans l’air, car les tissus et l’air possèdent des susceptibilités magnétiques χ différentes. À noter que le champ varie également d’un tissu biologique à l’autre, mais ces variations peuvent être considérées comme négligeables par rapport à la différence avec l’air. Dès lors, dans les zones de transition entre l’air et les tissus, le champ n’est pas homogène. La figure 8.13 illustre ce phénomène pour une tête humaine placée dans une IRM à 3 T : le champ B0 est inhomogène au voisinage des cavités aériques de la tête (sinus de la face, fosses nasales, rochers).
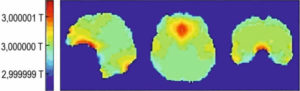
Inhomogénéités du champ magnétique B0 dans un cerveau humain chez un sujet placé dans une IRM à 3 T.
Au voisinage des cavités aériques de la tête, B0 s’éloigne de la valeur de 3 T ; même très faibles, ces inhomogénéités peuvent causer des artefacts importants sur les images.
Source : N. Boulant, CEA/NeuroSpin.
Effet des inhomogénéités sur le signal d’écho de gradient
Pour décrire l’effet des inhomogénéités de B0 sur les images acquises par écho de gradient, il faut considérer un voxel situé au voisinage d’une cavité aérique, par exemple au-dessus des rochers (figure 8.14). Au sein du voxel, le champ magnétique est inhomogène. La figure 8.14A représente deux aimantations de ce voxel : l’une est soumise au champ B0 + δB0 et l’autre au champ B0. Après l’excitation RF, les deux aimantations précessent à des fréquences différentes (la relation de Larmor permet aisément de calculer leur écart fréquentiel δf0 = [γ/(2π)].δB0). Les aimantations se déphasent donc entre elles pendant le TE. L’aimantation Mx′y′ mesurée dans le voxel étant la somme vectorielle de toutes les aimantations, son intensité est d’autant plus atténuée que les aimantations sont déphasées. L’effet de ce déphasage s’ajoute à la relaxation en T2 – à l’origine de la diminution d’intensité des aimantations transversales pendant le TE (figure 8.14A) – si bien que l’intensité de Mx′y′ décroît plus rapidement dans un voxel à B0 inhomogène que dans un voxel à B0 homogène (figure 8.14B). La décroissance accélérée par l’inhomogénéité de B0 est caractérisée par la constante de temps T2* (« T2 étoile »). Le T2* reflète à la fois le T2 et l’inhomogénéité au sein du voxel : le T2* est toujours inférieur au T2.
Évolution temporelle de l’aimantation transversale dans un voxel où B0 est inhomogène.
Les aimantations de ce voxel sont soumises à des champ magnétiques de valeurs différentes et précessent donc à des fréquences différentes (A) ; l’aimantation détectée à l’échelle du voxel étant la somme vectorielle de toutes les aimantations, elle est d’autant plus atténuée que les aimantations sont déphasées ; l’effet des déphasages s’ajoute à la relaxation en T2 et accélère la disparition de la composante transversale Mx′ qui décroît en T2* (B).
Comme l’illustre l’IRM cérébrale de la figure 8.14A, les inhomogénéités de B0 entraînent des hyposignaux au voisinage des cavités aériques sur les images d’écho de gradient. Dans certains cas, cela peut être mis à profit pour détecter des lésions qui génèrent des inhomogénéités locales de B0. C’est le cas des hémorragies ou des calcifications, car l’hémoglobine désoxygénée et le calcium perturbent B0 à leur voisinage. On utilisera donc des séquences d’écho de gradient à TE relativement long pour détecter les lésions hémorragiques ou calcifiées. En dehors de ces cas particuliers, on privilégiera une autre séquence qui corrige les déphasages liés aux inhomogénéités de champ : la séquence d’écho de spin.
Séquence d’écho de spin
Principe
L’écho de spin (ES) consiste à insérer au milieu de la séquence IRM une impulsion RF de 180°. La figure 8.15 illustre la manière dont cette impulsion corrige les déphasages liés aux inhomogénéités de champ. Pendant la 1re moitié de la séquence (t = 0 à TE/2), les deux aimantations du voxel se déphasent comme dans la séquence d’écho de gradient. À t = TE/2, on applique une impulsion RF de 180° autour de l’axe x.
Comme illustré figure 8.15A, cette impulsion inverse le déphasage accumulé pendant la 1re moitié de la séquence : elle transforme les avances de phase en retards de phase. L’aimantation qui précesse le plus vite (celle soumise à B0 + δB0) se retrouve donc en retard de phase par rapport à celle qui précesse le plus lentement (celle soumise à B0). Il suffit de laisser les aimantations évoluer librement pendant la durée TE/2 pour qu’elles compensent leur retard de phase et se retrouvent alignées le long de x. Au moment de la détection (à t = TE), les aimantations sont donc parfaitement rephasées : l’effet des inhomogénéités de B0 est annulé. Le signal du voxel détecté n’est affecté que par la décroissance en T2 qui a diminué l’intensité des aimantations pendant le TE.
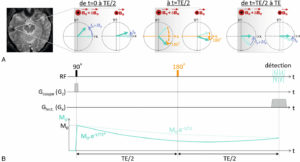
Principe de l’écho de spin.
Pendant la 1re moitié de la séquence, les aimantations du voxel se déphasent sous l’effet de l’inhomogénéité de B0 (A) ; à t = TE/2, on applique une impulsion RF de 180° qui inverse la phase des aimantations. Pendant la 2e moitié de la séquence, les aimantations du voxel se rephasent ; l’aimantation globale du voxel décroît en T2* pendant la 1re moitié de la séquence (B), puis retrouve une valeur correspondant à la décroissance en T2 au moment de la détection.
La figure 8.16 illustre l’intérêt de l’écho de spin (B) par rapport à l’écho de gradient (A) : les hyposignaux artéfactuels à proximité de la mastoïde et de l’ethmoïde de l’écho de gradient sont corrigés sur l’écho de spin.
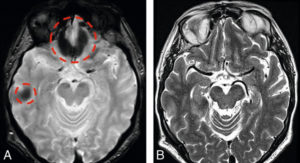
IRM acquises par écho de gradient (A) et par écho de spin (B) chez le même sujet dans le même plan de coupe.
Les hyposignaux artefactuels de l’écho de gradient (cercles rouges) disparaissent en écho de spin.
Influence du TR et du TE et notion de séquences pondérées en T1 et T2
En jouant sur les valeurs des paramètres TE et TR de la séquence d’écho de spin, on peut contrôler l’influence des temps de relaxation T1 et T2 sur le signal de l’image, c’est-à-dire pondérer l’image en T1 ou en T2. On parle indifféremment de pondération ou de contraste en IRM. Pour comprendre comment le contraste est généré, il faut savoir que l’acquisition d’une image par IRM nécessite en général un grand nombre de répétitions. On peut représenter de nouveau (voir figure 8.7B) la récupération de l’aimantation longitudinale lors d’une 1re répétition (qui conditionne le contraste T1) et la décroissance de l’aimantation transversale lors de la répétition suivante (qui conditionne le contraste T2 – figure 8.17). À partir de la 2e répétition, le signal détecté par une séquence d’écho de spin s’écrit S = S0·[1–exp(–TR/T1)]·exp(–TE/T2).
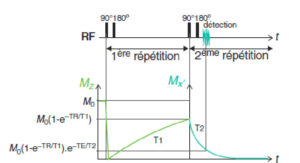
Effet du TR et du TE sur la pondération en T1 et en T2.
On retiendra que, dans une séquence en ES, il faut donc répéter la séquence élémentaire impulsion RF de 90° puis de 180° pour créer un signal dans le plan transversal et le mesurer. Le TR et le TE vont déterminer le contraste de l’image.
Concernant le TR :
- il correspond à l’intervalle séparant deux répétitions (deux impulsions de 90°) ;
- l’aimantation longitudinale récupère pendant ce temps en fonction des caractéristiques de T1 des tissus ;
- le TR conditionne donc le contraste en T1 ;
- si le TR est suffisamment long, tous les tissus peuvent avoir le temps de récupérer leur aimantation longitudinale, même si certains récupèrent plus vite que d’autres, et les tissus seront donc mal séparés.
Donc, plus on allonge le TR, et plus on diminue la pondération (le contraste) en T1 (figure 8.18A) ;
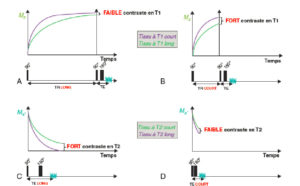
Influence du TR et du TE sur la pondération T1 et T2.
A. Si le TR est long, bien que certains tissus aient des vitesses de relaxation longitudinale (T1) plus rapides que d’autres, tous les tissus auront récupéré et le contraste T1 sera faible. B. Si le TR est court, les tissus ayant des vitesses de relaxation longitudinale (T1) différentes seront bien séparés et le contraste T1 sera important. C. Si le TE est long, les tissus ayant des vitesses de décroissance de l’aimantation transversale (T2) différentes auront le temps d’être bien séparés et le contraste T2 sera important. D. Si le TE est court, bien que certains tissus aient des vitesses de décroissance de l’aimantation transversale (T2) plus rapides que d’autres, ces différences n’auront pas le temps de s’exprimer et le contraste T2 sera faible.
- à l’inverse, pour un TR court, on pourra séparer les tissus ayant une récupération plus rapide (un T1 plus court) qui seront plus intenses que ceux ayant une récupération plus lente. Donc, plus on raccourcit le TR, plus la pondération (le contraste) en T1 est forte (figure 8.18B).
Concernant le TE :
- il correspond à l’intervalle entre la bascule dans le plan transversal et la mesure du signal au moment de l’écho (l’impulsion de 180° est appliqué au temps t = TE/2) ;
- l’aimantation transversale décroît pendant ce temps en fonction des caractéristiques de T2 des tissus ;
- le TE conditionne donc le contraste en T2 ;
- plus le TE est long, plus les différences de vitesse de décroissance de l’aimantation transversale apparaîtront sous la forme de différence de signal. Donc, plus on allonge le TE, plus on augmente la pondération (le contraste) en T2 (figure 8.18C) ;
- à l’inverse, si le TE est trop court, les différences de vitesse de décroissance n’auront pas le temps de s’exprimer et les tissus seront donc mal séparés. Donc, plus on raccourcit le TE, plus on diminue la pondération (le contraste) en T2 (figure 8.18D).
Ainsi, dans une séquence pondérée en T1 :
- le TR est court pour maximiser le contraste en T1 (différences liées à la relaxation longitudinale) ;
- le TE est court pour minimiser le contraste en T2 (différences liées à la décroissance transversale) ;
- les tissus avec les T1 les plus courts donneront plus de signal.
Dans une séquence pondérée en T2 :
- le TR est long pour minimiser le contraste en T1 ;
- le TE est long pour maximiser le contraste en T2 ;
- les tissus avec les T2 les plus courts donneront le moins de signal.
Pour illustrer ces notions, on peut prendre l’exemple du contraste au sein du système nerveux central. Les propriétés des tissus cérébraux sont telles que la récupération de l’aimantation longitudinale est plus rapide au sein de la substance blanche (SB) qu’au sein de la substance grise (SG), qui est elle-même plus rapide qu’au sein du liquide cérébrospinal (LCS). Autrement dit, T1SB < T1SG < T1LCS (en pratique, au bout d’un temps T1, 1 – 1/e = 63% de la récupération longitudinale a été récupérée). Un tissu dont l’aimantation longitudinale récupère vite a généralement une aimantation transversale qui décroît vite. Ainsi, la décroissance de l’aimantation transversale est plus rapide au sein de la SB qu’au sein de la SG, qui est elle-même plus rapide qu’au sein du LCS. Autrement dit, T2SB < T2SG < T2LCS (en pratique, au bout d’un temps T2, l’aimantation transversale a décru à 1/e, soit 37 % de sa valeur initiale).
Ainsi, en séquence pondérée T1 (TR court et TE court ; figure 8.19A), le contraste est dit anatomique :
- la SB est blanche, la SG est grise, le LCS est noir (hypo-intense).
En séquence pondérée T2 (TR long, TE long ; figure 8.19B), le contraste est inversé :
- la SB est la plus noire, la SG a un signal intermédiaire, le LCS est blanc (hyperintense).
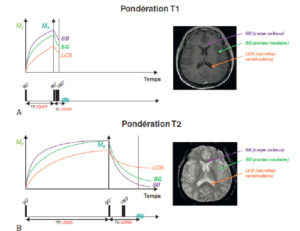
Influence des séquences pondérées T1 et T2 sur le contraste au sein du système nerveux central.
A. En séquence T1 (TR court pour pondérer T1 et TE court pour limiter la pondération T2), le contraste est anatomique : la substance blanche est blanche, la substance grise est grise et le LCS est hypo-intense. B. En séquence T2 (TR long pour limiter la pondération T1 et TE long pour pondérer T2), le contraste est inversé : la substance blanche est plus hypo-intense que la substance grise et le LCS est hyperintense.
La majorité des phénomènes pathologiques s’accompagnent d’une augmentation du contenu en eau, ce qui augmente les temps de relaxation T1 et T2 et ce qui apparaît donc en hyposignal sur les séquences pondérées T1 et en hypersignal sur les séquences pondérées T2 (figure 8.20A). Certaines modifications pathologiques impactent différemment les temps de relaxation. Par exemple, un saignement au bout de quelques jours (stade de méthémoglobine) va raccourcir le T1 et le T2, ce qui apparaît donc en hypersignal sur les séquences pondérées T1 et en hyposignal sur les séquences pondérées T2 (figure 8.20B). L’hyposignal sera encore plus marqué sur les séquences T2*, dans lesquelles on ne corrige pas les inhomogénéités de B0 comme expliqué précédemment.
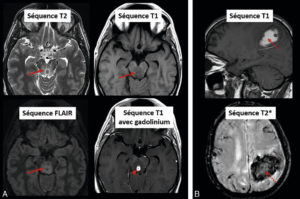
Exemples de modifications du signal induites par des conditions pathologiques au sein de l’encéphale.
A. Abcès mésencéphalique. L’abcès, visualisé après injection de gadolinium (tête de flèche), est entouré d’œdème apparaissant en hypersignal T2 et FLAIR et en hyposignal T1 (flèches) car cette augmentation du contenu en eau allonge les temps de relaxation T1 (relaxation plus lente, d’où hyposignal) et T2 (décroissance plus lente, d’où hypersignal). B. Hématome subaigu. La présence de sang au stade de méthémoglobine (flèche pointillée) raccourcit les temps de relaxation T1 (récupération plus rapide, d’où hypersignal) et T2 (décroissance plus rapide, d’où hyposignal).
Module d’inversion récupération (FLAIR et STIR)
Avant d’acquérir l’image avec une séquence d’écho de spin ou d’écho de gradient, il est possible de « préparer » l’aimantation pour modifier le contraste. Parmi les techniques utilisées pour une telle préparation, on compte notamment l’« inversion-récupération ». En faisant précéder l’impulsion initiale de 90° d’une impulsion de 180°, on obtient une séquence de type inversion-récupération. L’impulsion de 180° va inverser l’aimantation longitudinale qui passe alors de +Mz0 à –Mz0. Initialement, cette inversion ne s’accompagne pas d’aimantation transversale (Mxy = 0). À l’arrêt de l’impulsion de 180°, il s’ensuit une récupération (d’où le nom inversion-récupération) de l’aimantation longitudinale par retour dans le sens du champ magnétique principal de façon plus ou moins rapide en fonction du T1 des tissus. Au bout d’un temps appelé temps d’inversion ou TI (équivalent du TR dans une séquence ES classique), on bascule dans le plan transverse (impulsion de 90°) pour faire la mesure en écho de spin ou en écho de gradient.
Les séquences d’inversion-récupération offrent plusieurs avantages. Tout d’abord, le contraste T1 peut être amélioré par rapport à une séquence ES standard, car la relaxation longitudinale qui a lieu pendant le TI se fait sur une « une plus grande distance » (de –Mz0 à +Mz0), ce qui majore la possibilité de séparer des tissus ayant des T1 différents par rapport à une récupération qui va de 0 à +Mz0 dans une séquence ES classique. Il est donc possible d’utiliser ce schéma (en ajustant le TI et le TE) pour obtenir des images très anatomiques avec un très fort contraste T1. Pour l’exploration du cerveau, on utilise notamment ces séquences T1–IR (T1 inversion récupération) pour explorer de façon fine le ruban cortical dans un bilan d’épilepsie.
Par ailleurs, dans une séquence en inversion récupération, le signal de tous les tissus passe par 0 lors de la récupération de l’aimantation longitudinale (pour TI = T1 × ln2 ≅ 0,69 T1 du tissu considéré). Donc, si le TI est centré sur le moment où le signal d’un tissu croise le 0 lors de la récupération, alors le signal de ce tissu sera annulé.
L’eau des compartiments liquides (comme le LCS) a une aimantation longitudinale qui relaxe lentement (T1 long ; voir signal du LCS dans la figure 8.19). En utilisant un TI long (= 0,69 × T1eau ≈ 2500 ms à 1,5 T), on peut annuler le signal du LCS. Il s’agit de la séquence FLAIR (fluid-attenuated inversion recovery). Avec un TE suffisamment long, on exprime un contraste T2 dans le FLAIR au sein duquel le contraste entre la SB et la SG est donc identique à celui d’un T2, mais avec le LCS noir au lieu d’être hyperintense. Les lésions cérébrales (qui s’accompagnent très souvent d’un allongement du T2 par excès d’eau ; voir plus haut « Influence du TR et du TE et notion de séquences pondérées en T1 et T2 ») restent hyperintenses en séquence FLAIR comme sur un T2 standard (car les lésions ne correspondent pas à de l’eau libre – figure 8.20A), mais l’annulation du LCS facilite leur délimitation, par exemple pour les lésions inflammatoires de sclérose en plaques de topographie périventriculaire (figure 8.21A).
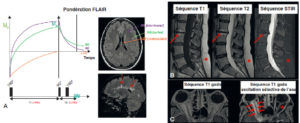
Illustration des séquences FLAIR, STIR et autre méthode d’annulation de la graisse.
A. En séquence FLAIR, le TI est long, centré sur le moment où le signal de l’eau croise le zéro. Du fait d’un TE long, il s’agit d’une séquence pondérée T2 mais sur laquelle le LCS est annulé, ce qui facilite la distinction entre des lésions hyperintenses parenchymateuses périventriculaires et le LCS comme dans la sclérose en plaques (flèches pointillées). B. En séquence STIR, le TI est court, centré sur le moment où le signal de la graisse croise le zéro. Le signal de la graisse sous-cutanée (astérisques, hyperintense en T1 et T2) est annulé, de même que la dégénérescence graisseuse des plateaux vertébraux de L2-L3 (flèches). C. Sur une séquence T1 après injection de chélate de gadolinium centrée sur les orbites, on distingue mal une éventuelle prise de contraste (hyperintense) du signal graisseux de l’orbite. En saturant le signal de la graisse (astérisque, annulation de la graisse orbitaire), on démasque bien une prise de contraste importante de la gaine du nerf optique (flèches). Ici, la méthode STIR ne peut pas être utilisée car le T1 de la graisse et le T1 de cette infiltration rehaussée sont proches. Une méthode d’excitation sélective de l’eau a été utilisée pour annuler le signal de la graisse.
La graisse a une aimantation longitudinale qui relaxe rapidement (T1 court). En utilisant un TI court (= 0,69 × T1graisse ≈ 150 ms à 1,5 T), on peut annuler le signal de la graisse. Il s’agit de la séquence STIR (short-TI inversion recovery). On utilise fréquemment cette séquence pour annuler le signal graisseux de la moelle osseuse au niveau rachidien (figure 8.21B), ou encore le contenu graisseux de l’orbite pour mieux apprécier le nerf optique et les muscles oculomoteurs. Un des inconvénients de la séquence STIR est l’annulation possible des tissus dont le T1 est proche de celui de la graisse. Par exemple, lorsqu’on utilise un agent de contraste à base de chélate de gadolinium (voir plus bas), le T1 des tissus au sein desquels le gadolinium s’accumule va diminuer (d’où l’hypersignal T1 post-gadolinium des lésions rehaussées). Il ne faut donc pas utiliser une séquence STIR après injection de gadolinium au risque de masquer les lésions rehaussées. Il existe d’autres méthodes de saturation du signal de la graisse (saturation spectrale, excitation sélective de l’eau) qu’on utilisera après injection de gadolinium si on recherche un rehaussement dans un environnement graisseux (figure 8.21C).
Autres séquences
Les acquisitions en écho de spin et écho de gradient décrites ci-dessus peuvent servir de briques élémentaires pour de nombreuses autres séquences sur lesquelles il est ajouté d’autres « modules », de façon à être sensible à un substratum biologique plus ou moins spécifiquement. En particulier, l’IRM peut être sensible aux mouvements de l’eau à différentes échelles (du microscopique au macroscopique), ce qui est exploité dans les séquences de diffusion, de perfusion et d’angiographie.
Séquence de diffusion
Les séquences précédemment décrites sont sensibles au contenu en eau. Les séquences pondérées en diffusion explorent un autre paramètre qui est l’importance des mouvements microscopiques des molécules d’eau. Il s’agit de mouvements browniens liés à l’agitation thermique (l’eau bouge dans les cellules et entre les cellules).
Pour pondérer une séquence en diffusion, on ajoute deux impulsions de gradient de diffusion de part et d’autre de l’impulsion de 180° d’une séquence T2 ES (figure 8.22A). Cela signifie que, sur la base d’une imagerie T2, on ajoute un module qui est sensible à la diffusion microscopique des molécules d’eau. En pratique, ces impulsions de gradient de diffusion induisent une chute de signal d’autant plus importante que l’eau bouge plus librement. Plus en détail, la première impulsion induit une chute de signal (déphasage). Si les molécules d’eau sont immobiles, la seconde impulsion (parfaitement symétrique par rapport à la première) compense la perte de signal initiale (rephasage) et le signal va donc être intense sur la carte de diffusion. En revanche, si les molécules d’eau sont mobiles, la seconde impulsion ne compense pas parfaitement la perte de signal induite par la première (rephasage d’autant plus incomplet que les mouvements d’eau sont importants) et le signal chute sur la carte de diffusion (figure 8.22A, B).
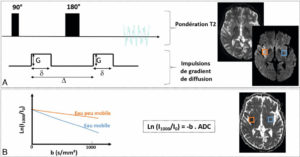
Principe de la séquence de diffusion.
A. Deux impulsions de gradient de diffusion sont appliquées de façon symétrique par rapport à l’impulsion de 180° d’une séquence T2. Ces impulsions induisent une chute de signal sur l’image résultante d’autant plus importante que l’eau est plus mobile. En bleu : parenchyme sain ; eau à mobilité normale = chute de signal. En orange : infarctus cérébral ; eau à mobilité restreinte (œdème intracellulaire) = peu de chute de signal. Noter que l’infarctus cérébral n’est pas visible sur la séquence T2 sans les impulsions de gradient de diffusion car la quantité d’eau n’est pas augmentée, mais le déficit énergétique induit par l’infarctus entraîne un transfert d’eau du milieu interstitiel vers le milieu intracellulaire où sa mobilité est plus restreinte. B. Le coefficient apparent de diffusion (ADC) quantifie la chute de signal en diffusion de manière absolue. En bleu : parenchyme sain ; chute de signal = ADC élevé. En orange : infarctus cérébral ; chute faible de signal = ADC bas.
On retient donc que les régions à diffusion restreinte apparaissent généralement en hypersignal sur la carte de diffusion (peu de chute de signal) et que les régions à diffusion accélérée apparaissent généralement en hyposignal sur la carte de diffusion (chute de signal). Pour quantifier l’information de diffusion, on utilise le coefficient apparent de diffusion (ou ADC pour apparent diffusion coefficient en anglais).
L’ADC quantifie directement la chute de signal induite par les gradients de diffusion. En pratique, la force des impulsions de gradient de diffusion (et donc l’importance de la pondération en diffusion) dépend de leur amplitude, de leur durée d’application et de leur éloignement dans le temps, ce qu’on quantifie de façon globale par le facteur « b ». Le facteur b s’exprime en s/mm2. En pratique, on collecte une première image sans gradient de diffusion (b = 0 s/mm2 ; ce qui est équivalent à un T2) et une seconde image avec l’utilisation du gradient (typiquement, b = 1000 s/mm2 en routine clinique). La chute de signal entre les images à b0 et les images à b1000 est d’autant plus grande que la force des gradients et l’ADC sont élevés : ln(I1000/I0) = –b × ADC). Autrement dit, sur la courbe de la chute de signal après application des gradients (en fonction de b), l’ADC représente la pente des droites (figure 8.22B).
À retenir sur les régions à diffusion restreinte
Les régions à diffusion restreinte :
- induisent une faible chute de signal après application des gradients de diffusion ;
- apparaissent en hypersignal sur l’image pondérée en diffusion ;
- présentent des valeurs d’ADC basses (pente faible traduisant une faible chute de signal) ;
- peuvent traduire, selon le contexte :
- un œdème intracellulaire (aussi appelé cytotoxique) comme à la phase aiguë de l’ischémie cérébrale (ballonisation cellulaire entraînant des obstacles à la diffusion de l’eau),
- une hypercellularité, par exemple au sein d’un lymphome (encombrement membranaire par excès de cellules gênant la diffusion de l’eau),
- un contenu épais, par exemple dans le cadre d’un abcès à pyogènes (contenu visqueux diminuant la diffusion de l’eau).
À retenir sur les régions à diffusion accélérée
Les régions à diffusion accélérée :
- induisent une forte chute de signal après application des gradients de diffusion ;
- apparaissent en hyposignal sur l’image pondérée en diffusion ;
- présentent des valeurs d’ADC hautes (pente élevée du fait d’une chute de signal importante) ;
- peuvent traduire, selon le contexte :
- un œdème extracellulaire (aussi appelé vasogénique), comme autour d’une tumeur cérébrale (excès d’eau interstitielle par ouverture de la barrière hémato-encéphalique refoulant les obstacles cellulaires à la diffusion de l’eau),
- une destruction tissulaire, par exemple au sein d’une lésion démyélinisée de sclérose en plaques (perte membranaire facilitant la diffusion de l’eau),
- un contenu nécrotique, par exemple au centre d’une tumeur (contenu « pseudo-liquidien » facilitant la diffusion de l’eau).
Concernant l’exploration cérébrale, on note aussi que, dans chaque voxel de l’image, ces mouvements microscopiques de l’eau ne sont généralement pas identiques dans toutes les directions de l’espace, mais se font dans une direction préférentielle. On parle de diffusion anisotrope, par opposition à la diffusion isotrope. En fait, l’eau diffuse plus facilement le long des faisceaux de substance blanche (SB) que perpendiculairement à ces faisceaux (figure 8.23A). Ainsi, en collectant l’information de diffusion dans plusieurs directions (au minimum 6 directions, le plus souvent 64 directions ou plus), on peut identifier, voxel à voxel, la direction préférentielle des mouvements microscopiques de l’eau qui reflète indirectement la direction des fibres de SB et qui permet de reconstruire virtuellement le trajet des faisceaux de SB (principe de la tractographie ; figure 8.23B).
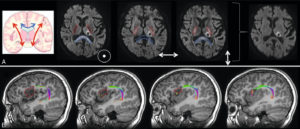
Phénomène d’anisotropie en diffusion.
A. L’eau diffuse préférentiellement le long des fibres de substance blanche et peu perpendiculairement aux fibres. Ainsi, quand on étudie les mouvements d’eau dans la direction haut/bas, la diffusion est restreinte dans le corps calleux (bleu) car on est perpendiculaire à ce dernier, mais accélérée le long des faisceaux pyramidaux (rouge) car on est dans le sens des fibres. À l’inverse, quand on étudie les mouvements d’eau en droite/gauche, la diffusion est accélérée dans le corps calleux et restreinte le long des faisceaux pyramidaux. Quand on étudie les mouvements d’eau en antéropostérieur, la diffusion est restreinte dans le corps calleux et les faisceaux pyramidaux. La moyenne géométrique de ces trois directions annule ces effets d’anisotropie et seul l’infarctus du thalamus (astérisque) qui est en restriction quelle que soit la direction reste en hypersignal. B. En multipliant les directions des gradients de diffusion, on peut identifier la direction des fibres et les reconstruire : ici, reconstruction du faisceau arqué qui est projeté sur une imagerie T1 pour étudier ses rapports avec une tumeur cérébrale (pointillés rouges).
Séquences de perfusion
L’imagerie de perfusion permet d’estimer le volume sanguin et les paramètres de microcirculation dans les tissus. Il existe de nombreuses méthodes pour mesurer la perfusion en IRM. Nous prendrons ici l’exemple de l’étude de la perfusion cérébrale en séquence T2 après injection de gadolinium.
On utilise pour cela la propriété du gadolinium de raccourcir les temps de relaxation T2 lorsqu’il est concentré au sein de la microcirculation, car il se comporte alors comme un agent paramagnétique accélérant le déphasage (= chute de signal) des vecteurs d’aimantation dans les voxels qu’il traverse et au-delà (figure 8.24A).
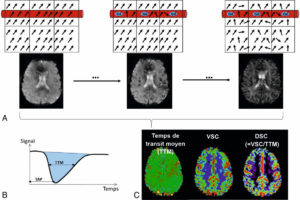
Principe de la séquence de perfusion.
A. Six voxels sont schématisés dont certains sont traversés par un vaisseau (proportions non respectées). Les vecteurs d’aimantation se déphasent lors de l’arrivée du gadolinium (chute du signal en T2 au sein des vaisseaux). Le déphasage induit par le gadolinium se propage aux voxels voisins, même si le gadolinium reste intravasculaire, ce qui accentue la chute du signal en T2. B. Courbe de variation de signal en fonction du temps de passage d’un bolus de gadolinium. Sont représentés, le temps au pic (TAP), le temps de transit moyen (TTM) et l’aire sous la courbe (bleue) qui représente le volume sanguin cérébral (VSC). C. Cartes paramétriques sur lesquelles les valeurs quantitatives issues de l’analyse des courbes de premier passage sont représentées voxel par voxel sur une échelle couleur, DSC étant le débit sanguin cérébral.
En pratique, on collecte une séquence T2 couvrant tout l’encéphale (le plus souvent T2 écho de gradient) de façon très rapide (1 à 2 secondes) et on répète cette séquence 45 à 60 fois durant l’injection d’un bolus de gadolinium. Ainsi, dans chaque point de l’image (x,y,z), on a 45 à 60 valeurs correspondant aux répétitions des acquisitions lors du passage de produit de contraste. Il s’agit d’une imagerie dite « au premier passage ». Sur les premiers volumes, le signal est stable car le gadolinium est encore en périphérie (veines périphériques, cœur, poumons), puis le signal chute quand le gadolinium arrive dans la circulation artérielle cérébrale et le signal remonte une fois que le gadolinium quitte la circulation cérébrale (figure 8.24B).
À partir de ces courbes de variation du signal lors du passage du gadolinium qui sont obtenues dans chaque voxel de l’image, il est possible de créer des cartes paramétriques dans lesquelles les valeurs d’un paramètre calculé au sein de ces courbes sont représentées au sein de l’image sur une échelle couleur (figure 8.24B, C). On calcule ainsi des cartes de temps (temps entre l’injection et la chute maximale de signal = temps au pic ; ou largeur à mi-hauteur = temps de transit moyen). On calcule aussi dans chaque point de l’image l’aire sous la courbe qui est d’autant plus importante que plus de gadolinium est arrivé et qui représente donc le volume sanguin cérébral. Ayant le volume sanguin cérébral et le temps de transit, il est possible de calculer des cartes de débit sanguin cérébral via la formule : débit = volume/temps (figure 8.24C).
Ces cartes de perfusion cérébrale peuvent être utilisées dans l’exploration d’un infarctus cérébral pour identifier l’étendue de la région hypoperfusée (allongement des paramètres de temps) qui peut être plus large que la région déjà infarcie de façon irréversible sur la séquence de diffusion (c’est le concept de la pénombre ischémique utilisé pour sélectionner les patients éligibles à un traitement de revascularisation dans des délais prolongés). Ces cartes de perfusion peuvent aussi être utilisées dans l’exploration d’une tumeur cérébrale pour identifier les régions hypervascularisées (augmentation du volume sanguin cérébral du fait d’une néo-angiogenèse liée au caractère agressif d’une tumeur gliale, par exemple).
Il existe d’autres méthodes de perfusion qui couplent l’injection de gadolinium avec la répétition de séquences T1 pour explorer d’autres organes. On peut aussi faire de la perfusion sans injecter de produit de contraste, mais en générant du signal au sein des protons du sang circulant qui est alors utilisé comme traceur endogène (technique dite par marquage de spins artériels).
Séquences d’angio-IRM
Il existe de nombreuses méthodes pour explorer les vaisseaux en IRM. Une des méthodes les plus utilisées est l’angio-IRM après injection de gadolinium. On utilise ici la propriété du gadolinium de réduire le T1 des tissus dans lesquels il est présent et donc de réduire le T1 du sang lors de son transit vasculaire. Ainsi, lorsque l’injection du gadolinium en bolus (utilisation d’un injecteur automatique) est couplée avec une séquence T1 rapide, acquise lorsque le gadolinium transite dans le système artériel, alors les artères riches en gadolinium apparaissent en hypersignal. Cette méthode est très efficace grâce au développement de séquences fortement pondérées T1 (TR et TE très courts), qui peuvent être acquises très rapidement et grâce à une bonne synchronisation de l’acquisition et du passage artériel du bolus. La réalisation d’une séquence avant l’arrivée du contraste est parfois utilisée pour servir de masque pour une éventuelle soustraction avec les séquences injectées. Les acquisitions sont aussi parfois répétées de façon dynamique après injection de façon à obtenir plusieurs phases (temps artériel, temps capillaire, temps veineux) pour l’exploration de certaines affections dans lesquelles le transit d’une phase à l’autre est perturbé (par exemple malformation artérioveineuse qui s’accompagne d’une opacification veineuse dès la phase artérielle). Pour visualiser ces imageries, on utilise généralement un post-traitement appelé MIP (maximal intensity projection) qui consiste à projeter dans chaque coupe uniquement les voxels les plus intenses (correspondant aux voxels vasculaires riches en gadolinium). En multipliant ces projections avec des angles différents, on obtient plusieurs images vasculaires 2D qu’on peut faire tourner et visualiser sous toutes les incidences comme une véritable image 3D (figure 8.25A).
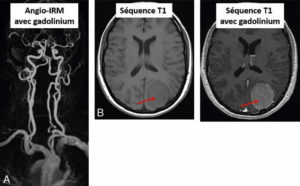
Exemples d’utilisation de chélates de gadolinium.
A. Angio-IRM des troncs supra-aortiques et des artères du cercle artériel du cerveau (polygone de Willis) après injection de gadolinium. B. Méningiome pariétal gauche (flèche) se rehaussant fortement après injection de gadolinium.
Il existe aussi plusieurs alternatives pour explorer les vaisseaux sans injecter de gadolinium en utilisant des propriétés des vecteurs d’aimantation circulants de pouvoir générer du signal sous certaines conditions (séquence en temps de vol dite TOF pour time of flight, séquence en contraste de phase). Ces méthodes ont l’avantage de ne pas nécessiter d’injection de produit de contraste, mais ont d’autres contraintes.
Agents de contraste en IRM
Les agents de contraste en IRM sont des agents exogènes (médicaments) injectés le plus souvent par voie veineuse pour augmenter le contraste entre un tissu pathologique et un tissu sain ou entre deux structures anatomiques (vaisseaux et parenchyme). Les agents de contraste les plus utilisés en IRM sont les chélates de gadolinium (agent paramagnétique à effet T1). Dans des indications particulières, on utilise parfois des nanoparticules de fer (agent super-paramagnétique à effet T2).
Propriétés physicochimiques et pharmacocinétiques des chélates de gadolinium
Le gadolinium (Gd3+) est un ion métallique de la famille des lanthanides qui possède 7 électrons célibataires sur sa couche périphérique. L’ion gadolinium libre est toxique et il est toujours utilisé sous forme chélatée soit au sein d’un macrocycle (chélate de gadolinium macrocyclique), soit au sein d’une chaîne linéaire (chélate de gadolinium linéaire). Les électrons célibataires accélèrent la relaxation de l’aimantation des tissus au sein desquels le gadolinium est présent. En effet, le retour des vecteurs d’aimantation dans le sens du champ magnétique principal après l’impulsion RF (voir plus haut) nécessite une restitution d’énergie (issue de l’impulsion RF) vers l’environnement (relaxation spin-réseau) qui est facilitée par ces électrons célibataires. Ainsi, le gadolinium est surtout utilisé comme agent T1 puisqu’il entraîne un hypersignal T1 des tissus au sein desquels il est présent. Lorsque le gadolinium est concentré, le champ magnétique local créé autour de lui (effet paramagnétique) accélère la relaxation transversale (chute du signal en T2 et T2* ; voir imagerie de perfusion de la figure 8.24A), mais cet effet est généralement moindre que l’effet T1.
D’un point de vue pharmacocinétique, les chélates de gadolinium se comportent de façon proche des produits de contraste iodés utilisés en scanner. Après injection intraveineuse, ils ont une biodistribution vasculaire puis rapidement interstitielle. Ils sont éliminés majoritairement par voie urinaire (certains ont une élimination biliaire surajoutée, ce qui est utilisé pour explorer certaines affections hépatobiliaires). Leur demi-vie est de l’ordre de 90 minutes chez les patients à fonction rénale normale.
Tolérance et effets secondaires des chélates de gadolinium
La tolérance de ces agents diagnostiques est très bonne.
Il existe des réactions d’hypersensibilité allergique ou non allergique qui sont peu fréquentes et souvent d’intensité légère à modérée et de nature transitoire (nausées, vomissements, prurit, manifestations respiratoires, etc.). De façon très rare, il a été décrit des états de choc anaphylactique.
Des cas de fibrose systémique néphrogénique (atteinte fibrosante cutanée avec une extension viscérale) ont été décrits avec des chélates linéaires, mais ne sont plus rencontrés maintenant que ces produits à risque ne sont plus utilisés chez les insuffisants rénaux sévères (débit de filtration glomérulaire [DFG] < 30 mL/min/1,73 m2). Les chélates de gadolinium ne sont pas néphrotoxiques, contrairement aux produits de contraste iodés utilisés en TDM. Compte tenu de l’absence de néphrotoxicité et du risque quasi nul de fibrose néphrogénique systémique avec les produits macrocycliques qui sont actuellement autorisés, il est possible d’injecter du gadolinium chez le patient insuffisant rénal (en se limitant uniquement à une dose toutes les 7 jours si le DFG est < 30 mL/min/1,73 m2).
La rétention intracérébrale (notamment au sein des noyaux dentelés) d’une faible partie du gadolinium injecté a été décrite, notamment lorsque les injections sont répétées (par exemple pour la surveillance d’une maladie chronique). Ces phénomènes de passage et de rétention cérébrale sont plus marqués avec les chélates linéaires. Il n’y a pas, à ce jour, de niveau de preuve suffisant pour associer ces phénomènes de rétention à des effets secondaires cliniques. Néanmoins, les chélates macrocycliques sont maintenant privilégiés et les injections répétées doivent être bien justifiées par un bénéfice clinique. Certaines maladies chroniques sont maintenant surveillées, autant que possible, sans injection de chélate de gadolinium pour limiter ces phénomènes.
Il existe peu de données cliniques sur l’utilisation des produits de contraste gadolinés pendant la grossesse. Ces produits n’ont pas d’effet tératogène ou mutagène. Néanmoins, par mesure de précaution, les produits de contraste à base de gadolinium ne doivent être injectés pendant la grossesse qu’en cas de stricte nécessité, en utilisant uniquement les plus stables et à la plus petite dose nécessaire pour le diagnostic. Le passage dans le lait maternel est minime et l’allaitement peut être poursuivi sans précaution si le produit a été injecté chez une femme allaitante.
Indications des produits de contraste en IRM
Utilisation des chélates de gadolinium
Les chélates de gadolinium sont très largement utilisés en couplage avec des acquisitions T1 pour augmenter le contraste entre des tissus normaux et pathologiques (processus tumoraux, inflammatoires, infectieux) au sein desquels le gadolinium s’accumulera (voir figures 8.20A et 8.25B).
L’injection est aussi utilisée, en couplage avec une acquisition T1 au temps artériel (et/ou veineux), pour collecter des images d’angio-IRM (voir figure 8.25A).
On exploite l’effet T2 (et T2*) en imagerie de perfusion au premier passage (voir plus haut) où l’injection en embole compacte est couplée à des acquisitions dynamiques en T2 (T2*) pour suivre le transit de l’embole qui entraîne une chute de signal (voir figure 8.24).
Autres agents de contraste IRM
Il existe d’autres agents de contraste à base d’oxyde de fer super-paramagnétique qui font essentiellement chuter le signal en T2 au sein des tissus où ils s’accumulent. En pratique clinique, ces agents sont utilisés pour l’exploration du foie car ils sont captés par le système réticulo-endothélial et induisent donc une chute de signal T2 au sein du foie (et de la rate) sain ; le tissu « extra-hépatique » (par exemple une métastase) apparaissant alors en contraste négatif (pas de chute de signal).
Réalisation pratique d’un examen IRM
Contre-indications
Avant tout examen IRM, il est impératif de s’assurer de l’absence de contre-indication. Les contre-indications sont en rapport avec la présence de matériel métallique qui peut entraîner un échauffement des tissus, un dérèglement du dispositif électronique ou une migration du matériel métallique avec risque de lésion des tissus de voisinage.
Les contre-indications à la pratique d’une IRM sont donc les suivantes :
- patient porteur d’un pacemaker non compatible IRM ;
- patient porteur d’un défibrillateur cardiaque non compatible IRM ;
- patient porteur d’une valve cardiaque mécanique ancienne non compatible IRM ;
- patient porteur d’une pompe implantée (pompe à insuline, pompe à baclofène, etc.) ;
- patients ayant des éclats métalliques intra-orbitaires (origine accidentelle, meulage, travail du métal, bricolage, etc.) ;
- patient porteur de tout éclat métallique dans le corps d’origine accidentelle (limaille, balle, éclats d’obus, etc.).
D’une manière générale, tous les implants doivent être vérifiés avant la réalisation de l’examen (valves et dérivations ventriculaires, neurostimulateur, clamps artériels carotidiens, clips anévrismes, coils, stents, filtres, prothèses et valves cardiaques, implants oculaires, implants cochléaires, implants péniens, etc.). Les dispositifs récents peuvent généralement permettre la réalisation de l’examen IRM (y compris les pacemakers récents), mais en respectant des précautions spécifiques au matériel concerné. Ces précautions concernent la valeur maximale du champ magnétique utilisable (1,5 T, 3 T), la puissance maximale des gradients utilisable, le taux d’absorption spécifique maximal (dépôt d’énergie au tissu du fait des impulsions RF).
Ainsi, chez un patient qui présente un dispositif implanté, la compatibilité doit être vérifiée par l’équipe d’imagerie en utilisant les données des constructeurs afin de s’assurer que le matériel est : 1) IRM compatible (= examen possible), 2) IRM compatible sous condition (= examen possible, mais en respectant des conditions de réalisation qui vont concerner le type de machine utilisable, le type de séquence utilisable, la durée maximale de l’examen, etc.), ou 3) IRM non compatible (= examen impossible, nécessitant d’utiliser une autre modalité, comme le scanner).
La présence de matériel orthopédique (broches, vis, prothèses orthopédiques), à l’exception des fixateurs externes, n’est pas une contre-indication, mais pourra générer un artefact métallique si le matériel est dans le champ d’exploration. Il s’agit du même problème pour le matériel d’orthodontie. On peut aussi être amené à attendre quelques semaines après réalisation d’un tatouage car certaines encres contiennent des pigments ferromagnétiques.
Les patients claustrophobes peuvent avoir des difficultés à supporter l’examen du fait de l’étroitesse du tunnel de l’aimant. Une prémédication ou l’utilisation de l’hypnose peuvent permettre de réaliser l’examen chez ce type de patients. Dans des cas particuliers (pédiatrie, claustrophobie sévère, mouvements anormaux incontrôlés, patient très agité ou non coopérant) où l’examen est indispensable, on peut être amené à réaliser l’IRM sous sédation ou sous anesthésie générale (via du matériel spécifique IRM compatible).
Le patient sera interrogé à la recherche d’antécédent d’allergie au chélate de gadolinium si une injection est nécessaire.
Les patientes en âge de procréer seront interrogées sur une éventuelle grossesse. On peut pratiquer une IRM pendant la grossesse, mais uniquement si l’examen est indispensable, sans attendre l’accouchement et généralement sans utilisation de produit de contraste (sauf nécessité diagnostique absolue, voir plus haut).
Déroulement pratique de l’examen
La demande d’un examen IRM doit faire l’objet d’une demande écrite.
Le patient est accueilli par un manipulateur en électroradiologie. Tous les objets métalliques (bijoux, lunettes, clés) ou susceptibles d’être sensibles aux lignes de champs (téléphone portable, cartes de crédit) sont retirés en dehors de la salle d’examen. En effet, même si l’acquisition n’a pas encore commencé, le champ magnétique principal (B0) est permanent et il existe un risque de projection de tous les matériaux ferromagnétiques (brancards, pieds de perfusion, lits). Le patient est ensuite allongé sur la table et le manipulateur met en place des protections auditives (casque, bouchons d’oreille) car l’examen est bruyant. Le manipulateur met aussi en place les antennes permettant d’émettre les impulsions RF et de recueillir le signal (antennes émettrices et réceptrices) en fonction de la région anatomique étudiée (antenne tête pour le crâne, antenne de surface pour l’abdomen par exemple). L’acquisition en IRM est plus longue qu’en TDM, de l’ordre de 10 à 45 minutes pour chaque région anatomique étudiée. Pendant toute la durée de l’examen, le patient ne doit pas bouger et peut communiquer avec le manipulateur présent dans la salle de commande via un microphone. Le patient pourra être perfusé par le manipulateur si une injection de produit de contraste est nécessaire.
Les séquences utilisées sont prescrites par le médecin radiologue selon la question clinique qui est posée. En fonction des constatations sur les premières séquences, le radiologue peut ajuster le choix des séquences à réaliser (soit en raccourcissant le nombre de séquences si la réponse clinique est rapidement obtenue, soit à l’inverse en ajoutant d’autres acquisitions pour aider à mieux comprendre les constatations faites sur les premières images). Le radiologue analyse l’ensemble des séquences sur une console d’imagerie dédiée et il intègre ses observations avec le contexte clinique et biologique pour faire une synthèse dans un compte rendu qui est rendu au médecin demandeur et expliqué au patient. Le compte rendu pourra soit affirmer un diagnostic, soit proposer plusieurs hypothèses qui nécessiteront d’autres examens pour conclure sur un diagnostic unique.
Essentiel à retenir
- L’IRM consiste à détecter l’aimantation des noyaux d’hydrogène et à la localiser pour reconstruire des images. Pour ce faire, on utilise le champ magnétique intense de la machine IRM appelé B0 (aimant supraconducteur) qui va polariser les aimantations nucléaires, c’est-à-dire les aligner entre elles et sur B0 en induisant une aimantation macroscopique appelée M0.
- La détection de cette aimantation macroscopique est fondée sur sa mise en mouvement via une onde de radiofréquence délivrée par l’antenne d’émission permettant de faire pivoter l’aimantation des noyaux d’hydrogène par rapport à B0.
- Le retour à l’équilibre de M0 qui se réaligne sur B0 après l’excitation radiofréquence constitue la base du signal IRM. Ce retour à l’équilibre se fait selon des caractéristiques propres à chaque tissu sous la forme de : 1) la récupération de la composante longitudinale alignée sur B0 selon une exponentielle croissante en T1, et 2) la décroissance de la composante transversale perpendiculaire à B0 selon une exponentielle décroissante en T2.
- Ce sont les antennes de réception qui vont détecter la tension induite par ce retour à l’équilibre de l’aimantation qui correspond au signal IRM. Pour localiser ce signal IRM dans le volume exploré et ainsi obtenir une image, on utilise trois gradients de champ magnétique qui se superposent au champ magnétique principal B0 et qui permettent de coder la position du signal.
- La description chronologique de ces manipulations de l’aimantation constitue une séquence IRM qui peut favoriser le contraste induit par des différences de récupération de l’aimantation longitudinale (pondération T1) ou par des différences de décroissance de l’aimantation transversale (pondération T2).
- L’ajout de modules spécifiques au sein d’une séquence IRM peut aussi permettre d’annuler un signal tissulaire spécifique (eau libre, graisse) ou de sensibiliser le signal aux phénomènes de diffusion ou de perfusion.
- Des agents de contraste IRM, dont les plus utilisés sont les chélates de gadolinium, permettent d’accentuer le contraste des tissus au sein desquels ils s’accumulent.
- L’examen IRM est sans risque, à condition que le patient ne soit pas porteur de dispositif métallique implanté pouvant migrer, se dérégler ou entraîner un échauffement des tissus.
 |
Chapitre suivant |
 |
Retour au sommaire |
