Les fondamentaux – Chapitre 16 – Radiothérapie interne vectorisée
C. Lussey-Lepoutre et E. Deshayes
Plan du chapitre
- Introduction et principes généraux
- Particularités de radioprotection
- Applications
- Radiothérapie interne sélective (RIS)
Objectifs
- Connaître les particularités de la radiothérapie interne vectorisée : type de sources, indications, effets indésirables.
- Connaître les prérequis de la radiothérapie interne vectorisée.
- Connaître les conséquences de la radioprotection.
Introduction et principes généraux
La radiothérapie interne vectorisée (RIV) est la partie thérapeutique de la médecine nucléaire. Elle concerne à l’heure actuelle une minorité de patients par rapport à la partie diagnostique, mais est en plein essor et conforte la place de thérapeute du médecin nucléaire. Cette thérapie est par ailleurs loin d’être nouvelle ; elle est utilisée depuis plusieurs dizaines d’années puisque la première utilisation remonte à 1941, date à laquelle le Dr Saul Hertz a utilisé pour la première fois de l’iode 131 pour traiter une hyperthyroïdie.
Le principe biophysique est le même que celui utilisé avec la radiothérapie externe. Il repose sur l’utilisation de l’énergie des rayonnements ionisants pour détruire un tissu ou une tumeur en créant des dommages à l’ADN de manière directe ou indirecte (radiolyse de l’eau principalement). La particularité de la RIV est son caractère spécifique d’un type cellulaire. On utilise, comme en imagerie, une source radioactive non scellée, appelée médicament radiopharmaceutique, qui est un isotope radioactif lié à une molécule biologique capable de cibler certains organes, tissus ou cellules du corps humain. Ce radiopharmaceutique va spécifiquement atteindre toutes les cellules cibles, permettant le traitement des cibles de petite taille, nombreuses et dispersées. La source est ainsi au contact ou au sein de la tumeur ou du tissu, ce qui permet d’épargner les tissus voisins et de diminuer les effets indésirables. En revanche, il n’y a pas de relation simple entre l’activité administrée et la dose absorbée, rendant la dosimétrie beaucoup plus complexe que pour la radiothérapie externe. En effet, la dose absorbée est directement reliée à la pharmacocinétique du radiopharmaceutique qui est propre à chaque patient.
L’administration se fait habituellement par voie générale (orale ou intraveineuse) et la fixation au niveau des cibles se fait en utilisant un processus métabolique (radiothérapie métabolique), par le biais d’une liaison antigène-anticorps (radio-immunothérapie) ou récepteur-ligand (radio-peptido-thérapie ou radio-ligand-thérapie).
Il existe différents types de radio-isotopes qui sont caractérisés par le type de rayonnement émis et qui vont avoir des comportements différents dans la matière. En fonction du type de désintégration et de rayonnement, les parcours dans la matière et les transferts linéiques d’énergie (TEL) sont variables. Le parcours d’un rayonnement ionisant est la distance moyenne parcourue dans la matière avant qu’il ne dépose totalement son énergie. Le TEL est une quantité qui décrit l’énergie transférée par une particule ionisante traversant la matière, par unité de distance, exprimée en keV ∙ μm− 1. En thérapie, contrairement à l’imagerie, on utilise des rayonnements ionisant à TEL plus élevé ayant pour conséquence une forte densité d’ionisations sur un court trajet. C’est une irradiation continue, à bas débit de dose avec un débit décroissant selon la période effective (Teff). La Teff est la résultante de la période physique du radioélément utilisé (Tphys) et de la période biologique (Tbio) qui est le temps mis par l’organisme pour éliminer biologiquement la moitié du radiopharmaceutique (élimination urinaire pour la plupart d’entre eux), selon la relation suivante :
Les particules principalement utilisées actuellement sont les particules α et les particules β−. Les particules α sont des noyaux d’hélium ; ce sont donc des particules lourdes dont le pouvoir ionisant est très élevé et le parcours dans la matière est extrêmement court (de l’ordre de quelques μm) à l’origine d’un TEL élevé. Les particules β− sont des électrons, beaucoup plus légers, avec un parcours plus long et plus erratique, de l’ordre de quelques millimètres. Les radio-isotopes émetteurs α utilisés en clinique sont principalement le radium 223 et l’actinium 225 (traitement des cancers de la prostate métastatiques). Les émetteurs β− peuvent être des émetteurs β purs (yttrium 90 avec faible co-émission β+) ou avec une émission γ associée (iode 131, lutétium 177).
La RIV est une thérapie administrée par voie systémique (principalement par voie veineuse périphérique ou orale). Il est donc nécessaire de connaître la biodistribution du traceur dans l’organisme et les tissus cibles ; c’est la notion de ciblage et de compagnon théranostique. En effet, ce principe de théranostique (contraction de « thérapeutique » et de « diagnostic ») est de « traiter ce qu’on voit et voir ce qu’on traite ». Cela repose sur une phase préliminaire de ciblage par une imagerie diagnostique utilisant le même vecteur radiomarqué avec un radio-isotope, le plus souvent un émetteur β+ permettant de réaliser une imagerie par tomographie par émission de positons (TEP) et de visualiser la biodistribution du traceur. Si le patient est éligible au traitement, les cibles devant présenter un niveau de captation suffisant, l’émetteur β+ diagnostique sera remplacé sur le même traceur par un émetteur α ou β–, à visée thérapeutique (figure 16.1). Après administration du radiopharmaceutique thérapeutique, s’il est émetteur impur avec une émission γ associée, il sera alors possible de visualiser sa fixation par la réalisation d’une scintigraphie dite « post-thérapeutique » (figures 16.1 et 16.2).
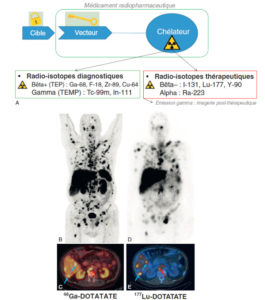
Illustration du concept de « théranostique ».
A. Concept général (cible, vecteur, chélateur, isotope). B-C. Validation de l’expression des cibles. Imagerie TEP-TDM à l’aide du 68Ga-DOTATOC (analogue des récepteurs à la somatostatine). L’examen montre une hyperfixation intense en regard de multiples lésions métastatiques majoritairement osseuses, mais également hépatiques (flèches bleues) et ganglionnaires (flèche rouge) visibles sur l’image corps entier (projection d’intensité maximale, B) et une coupe axiale au niveau hépatique (C). Ces images attestent d’une forte surexpression des récepteurs à la somatostatine. Ce critère validé, le patient a reçu une injection de Lu-177-DOTATATE thérapeutique. D, E. Imagerie post-thérapeutique. Ces images (projection d’intensité maximale vue antérieure en D, et coupe axiale TEMP-TDM en E) réalisées 24 heures après l’injection de 7,4 GBq de 177Lu-DOTATATE confirment la bonne captation du médicament radiopharmaceutique thérapeutique par les différentes cibles tumorales.
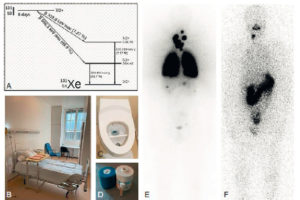
Illustration du cas d’un patient présentant un carcinome thyroïdien différencié métastatique aux poumons traité par iode 131.
A. Schéma de désintégration de l’iode 131. B. Chambre d’hospitalisation en secteur protégé. C. Sanitaire à deux compartiments permettant le recueil et le stockage des urines radioactives. D. Pot plombé et gélule d’iode 131. E. Balayage corps entier d’une scintigraphie réalisée à J5 d’un premier traitement par 3700 MBq d’iode 131 chez un patient atteint de cancer thyroïdien montrant des fixations anormales pulmonaires (aspect de miliaire pulmonaire) et cervicales (adénopathies cervicales persistantes après chirurgie). F. Balayage corps entier chez le même patient réalisé à J5 d’un second traitement par iode 131, 6 mois après le précédent et après exérèse chirurgicale des adénopathies cervicales, montrant la rémission complète au niveau pulmonaire et une fixation physiologique gastroduodénale.
Particularités de radioprotection
La RIV implique des précautions de radioprotection à la fois communes et différentes de celles appliquées à la médecine nucléaire diagnostique. L’irradiation interne étant beaucoup plus importante, les précautions vis-à-vis d’une éventuelle grossesse doivent être renforcées et prolongées à plusieurs mois après l’administration du radio-isotope. Concernant l’entourage et l’environnement, il est nécessaire, lorsque l’excrétion est principalement urinaire, de recueillir les urines et de les conserver pour décroissance dans des cuves spéciales, ainsi que d’éloigner le patient de son entourage. La durée de ces précautions est variable (de quelques heures à quelques jours) et peut nécessiter une hospitalisation. Cette hospitalisation se fait dans un secteur dit « protégé », dans une chambre spécialement conçue pour ce type de traitement avec une protection plombée au niveau des murs et des sanitaires spéciaux permettant le recueil des urines dans les cuves de décroissance.
Dans tous les cas, le suivi des recommandations de radioprotection nécessite une participation active du patient, et l’absence de compréhension de ces consignes est une contre-indication au traitement.
Applications
Les radio-isotopes les plus utilisés actuellement en RIV sont l’iode 131 en pathologie thyroïdienne bénigne et maligne, et les radiopharmaceutiques marqués au lutétium 177 pour les tumeurs neuroendocrines et le cancer de la prostate.
Iode 131 et pathologie thyroïdienne
L’iode est un élément chimique de la famille des halogènes de numéro atomique 53 et possédant 37 isotopes connus. L’iode 131 est l’isotope utilisé en thérapie thyroïdienne. C’est un émetteur double : deux émissions β– (à 90 %) permettant le traitement, puisque 95 % de l’énergie délivrée par ce rayonnement sera transférée sur une distance de 1 mm, et deux émissions γ permettant l’imagerie. Sa période physique est de 8 jours.
Ce traitement a deux indications : l’hyperthyroïdie et le cancer thyroïdien différencié. Il est administré par voie orale, uniquement au sein des services de médecine nucléaire, sous la forme d’une gélule calibrée spécifiquement pour un patient donné et livrée sur commande dans un pot plombé (voir figure 16.2). Le traitement de l’hyperthyroïdie est réalisé avec de faibles activités (le plus souvent < 740 MBq) et peut ainsi être délivré à des patients en ambulatoire (le patient peut rentrer chez lui après l’administration de la gélule). En revanche, le traitement des patients avec un cancer thyroïdien nécessite des activités beaucoup plus importantes, de l’ordre de 1100 à 3700 MBq, délivrées lors d’une courte hospitalisation de 48 à 72 heures.
L’élimination de l’iode non fixé se fait essentiellement par les urines et la période biologique varie en fonction du type de pathologie traitée : environ 6 jours pour une hyperthyroïdie (captation et rétention importantes de l’iode dans la glande thyroïde) contre seulement 24 à 48 heures pour les patients atteints de cancer thyroïdien, le traitement intervenant après thyroïdectomie totale. Les effets secondaires sont rares car l’iode, s’il peut être capté par certaines glandes exocrines (salivaires, lacrymales, etc.), est uniquement stocké dans les cellules thyroïdiennes, ce qui en fait un traitement très spécifique. L’émission γ permet la détection des foyers de fixation grâce à la réalisation systématique d’une scintigraphie dite « post-thérapeutique » entre J3 et J5 de l’administration de la gélule. C’est un traitement peu coûteux et très efficace. Il contribue au bon pronostic de ce cancer en permettant la guérison complète des formes métastatiques chez un tiers des patients, notamment s’ils sont jeunes, avec des métastases de petite taille [1], efficacité à l’heure actuelle inégalée pour un traitement systémique de cancer solide métastatique.
Lutécium 177
Le lutécium (ou lutétium) est un élément chimique de la famille des lanthanides (terres rares) de numéro atomique 71. Son dérivé isotope, le lutécium 177 (ou Lu-177), se désintègre en hafnium 177 avec une demi-vie de 6,7 jours et un mode de désintégration β– (0,4971 MeV d’énergie maximale à 78,6 %). Il possède un parcours moyen dans les tissus de 0,7 mm et, lors de sa désintégration, il existe une émission de particules γ permettant une imagerie scintigraphique post-thérapeutique.
Deux médicaments radiopharmaceutiques utilisant le Lu-177 sont actuellement disponibles en France : le 177Lu-DOTATATE (Lutathera®), médicament ciblant les tumeurs neuroendocrines [2] et disposant d’une autorisation de mise sur le marché depuis 2017, et le 177Lu-PSMA-617, disposant d’une autorisation temporaire d’utilisation pour traiter les cancers de la prostate [3]. Contrairement à l’iode qui est son propre vecteur, le lutécium 177 doit être attaché à la molécule vectrice de manière forte et stable dans le temps. On utilise pour cela un chélateur, le plus souvent le DOTA (tetraxetan), qui est lui-même relié à la molécule vectrice. Avant de réaliser ces traitements, il faut valider l’expression suffisante des cibles par une imagerie, le plus souvent TEP, à l’aide de l’émetteur gallium-68 (68Ga-DOTATOC ou 68Ga-DOTATATE). Le 177Lu-DOTATATE a pour cible les récepteurs à la somatostatine, qui sont habituellement surexprimés dans les tumeurs neuroendocrines digestives bien différenciées. Pour le cancer de la prostate, il s’agit d’une glycoprotéine transmembranaire, le PSMA (prostate-specific membrane antigen), surexprimé dans les cancers prostatiques évolués. Ces traitements ont montré une efficacité sur le contrôle de la progression tumorale, mais ils ont également un impact positif sur la qualité de vie des patients (douleurs, diarrhées, etc.). Les schémas de traitement sont standardisés : le patient reçoit des injections intraveineuses d’activités fixes de 7,4 GBq toutes les 8 semaines pour les tumeurs neuroendocrines (au maximum 4 injections), ou toutes les 6 semaines pour le cancer de la prostate (au maximum 4 injections). Une courte hospitalisation peut être proposée, mais la tendance future sera de délivrer ces traitements en ambulatoire, les contraintes de radioprotection étant moins importantes qu’avec l’iode 131. Une attention particulière est apportée au risque d’extravasation (passage du produit en dehors de la veine) lors de l’injection.
Ces traitements sont en général bien supportés ; les effets secondaires sont liés à la biodistribution du médicament (excrétion et présence des cibles sur certains tissus non tumoraux). En particulier, on note fréquemment une toxicité hématologique (variation des paramètres sanguins circulants), modérée et transitoire avec le 177Lu-DOTATATE, plus fréquente et profonde avec le 177Lu-PSMA. Le patient est donc surveillé régulièrement en cours de traitement. Une imagerie post-thérapeutique scintigraphique est habituellement réalisée après les injections ; elle permet de valider la bonne captation par les tumeurs du médicament radiopharmaceutique voire de calculer la dose absorbée.
Radiothérapie interne sélective (RIS)
La RIS ou radio-embolisation est à la frontière de la radiologie interventionnelle et de la médecine nucléaire thérapeutique, utilisée dans le traitement local des cancers du foie. Elle consiste en l’injection intra-artérielle hépatique de microsphères chargées d’yttrium 90 (90Y). L’yttrium 90 est un émetteur β– pur de haute énergie (2200 keV) avec un parcours moyen de 2,5 mm, permettant d’irradier la tumeur en préservant le foie sain péritumoral. Sa période physique est de 64,2 heures. Ce traitement nécessite un certain nombre d’étapes préalables et une collaboration étroite entre l’équipe de radiologie interventionnelle, en charge de cathétériser de façon ultra-sélective l’artère hépatique par abord fémoral, et le médecin nucléaire, en charge de l’administration par ce microcathéter des microsphères radiomarquées. Une scintigraphie préthérapeutique est systématiquement réalisée. Elle permet notamment de s’assurer de l’absence de shunt hépato-pulmonaire trop important (risque d’irradiation pulmonaire). L’yttrium 90 n’émettant pas de rayonnement γ, cette phase d’imagerie préalable est réalisée avec des macro-agrégats d’albumine marqués au Tc-99m. Cette approche endovasculaire est récente, encore en cours d’évaluation, mais pourrait avoir une efficacité en termes de contrôle du volume tumoral dans plus de 60 % des cas [4].
Essentiel à retenir
• La radiothérapie interne vectorisée (RIV) utilise des sources radioactives non scellées rendant son utilisation très réglementée.
• La RIV est très spécifique d’un type cellulaire.
• La RIV est intéressante pour les cibles disséminées (métastases) et de petite taille. Elle est plus assimilable à un traitement de type systémique que focal.
• Un ciblage des récepteurs et de la captation du traceur est souvent nécessaire : c’est la notion de théranostique.
• Les mesures de radioprotection sont spécifiques, nécessitant notamment de garder les patients dans les premières heures ou les premiers jours après l’administration du traitement dans un service de médecine nucléaire, en particulier pour recueillir leurs urines (gestion des effluents).
 |
Chapitre suivant |
 |
Retour au sommaire |
