Les fondamentaux – Chapitre 17 – Processus tumoraux
F. Cachin et L. Fournier
Plan du chapitre
Définition et rôle de l’imagerie : détection et caractérisation
Imagerie du syndrome tumoral
Bilan d’extension
Suivi des traitements
Objectifs
- Connaître le rôle de l’imagerie dans le syndrome tumoral.
- Connaître les signes séméiologiques permettant de reconnaître un syndrome tumoral.
- Connaître les traceurs utilisés en médecine nucléaire dans l’exploration des tumeurs.
Définition et rôle de l’imagerie : détection et caractérisation
Le syndrome tumoral est constitué d’un ensemble d’éléments cliniques ou paracliniques qui traduisent le développement d’une lésion tumorale, quelle qu’en soit la nature, entraînant progressivement le refoulement ou la compression des structures voisines.
Ce syndrome tumoral peut être en rapport avec une tumeur, bénigne ou maligne, mais certains diagnostics différentiels peuvent entraîner les mêmes signes tels que les processus infectieux ou inflammatoires.
L’imagerie a deux rôles dans le cadre du syndrome tumoral : la détection et la caractérisation.
La détection représente la capacité de déceler la présence d’une tumeur. Un examen d’imagerie sera d’autant plus performant pour détecter une tumeur qu’il aura une sensibilité élevée. Une circonstance particulière de la détection en imagerie est le dépistage, qui consiste à rechercher chez une personne en bonne santé apparente des signes d’une maladie avant qu’elle ne se déclare. En France, la mammographie est l’examen d’imagerie proposé en dépistage du cancer du sein chez des patientes sans symptôme et sans antécédent. Lorsqu’un examen d’imagerie est proposé pour explorer les causes d’un symptôme amenant le patient à consulter, on parle d’un examen de diagnostic (et non de dépistage).
La caractérisation représente la capacité de différencier une tumeur bénigne d’une tumeur maligne, voire de caractériser le type tumoral pour certaines tumeurs, ou de différencier une tumeur d’un autre diagnostic. Un examen d’imagerie sera d’autant plus performant pour caractériser une tumeur qu’il aura une spécificité élevée.
Imagerie du syndrome tumoral
Le syndrome tumoral sera diagnostiqué en imagerie devant :
- des signes directs, c’est-à-dire la visualisation de la tumeur grâce à une différence de signal entre la tumeur et son environnement ;
- des signes indirects, tels que le syndrome de masse refoulant les structures avoisinantes, ou le syndrome obstructif entraînant une dilatation d’amont (organes creux comme le côlon et structures canalaires comme les voies biliaires).
Signes directs du syndrome tumoral : contraste en signal
La tumeur sera d’autant mieux visualisée qu’elle présente un signal différent de son environnement (figure 17.1), soit d’opacité en radiographie, d’échogénicité en échographie, de densité en TDM, d’intensité en IRM, de captation en médecine nucléaire. Ces différences sont en rapport avec les différences de propriétés physiques entre la tumeur et les tissus, par exemple une différence d’absorption des rayons X en radiographie ou en TDM. En IRM, différentes propriétés physiques des tissus sont responsables des différences de signal : la densité en protons, l’environnement moléculaire des protons, la restriction de la diffusion de l’eau (pour la séquence pondérée en diffusion). En médecine nucléaire, ce sont les caractéristiques biologiques ou métaboliques des tumeurs qui sont utilisées pour leur détection, telles que l’hyperconsommation de glucose ou l’hyperexpression de certains récepteurs par les cellules tumorales.
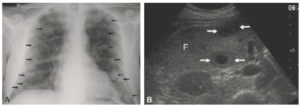
Visualisation directe de tumeurs.
A. Radiographie thoracique. De multiples nodules (flèches) sont visibles dans les deux poumons sous la forme d’opacités bien limitées de tailles variables. Ces nodules de tonalité hydrique (tissulaire) sont visibles au sein du poumon car ils contrastent avec la clarté aérique du poumon normal. Il s’agit d’une image en « lâcher de ballons » évocatrice de métastases pulmonaires. B. Coupe transverse en échographie mode B du segment VI du foie (F) au sein duquel on visualise deux lésions suspectes de métastases (flèches) dont l’échogénicité contraste avec l’échogénicité environnante du foie. La lésion supérieure est hypoéchogène homogène. La lésion inférieure présente l’aspect typique « en cible » avec un centre hypoéchogène, une couronne isoéchogène au parenchyme hépatique et une limite périphérique hypoéchogène.
Les tumeurs peuvent se présenter sous la forme de nodule ou de masse (figure 17.2). Le terme de nodule est utilisé en général pour une lésion de petite taille, ronde et bien limitée. Le terme de masse est utilisé plutôt pour une lésion plus volumineuse, à contours irréguliers. La limite en taille entre un nodule et une masse est variable, mais on peut citer l’exemple des lésions pulmonaires définies par la société Fleischner [1] :
- un micronodule est une lésion globalement sphérique de moins de 5 mm ;
- un nodule est une lésion mesurant entre 6 mm et 3 cm ;
- une masse est une lésion mesurant au moins 3 cm.
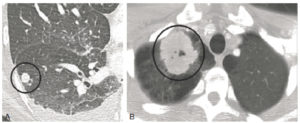
Nodules et masses pulmonaires en TDM.
A. Coupe axiale en TDM, image centrée sur le lobe inférieur droit. Un nodule (cercle noir) est visible sous la forme d’une hyperdensité ronde au sein du poumon aéré hypodense. B. Coupe axiale en TDM au niveau des apex. Une masse (cercle noir) du lobe supérieur droit mesurant 6 cm est visible sous la forme d’une hyperdensité à bords spiculés au sein du poumon hypodense.
L’injection de produit de contraste par voie veineuse permet de sensibiliser l’examen en exploitant des caractéristiques vasculaires, tissulaires ou cellulaires différenciant la tumeur des tissus avoisinants.
En radiologie, les agents de contraste utilisés en routine clinique exploitent essentiellement la différence de vascularisation des tumeurs. Le changement de signal après injection de l’agent de contraste par voie veineuse, appelée rehaussement, permet de mieux détecter la tumeur, mais aussi de la caractériser. L’échographie, la TDM et l’IRM peuvent être réalisés avec injection d’agent de contraste. En imagerie hépatique par exemple, la dynamique de rehaussement d’une lésion permettra parfois de prédire s’il s’agit d’une tumeur bénigne (angiome, par exemple) ou d’une tumeur maligne (carcinome hépatocellulaire, par exemple).
La séméiologie radiologique de ces lésions dans ces deux cas particuliers est suffisamment typique pour pouvoir se dispenser d’une preuve histologique, contrairement à la majorité des tumeurs qui nécessiteront un prélèvement afin d’affirmer le diagnostic.
En médecine nucléaire, la diversité des médicaments radiopharmaceutiques (MRP) permet d’interroger un grand nombre de processus physiopathologiques tumoraux. Dans la majorité des cas, une analyse de la biodistribution du traceur « corps entier » (scintigraphie corps entier) a pour double objectif la détection et la caractérisation du syndrome tumoral, sur la base d’anomalies de fixation à type d’hyperfixation ou d’hypofixation respectivement lors d’une augmentation ou d’une diminution de la fixation par rapport à une fixation dite « normale » (physiologique) (figure 17.3). L’analyse porte sur la tumeur elle-même (caractérisation) et sur les sites métastatiques potentiels (bilan d’extension). L’intensité des anomalies de fixation est fonction de la nature du traceur et du type histologique de la tumeur.
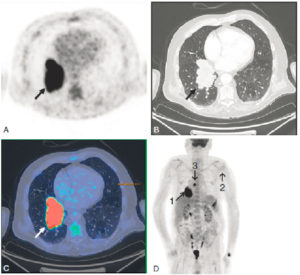
Acquisition multimodale. TEP/TDM (coupes transverses).
TEP au 18F-FDG (A), TDM (B), fusion TDM-TEP (C) et projection 3D de la biodistribution du 18F-FDG (D). Caractérisation d’une masse tumorale pulmonaire lobaire inférieure droite (B, flèche noire). Hyperfixation très intense du 18F-FDG (A, flèche noire ; C, flèche blanche) de la lésion tumorale pulmonaire orientant vers un carcinome. L’analyse de la biodistribution du 18F-FDG sur l’ensemble de l’acquisition (D) permet de réaliser le bilan d’extension. Noter les hyperfixations localisées sur la tumeur primitive (1) et sur l’adénopathie médiastinale rétrocarénaire (3), la tête humérale gauche (2) et la 10e côte gauche, témoignant respectivement d’une atteinte locorégionale lymphatique et d’une atteinte osseuse. La biopsie de la lésion pulmonaire montrera l’existence d’un adénocarcinome pulmonaire.
Plusieurs MRP sont disponibles et sont choisis en fonction de la question clinique posée et des recommandations publiées (figure 17.4). Tous explorent une perturbation du métabolisme ou d’une fonction cellulaire impliquée directement ou indirectement dans les mécanismes physiopathologiques de la cancérogenèse. Plusieurs classifications ont été proposées, les unes en fonction de la nature du traceur (acides aminés, anticorps, etc.), les autres relatives à la cible ou au métabolisme exploré (récepteurs à la somatostatine, métabolisme glucidique ou lipidique, hypoxie, etc.). Nous listons dans le tableau 17.1 les principaux MRP ayant obtenu une autorisation de mise sur le marché (AMM) et utilisés en oncologie.
Tableau 17.1 – Médicaments radiopharmaceutiques (MRP) utilisables en oncologie ayant obtenu une autorisation de mise sur le marché (AMM).
|
Nom du MRP |
Technique scintigraphique |
Phénomène biologique ciblé |
Principales indications |
|
18F-FDG1 |
TEP |
Métabolisme glucidique (expression de transporteurs GLUT-1, activité hexokinase) |
La plupart des tumeurs solides et lymphomes (à l’exception de certaines tumeurs très bien différenciées ne présentant pas ou peu de modifications du métabolisme glucidique) |
|
18F-FCH (fluorocholine) |
TEP |
Synthèse des lipides membranaires (activité choline kinase) |
Cancers de la prostate, cancers primitifs du foie |
|
18F-Fluciclovine |
TEP |
Transport d’acides aminés, analogue de la leucine |
Cancers de prostate |
|
18F-F-DOPA |
TEP |
Transport d’acides aminés |
Tumeurs cérébrales, tumeurs neuroendocrines, tumeurs du système amine precursor uptake decarboxylation (APUD) (phéochromocytomes, neuroblastomes, carcinoïdes, cancer médullaire de la thyroïde) |
|
18F-FET 18Fluoro-ethyl-thyrosine |
TEP |
Transport d’acides aminés |
Tumeurs cérébrales |
|
18F-fluorure ou FNa |
TEP |
Remodelage osseux (incorporé dans les cristaux d’hydroxyapatite de la matrice osseuse) |
Tous les cancers ostéotropes (recherche de métastases osseuses) |
|
99mTc phosphonates |
Scintigraphie conventionnelle |
Remodelage osseux (incorporé dans les cristaux d’hydroxyapatite de la matrice osseuse) |
Tous les cancers ostéotropes (recherche de métastases osseuses) |
|
123I-MIBG |
Scintigraphie conventionnelle |
Recapture et stockage de la noradrénaline |
Tumeurs du système APUD (phéochromocytomes, neuroblastomes, carcinoïdes, cancer médullaire de la thyroïde) |
|
111In-octréotide (OctreoScan®) |
Scintigraphie conventionnelle |
Expression de récepteurs de la somatostatine |
Tumeurs neuroendocrines |
|
68Ga-DOTA-(Tyr3)-octréotate |
TEP |
Expression de récepteurs de la somatostatine |
Tumeurs neuroendocrines |
|
18F-FES (18F-fluoro-estradiol) |
TEP |
Expression de récepteurs des œstrogènes |
Cancers du sein hormonodépendants, cancers de l’endomètre |
|
68Ga/18F-PSMA-ligand |
TEP |
Expression de PSMA |
Cancers de la prostate |
1. Voir chapitre 5. PSMA : prostate-specific membrane antigen.
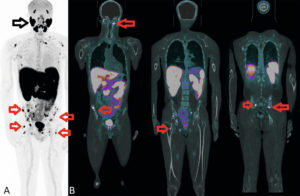
Acquisition multimodale. TEP/TDM (coupes frontales).
TEP au 68Ga-PSMA : TEP projection 3D (A), fusion TDM-TEP (B). Bilan d’extension de récidive d’un adénocarcinome prostatique. Hyperfixation très intense de nombreuses lésions osseuses secondaires (flèches rouges). Noter l’hyperfixation physiologique du traceur sur les glandes salivaires (flèche noire). La fixation intense des lésions osseuses est expliquée par une forte expression des récepteurs PSMA présents à la surface des cellules tumorales.
Signes indirects : syndrome de masse et syndrome obstructif
L’effet de masse ou le syndrome de masse est l’effet de la croissance d’une lésion, qui se traduit par des effets pathologiques indésirables, lié au déplacement ou à la compression du tissu environnant. Ces effets peuvent correspondre au refoulement des organes (figure 17.5), ou à la compression d’organes creux ou de structures canalaires. Dans ce dernier cas, un syndrome obstructif (figure 17.6) apparaît et deux types d’images sémiologiques sont observées : des images de sténose, avec une réduction du calibre du canal ou de l’organe creux à l’endroit de la pathologie, et des images de dilatation de l’organe creux ou des structures canalaires en amont de la compression.
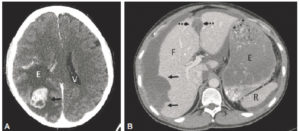
Signes indirects d’une tumeur : syndrome de masse.
A. Coupe axiale en TDM cérébrale. Une masse cérébrale prenant le contraste (flèche) entraîne un œdème en doigt de gant (E) responsable d’un syndrome de masse sur le ventricule latéral homolatéral et effaçant les sillons corticaux. Seul le ventricule controlatéral (V) est visible. B. Coupe axiale en TDM de l’abdomen. Le patient est porteur d’une tumeur péritonéale qui entraîne un effet de masse (flèches noires), refoulant le bord latéral du foie (F) et élargissant le ligament falciforme (flèches en pointillé). E : estomac, R : rate.
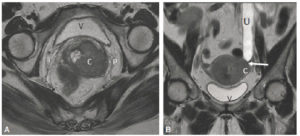
Signes directs (A) et indirects (B) d’une tumeur : syndrome obstructif.
A. Coupe axiale en IRM en pondération T2 centrée sur le col utérin. Un cancer du col est visible sous la forme d’une lésion en signal intermédiaire (C) envahissant le paramètre gauche (P). V : vessie. B. Coupe coronale en IRM en pondération T2 centrée sur le bassin. L’uretère gauche (U) est sténosé (flèche) à hauteur du paramètre gauche car envahi par le cancer du col (C), et dilaté en amont de la compression, visible sous la forme d’un canal à contenu liquidien en hypersignal T2 franc.
Lésions tumorales osseuses
Dans le cas des lésions tumorales osseuses, l’anomalie visualisée correspond le plus souvent à la réaction de l’os au contact de la lésion sous-jacente parfois non visible directement. Deux types de lésions sont décrites : les lésions lytiques entraînant une lyse de la trame osseuse et les lésions condensantes (ou sclérosantes) entraînant une condensation de la trame osseuse (figure 17.7). Typiquement, les lésions de myélome et certaines métastases osseuses sont lytiques (par exemple dans les cancers du poumon), alors que d’autres lésions métastatiques sont condensantes (par exemple dans les cancers de la prostate). Chez un même patient, la coexistence de lésions osseuses sclérosantes, de lésions ostéolytiques ou de lésions mixtes est possible.
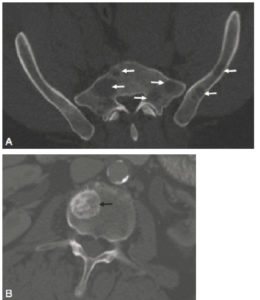
A. Métastases osseuses lytiques du bassin chez un patient porteur d’un cancer du rein. Les lésions (flèches) apparaissent sous la forme de lacunes (hypodensités) de la trame osseuse. B. Métastase osseuse du corps vertébral de L2 chez un patient porteur d’un cancer de la prostate. La lésion (flèche) apparaît sous la forme d’une condensation focale (hyperdensité) de la trame osseuse.
Bilan d’extension
Un rôle important de l’imagerie dans les syndromes tumoraux est le bilan d’extension d’un cancer. Trois niveaux d’extension sont analysés : l’extension locale et en particulier l’envahissement possible des organes de voisinage ; l’extension locorégionale et en particulier l’envahissement lymphatique ; et l’extension à distance avec l’existence de métastases dans d’autres organes.
En fonction des cancers, l’extension locale est parfois réalisée en IRM, qui offre un contraste tissulaire plus performant que la TDM. On peut citer à titre d’exemple les cancers du rectum ou utérins (voir figure 17.6).
Le diagnostic de l’atteinte lymphatique en TDM et IRM est fondé essentiellement sur des critères de taille. Un nœud lymphatique sera considéré comme suspect si son petit diamètre est supérieur ou égal à 10 mm lorsqu’il est de topographie « proximale » (le long des gros vaisseaux), et supérieur ou égal à 5 mm lorsqu’il est de topographie « distale » (dans le mésorectum par exemple). Cependant, ce critère de taille est peu spécifique, puisqu’il peut exister des nœuds lymphatiques métastatiques de petite taille et, inversement, des adénopathies réactionnelles de grande taille. L’imagerie métabolique, telles que la TEP au 18F-FDG, permet de caractériser spécifiquement l’atteinte lymphatique en montrant une hyperfixation des nœuds lymphatiques cancéreux.
Enfin, l’imagerie peut aider à guider la décision de réaliser un curage lymphatique lors de la chirurgie d’exérèse d’un cancer grâce à la technique du nœud lymphatique sentinelle – appelée technique du « ganglion sentinelle » en pratique clinique courante (voir chapitre 29). Un nœud lymphatique sentinelle est défini comme le premier relais lymphatique vers lequel les cellules cancéreuses sont les plus susceptibles de se propager à partir d’une tumeur primitive. Le médecin nucléaire et le chirurgien injectent respectivement une substance radioactive et un colorant bleu à proximité de la tumeur plusieurs heures avant la procédure chirurgicale. Lors de la chirurgie, le chirurgien utilise une sonde-compteur afin de détecter dans quel nœud lymphatique la substance radioactive a diffusé, le résèque et l’envoie à l’anatomopathologiste. Si le nœud lymphatique ne contient aucune cellule cancéreuse, le risque que le cancer se soit propagé aux autres nœuds lymphatiques situés en aval du nœud lymphatique sentinelle est très faible. Si l’analyse histologique montre la présence de cellules cancéreuses, un curage lymphatique sera réalisé afin de s’assurer que la chirurgie est carcinologique et que l’ensemble de la maladie a été réséqué.
Enfin, le bilan d’extension à distance est réalisé par TDM (figure 17.8) ou TEP (voir figure 17.3), en fonction des indications. Ces deux types d’imagerie permettent d’analyser les sites métastatiques les plus fréquents : poumon, foie, os, etc. Dans certaines indications, l’IRM corps entier peut être réalisée pour le bilan de la maladie (les myélomes, par exemple). Ces mêmes techniques permettront également de réaliser le suivi de la maladie, afin de déterminer si le cancer répond au traitement en cas de maladie métastatique traitée par thérapie systémique (chimiothérapie, thérapie ciblée, etc.).
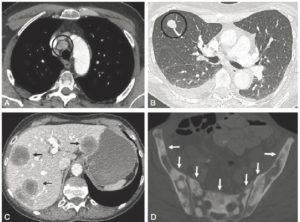
Coupes axiales en TDM du thorax en fenêtres médiastinale (A) et pulmonaire (B) de l’abdomen, en fenêtre tissu mou (C) et du bassin en fenêtre osseuse (D) montrant les multiples métastases disséminées chez une patiente porteuse d’un cancer du sein (cercles et flèches).
Suivi des traitements
L’imagerie joue un rôle majeur dans l’évaluation des traitements en cancérologie, car elle permet une mesure objective et une traçabilité des résultats.
Après un traitement curatif, elle permet de rechercher l’apparition secondaire de nouvelles lésions (rechute ou récidive).
Lors des traitements palliatifs (chimiothérapie ou thérapies ciblées, par exemple), elle permet de déterminer si le traitement proposé est efficace, résultant en une diminution, voire une disparition des lésions, ou si, au contraire, la thérapeutique est inefficace et que la maladie progresse malgré le traitement.
La plupart des méthodes d’évaluation des traitements en radiologie sont fondées sur la mesure de la taille des lésions, et des critères internationaux sont proposés pour standardiser l’évaluation de la réponse aux thérapies antitumorales (par exemple Response Evaluation Criteria In Solid Tumors [RECIST]). En médecine nucléaire, une diminution ou la disparition complète de la captation des MRP permet de définir une réponse métabolique complète ou partielle, alors qu’à l’inverse une augmentation du métabolisme ou l’apparition de nouvelles lésions métaboliques définissent une progression de la maladie. L’utilité de la médecine nucléaire pour l’évaluation de la réponse thérapeutique a été particulièrement bien démontrée avec la TEP au 18F-FDG. Cet examen est en effet devenu incontournable pour le suivi thérapeutique de certains lymphomes. La disparition précoce, dès la première ou deuxième cure de chimiothérapie, des anomalies de fixation tumorale est alors une information pronostique importante. La seule diminution de la fixation sans disparition complète est considérée comme insuffisante et pourrait imposer un changement thérapeutique. Cette stratégie est en cours de validation pour d’autres tumeurs.
L’imagerie est utilisée pour suivre l’efficacité des traitements de radiologie interventionnelle comme la radio-chimio-embolisation ou l’ablation thermique, qui requièrent l’utilisation de critères spécifiques d’efficacité.
Enfin, l’imagerie peut aider au diagnostic de certaines toxicités des traitements anticancéreux, comme les pneumopathies iatrogènes, la radionécrose ou l’insuffisance cardiaque.
Essentiel à retenir
- Le syndrome tumoral est l’ensemble des éléments cliniques ou paracliniques traduisant le développement d’une tumeur, entraînant le refoulement ou la compression des structures voisines.
- Le signe direct est la visualisation de la tumeur grâce à une différence de signal entre la tumeur et son environnement.
- Les signes indirects sont le syndrome de masse refoulant les structures avoisinantes, ou le syndrome obstructif entraînant une dilatation d’amont dans les organes creux ou structures canalaires.
- L’imagerie a pour objectif de détecter le syndrome tumoral, de le caractériser (tumeur bénigne ou maligne), d’en faire le bilan d’extension et d’en assurer le suivi sous traitement.
Référence
[1] Hansell DM, Bankier AA, MacMahon H, et al. Fleischner Society : glossary of terms for thoracic imaging. Radiology 2008; 246(3):697–722.
 |
Chapitre suivant |
 |
Retour au sommaire |
