Les fondamentaux – Chapitre 25 – Imagerie thoracique
M. Ohana , G. Ferretti , M. Montaudon et P.-Y. Le Roux
Plan du chapitre
- Radiographie du thorax
- Tomodensitométrie thoracique
- Scintigraphie pulmonaire de ventilation-perfusion
- TEP-TDM au 18F-FDG
Objectifs
Connaissances
- Connaître les critères de qualité d’une radiographie thoracique de face.
- Connaître les différences entre une radiographie de face debout et au lit.
- Connaître la séméiologie élémentaire de la radiographie thoracique :
- pouvoir différencier une opacité d’une clarté pulmonaire et d’une image mixte ;
- savoir localiser une anomalie parenchymateuse au sein des différents lobes ;
- identifier les contours de la silhouette médiastinale ;
- connaître la morphologie normale des culs-de-sac pleuraux.
- Connaître les non-indications de la radiographie thoracique selon la Haute autorité de santé (HAS).
- Connaître la séméiologie de base de la tomodensitométrie (TDM) thoracique :
- reconnaître les fenêtres médiastinale, parenchymateuse et osseuse ;
- pouvoir déterminer si la TDM est injectée ;
- si elle est injectée, savoir déterminer s’il s’agit d’un temps artériel pulmonaire, artériel aortique ou veineux ;
- reconnaître des modifications basiques de la densité du parenchyme pulmonaire : augmentation de densité (condensation alvéolaire, verre dépoli, nodules et masses) ; réduction de densité (emphysème, excavation) ; images mixtes.
- Connaître les indications principales pour lesquelles une TDM thoracique doit être injectée, et celles pour lesquelles ce n’est pas nécessaire.
- Connaître un ordre de grandeur relatif de l’exposition aux rayonnements ionisants entre radiographie et TDM thoraciques.
Compétences
- Sur une radiographie thoracique de face, reconnaître :
- un pneumothorax de forte abondance ;
- une cardiomégalie ;
- un foyer de condensation alvéolaire lobaire ;
- un nodule/une masse parenchymateuse.
- Sur une TDM thoracique, identifier :
- une condensation alvéolaire ;
- un nodule/une masse parenchymateuse ;
- une masse médiastinale ;
- un nœud lymphatique médiastinal normal/pathologique ;
- un défaut de rehaussement au sein des artères pulmonaires ;
- une hyperclarté anormale (pleurale/parenchymateuse).
Communication
- Savoir expliquer à un patient le déroulement d’une angio-TDM thoracique pour recherche d’embolie pulmonaire.
Radiographie du thorax
La radiographie du thorax reste, en 2022, l’examen radiologique le plus pratiqué en France avec environ 13 millions de clichés annuels, concernant dans 60 % des cas des patients hospitalisés. Le coût CCAM (classification commune des actes médicaux) d’une radiographie thoracique de face (réalisation + interprétation) est d’environ 26 euros.
Ce chapitre a pour objectifs de présenter les critères de qualité d’une radiographie thoracique, les éléments essentiels de sa sémiologie et ses indications résiduelles.
Critères de qualité d’une radiographie du thorax
La radiographie thoracique de face est un examen qui doit être acquis dans la mesure du possible en incidence postéro-antérieure, patient debout, de face stricte, en inspiration profonde et correctement contrasté, afin d’être interprétable (figure 25.1).
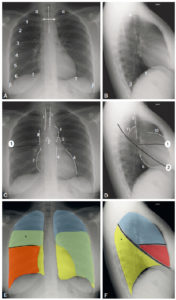
Radiographies normales du thorax, de face et de profil.
A, B. Critères de qualité et éléments anatomiques. Visibilité des apex (α) et des culs-de-sac pleuraux (β), d’au moins six arcs costaux antérieurs au-dessus des coupoles diaphragmatiques (γ) et projection symétrique des articulations sternoclaviculaires (double flèche blanche) par rapport à la ligne des processus épineux (ligne en pointillés). C, D. Structures médiastinales et scissures principales. Structures médiastinales (lignes blanches en pointillés). 1. Trachée ; 2. Carène ; 3. crosse aortique ; 4. bord gauche de l’aorte descendante ; 5. artère pulmonaire ; 6. ventricule gauche ; 7. atrium droit ; 8. veine cave supérieure ; 9. bord postérieur de la trachée ; 10. infundibulum du ventricule droit ; 11. bord supérieur et postérieur de la crosse aortique. Scissures (lignes noires). 1. Petite scissure ; 2. grande scissure (droite et gauche sont représentées superposées). E, F. Représentation des lobes pulmonaires et de leurs superpositions. En bleu : lobe supérieur ; en jaune : lobe inférieur ; en rouge : lobe moyen. Sur la radiographie de thorax de face, les lobes se superposent : la partie la plus apicale du lobe inférieur avec le lobe supérieur (*, vert) et le lobe moyen avec le lobe inférieur droit (orange). Sur le cliché de profil, seule la segmentation du poumon droit est représentée.
L’incidence postéro-antérieure répond à des critères de réalisation stricts : le patient est debout, en inspiration profonde, face contre le capteur de rayons X, dos au tube qui est situé à 1,8 mètre afin de limiter au maximum les déformations géométriques et de ne pas augmenter artificiellement la taille du cœur, situé dans le compartiment antérieur du médiastin. À l’opposé, les radiographies réalisées au lit sont acquises en incidence antéropostérieure, entraînant une majoration de taille du cœur rendant peu fiable l’appréciation du rapport cardiothoracique.
L’acquisition en position debout permet de dégager les culs-de-sac pleuraux latéraux et autorise une inspiration maximale. Les radiographies acquises en position assise ou au lit sont systématiquement de moins bonne qualité. La présence d’un niveau hydroaérique dans l’estomac, sous la coupole diaphragmatique gauche, est un bon indicateur de cliché acquis en position debout ; de même, la position couchée est généralement spécifiée sur le cliché.
L’obtention d’une face stricte est assurée par un centrage précis du patient, qui se vérifie sur le cliché de radiographie thoracique par :
- la visualisation de l’ensemble des parenchymes pulmonaires, des apex jusqu’aux culs-de-sac pleuraux ;
- le caractère médian du sternum et symétrique des articulations sternoclaviculaires par rapport à la ligne des processus épineux.
L’inspiration maximale se vérifie par la visualisation d’un nombre suffisant d’arcs costaux antérieurs ; il faut pouvoir compter au moins six arcs costaux antérieurs au-dessus de la coupole diaphragmatique droite.
Le réglage du contraste, qui peut être affiné a posteriori si l’examen est lu sur support informatique, doit permettre de visualiser la silhouette des corps vertébraux thoraciques en arrière du médiastin.
À retenir
Check-list avant de pouvoir interpréter une radiographie thoracique de face
- Vérification de l’identité du patient et de la date du cliché.
- Acquisition debout : niveau hydroaérique gastrique ; étiquetage.
- Cadrage : des apex jusqu’aux culs-de-sac pleuraux latéraux et inférieurs.
- Centrage : symétrie des clavicules par rapport à la ligne des épineuses.
- Inspiration : compter au moins 6 arcs costaux antérieurs au-dessus de la coupole diaphragmatique droite.
- Contraste : distinguer le rachis thoracique en arrière du médiastin.
Ce n’est qu’après s’être assuré de la qualité du cliché de radiographie thoracique que l’on peut passer à son interprétation. Inversement, tout cliché ne respectant pas ces critères de qualité ne doit être interprété qu’avec la plus extrême précaution ; en particulier, les radiographies thoraciques réalisées au lit sont souvent mal inspirées et mal centrées, ce qui peut très facilement créer de fausses images (syndrome interstitiel, foyer de condensation, cardiomégalie, masse médiastinale) ou, au contraire, en masquer (figure 25.2). Il ne faut pas hésiter à refaire un cliché jugé techniquement insuffisant.
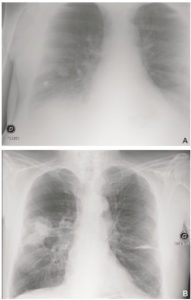
Patient de 68 ans, admis aux urgences pour altération de l’état général avec dyspnée.
Un premier cliché de radiographie du thorax (A) est réalisé à l’admission, à 23 heures. Il est techniquement insuffisant, mal cadré (il manque l’apex droit et le cul-de-sac gauche), n’est pas de face et est mal inspiré (position assise, on ne voit pas assez d’espaces intercostaux). B. Un cliché est réalisé le lendemain matin, en position debout, avec une inspiration suffisante, et démasque deux masses spiculées lobaires supérieures droites en rapport avec une néoplasie primitive.
Rappelons que le cliché radiographique montre par convention le patient vu de face ; sa droite est ainsi à la gauche du cliché.
Afin de vous aider à ne pas « oublier » de regarder un des compartiments anatomiques du thorax et à ne pas négliger une anomalie, nous vous proposons de suivre le plan de lecture systématique et organisé de la radiographie thoracique suivant :
- identification du patient ;
- qualité : centrage, position, noircissement ;
- parties molles extrathoraciques, seins ;
- cadre osseux : rachis thoracique, côtes, clavicules, scapulas ;
- médiastin : trachée, cœur, vaisseaux, lignes médiastinales ;
- hiles : taille, position, densité ;
- plèvre : diaphragmatique, costale, médiastinale ;
- champs pulmonaires : taille, situation, symétrie de transparence ;
- zones cachées : apex pulmonaires, hiles, rétrocardiaque, rétrodiaphragmatique ;
- sous le diaphragme : niveau hydroaérique gastrique.
Les acquisitions complémentaires de la radiographie thoracique standard sont :
- le profil (figure 25.1B), dont l’acquisition ne doit pas être systématique car plus irradiant que la face. Il est acquis systématiquement en profil gauche afin de minorer la taille du cœur. Il est utile pour localiser une anomalie vue sur le cliché de face (nodule, masse, condensation alvéolaire, atélectasie), explorer les espaces clairs rétrosternal et rétrocardiaque, et objectiver un épanchement pleural de faible abondance de localisation postérieure ou scissural enkysté ;
- l’acquisition de face en expiration profonde, qui peut être utile pour majorer un petit pneumothorax difficilement visible en inspiration, ou pour confirmer indirectement la présence d’un corps étranger endobronchique obstructif, entraînant l’absence de collapsus pulmonaire expiratoire du poumon d’aval (appelé également piégeage expiratoire : le poumon piégé est de grande taille et reste « noir » en expiration).
Sémiologie élémentaire de la radiographie du thorax
La radiographie standard est une imagerie de transmission et de projection (voir chapitre 3) :
- de transmission car tout ce qui atténue le faisceau de rayons X entraîne une opacité plus ou moins marquée, tandis que toute transmission anormalement facile du faisceau de rayons X (air) aboutit à une clarté ;
- de projection car la structure 3D traversée est projetée (« aplatie ») sur une image 2D.
Ces deux critères permettent de différencier et de localiser les anomalies.
Une opacité pulmonaire se traduit par une augmentation de la densité, comparativement au parenchyme pulmonaire adjacent, c’est-à-dire par une image plus « blanche ». Cette augmentation peut être plus ou moins marquée selon la composition et la taille de l’anomalie : une lésion calcifiée est plus opaque (« blanche ») qu’une lésion tissulaire, qui est elle-même plus opaque qu’une lésion graisseuse.
Une clarté est une diminution de la densité, c’est-à-dire une image plus « noire ». La clarté est due à un remplacement du parenchyme pulmonaire normal par de l’air qui n’atténue plus la transmission des rayons X (tableau 25.1).
Tableau 25.1 – Effets de l’atténuation des rayons X sur l’image radiologique
|
Absorption des RX |
Structure |
Traduction radiographique |
|
+ |
Air |
Image noire |
|
++ |
Graisse |
Image gris foncé |
|
+++ |
Tissu mou – eau |
Image gris clair |
|
++++ |
Calcification – os |
Image blanche |
|
+++++ |
Métal |
Image blanche brillante |
Une fois ces anomalies repérées, il faut déterminer leur localisation :
- médiastinale : sur le cliché de face, on définit les localisations supérieure (au-dessus de la crosse de l’aorte), moyenne et inférieure (en-dessous de la carène). Sur le cliché de profil, on détermine les positions antérieure (en avant de l’aorte ascendante et du cœur), moyenne et postérieure (derrière une ligne passant 1 cm en arrière du bord antérieur des corps vertébraux). Une opacité médiastinale se manifeste par une augmentation de densité et/ou de taille du médiastin. La clarté médiastinale, ou pneumomédiastin, se manifeste par la présence anormale d’air moulant les structures médiastinales normales ;
- parenchymateuse. Il faut préciser la position lobaire :
- à droite, il y a trois lobes : la limite entre le lobe supérieur et le lobe moyen est la petite scissure (fissure horizontale), qui du fait de sa position horizontale à mi-champ pulmonaire est souvent bien visualisée sur les clichés de face et de profil ; la grande scissure (fissure oblique) sépare le lobe inférieur, en bas et en arrière, des lobes supérieur et moyen en haut et en avant (car, en l’occurrence, un bout du lobe inférieur est au-dessus du lobe moyen). Elle n’est pas visualisée sur le cliché de face mais visible sur le profil. Le signe de la silhouette (figure 25.3) aide à localiser une anomalie. Lorsqu’une opacité anormale, ayant une densité proche des tissus, est en contact avec une structure normale de même densité (médiastin ou diaphragme) leurs contours respectifs ne sont plus visibles sur toute l’étendue du contact. Ce signe correspond à celui de la silhouette. Ce signe permet de localiser une opacité par rapport à une structure connue et parfois de la démasquer. Il n’en précise pas l’origine ;
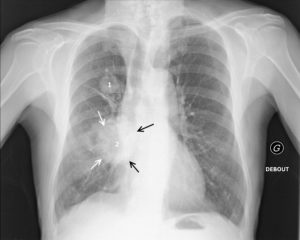
Patient de 54 ans, fumeur, avec un double cancer pulmonaire droit.
La radiographie du thorax objective un nodule du lobe supérieur droit (1) de contours spiculés, et une masse à contours spiculés (flèches blanches) en projection de la base pulmonaire droite (2). La masse 2 est soit dans le lobe moyen, soit dans le lobe inférieur. Si une opacité de tonalité hydrique se trouve dans le lobe moyen, son bord interne se confond avec le bord droit du cœur. Or, ici, la masse est silhouettée par de l’air sur son bord interne (flèches noires), ce qui signifie qu’elle n’est pas dans le plan du cœur, mais plus postérieure ; c’est le signe de la silhouette. La masse 2 se situe donc dans le lobe inférieur droit.
- à gauche, il y a deux lobes, séparés par la grande scissure. Elle est habituellement visible sur un cliché de profil et invisible sur le cliché de face.
- pleurale : il faut rechercher une opacité déclive comblant le cul-de-sac pleural (= épanchement – figure 25.4), une clarté plutôt apicale (= pneumothorax – figure 25.5) ou une opacité avec des angles de raccordement doux (= lésion d’origine pleurale – figure 25.6) ;
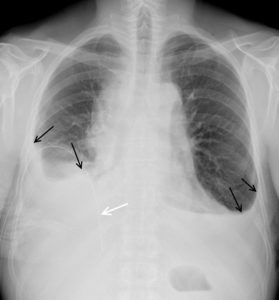
Patient de 46 ans, admis aux urgences pour dyspnée et douleur thoracique.
Comblement des culs-de-sac pleuraux latéraux par une opacité concave vers le haut, bien délimitée, à angle de raccordement pleural doux, correspondant à un épanchement pleural bilatéral. La limite de cet épanchement (flèches noires) est appelée ligne de « Damoiseau ». À droite, un drain pleural a été posé (flèche blanche). Noter la disparition des contours normaux des coupoles diaphragmatiques en raison d’un signe de la silhouette.
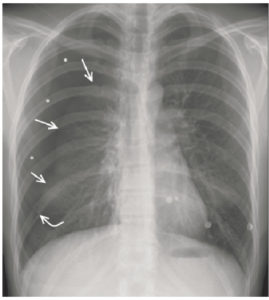
Patient de 18 ans, admis aux urgences pour douleur thoracique droite secondaire à une chute d’un arbre.
On visualise une hyperclarté hémithoracique périphérique droite (astérisques), avec une absence de trame alvéolo-interstitielle et une ligne pleurale (flèches) délimitant de manière nette le poumon droit tassé : pneumothorax droit secondaire à une fracture costale (flèche courbe).
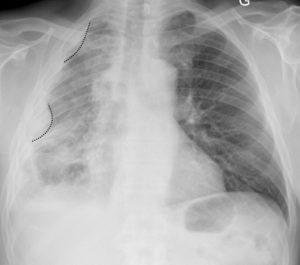
Patient de 57 ans exposé professionnellement à l’amiante.
Multiples opacités pleurales droites, à angle de raccordement doux, réalisant un aspect festonné de la plèvre. Il s’agit d’un aspect évocateur d’une tumeur primitive de la plèvre, le mésothéliome. Il s’accompagne d’une perte de volume du poumon droit.
- pariétale : les clartés pariétales témoignent de la présence anormale d’air dans la paroi. La cause la plus fréquente est l’emphysème pariétal accompagnant un pneumothorax (figure 25.7).
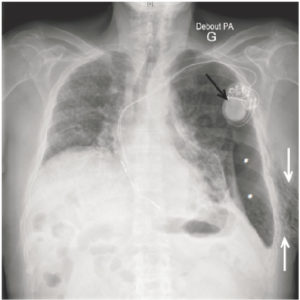
Patient de 87 ans porteur d’une fibrose pulmonaire idiopathique.
Pneumothorax gauche (astérisque) avec emphysème sous-cutané pariétal axillaire gauche (flèches blanches), se manifestant sous la forme de clartés linéaires d’extension limitée. Noter l’aspect pathologique du parenchyme pulmonaire droit en rapport avec la fibrose. Présence par ailleurs d’un pace-maker (flèche noire).
Une fois la lésion localisée, il faut étudier ses caractéristiques :
- contours : sont-ils nets (= limite claire entre la lésion et les structures saines adjacentes) ou flous ? S’ils sont nets, sont-ils réguliers ou irréguliers ? S’ils sont irréguliers, sont-ils macrolobulés, microlobulés ou spiculés ?
- forme : ronde, ovalaire, segmentaire, etc. ;
- densité : homogène ou mixte (= mélange d’opacités et/ou de clartés différentes) ?
- taille : pour les lésions du parenchyme, on parle de micronodule lorsqu’une lésion fait moins de 5 mm, de nodule jusqu’à 3 cm et de masse au-delà de 3 cm.
Indications
La radiographie est un examen très souvent demandé pour de nombreuses pathologies thoraciques.
Afin de limiter son utilisation, la HAS a établi en 2009 une liste des principales non-indications de la radiographie thoracique :
- dans les maladies respiratoires non tumorales, la radiographie thoracique n’est pas indiquée dans les infections des voies aériennes hautes, la bronchite aiguë, la bronchiolite non compliquée de l’enfant ou la douleur thoracique non spécifique en dehors de l’urgence ;
- dans les maladies cardiovasculaires, la radiographie thoracique n’est pas indiquée en cas d’hypertension artérielle (HTA) ou pour le suivi de l’insuffisance cardiaque ;
- dans les maladies tumorales, la radiographie thoracique n’est pas indiquée pour le dépistage et ne garde que de rares indications pour le suivi, entre deux examens tomodensitométriques ;
- dans le bilan pré-anesthésie, la radiographie thoracique n’est pas indiquée chez les sujets de moins de 60 ans sans comorbidités cardiopulmonaires ;
- dans les services de réanimation, la radiographie thoracique n’est pas indiquée de manière systématique chez un patient stable non ventilé ;
- dans les services d’urgences, la radiographie thoracique n’est pas indiquée systématiquement, et ne doit pas être réalisée lorsque l’on suspecte une perforation œsophagienne, une dissection aortique ou une rupture d’anévrisme.
Tomodensitométrie thoracique
Le thorax, y compris en imagerie cardiaque, est un domaine où la tomodensitométrie (TDM) excelle, du fait de sa haute résolution spatiale et du contraste naturel élevé des structures (voir chapitre 4).
Technique
L’interprétation d’une TDM thoracique doit absolument se faire sur une console informatique, qui permet une adaptation en temps réel du contraste, des zooms, des reconstructions multiplanaires dans les trois plans de l’espace, des reconstructions obliques selon le plan des vaisseaux et un défilement facilitant le repérage d’anomalies.
Il est plus simple d’analyser une TDM thoracique en trois étapes successives (figure 25.8) :
- l’étude du médiastin : elle se fait en « fenêtre médiastinale » (niveau 30 unités Hounsfield [UH]) ; largeur 350 UH), avec un filtre qui favorise le contraste et permet de bien analyser les structures tissulaires et vasculaires du médiastin ;
- l’étude du parenchyme : elle se fait en « fenêtre parenchymateuse » (niveau –400 UH ; largeur 1600 UH), avec un filtre qui favorise la résolution spatiale et fait bien ressortir les structures interstitielles fines.
- l’étude de la paroi : elle se fait en « fenêtre osseuse » (niveau 500 UH ; largeur 1500 UH), avec un filtre qui favorise la résolution spatiale et des reconstructions 2D et 3D.
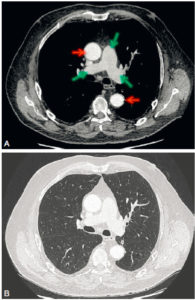
Coupes axiales d’une TDM thoracique, en fenêtre médiastinale (A) et en fenêtre parenchymateuse (B).
Le caractère injecté ou non de l’examen se détermine sur la fenêtre médiastinale. Ici, cette TDM est injectée, car il existe un rehaussement des vaisseaux (aorte, flèches rouges ; et artères pulmonaires, flèches vertes).
Pour l’analyse du médiastin, il est possible de mieux faire ressortir les structures vasculaires et tissulaires en injectant un produit de contraste iodé en intraveineux.
Les structures vasculaires et tissulaires médiastinales sont analysées après injection d’un produit de contraste iodé en intraveineux, avec possibilité de réaliser des acquisitions à différents temps (figure 25.9) :
- un temps sans injection, dit en « contraste spontané » : il est reconnu par l’aspect gris homogène des vaisseaux médiastinaux ;
- un temps artériel pulmonaire : il est reconnu par une opacification des artères pulmonaires qui apparaissent rehaussées et donc très blanches. C’est une angioTDM des artères pulmonaires, sur laquelle l’aorte n’est parfois pas encore opacifiée ;
- un temps artériel aortique : il est acquis un peu après le temps artériel pulmonaire, et est reconnu par une opacification très marquée de l’aorte thoracique. C’est une angioTDM aortique, sur laquelle les artères pulmonaires ne sont parfois déjà plus opacifiées ;
- un temps veineux : il est acquis entre 70 et 90 secondes après injection. Il sert à l’étude des lésions tissulaires comme les adénopathies, les tumeurs médiastinales, les collections pleurales, etc.
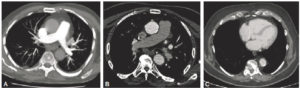
TDM thoraciques injectés, en coupe axiale et en fenêtre médiastinale.
A. L’artère pulmonaire et ses branches sont bien opacifiées (« blanches ») et l’aorte est encore grise ; il s’agit donc d’un temps artériel pulmonaire. B. L’aorte est bien opacifiée (« blanche ») et les artères pulmonaires ne sont plus aussi « blanches » qu’en (A) ; il s’agit d’un temps artériel aortique. C. Les cavités cardiaques droite et gauche sont opacifiées de manière homogène ; il s’agit d’un temps veineux (dit d’équilibre).
L’injection se réalise habituellement par une veine du membre supérieur, avec administration de 50 à 120 mL de produit de contraste iodé à un débit compris entre 1,5 et 5 mL/s. Pour le temps artériel, le déclenchement de l’acquisition se fait par méthode de suivi de l’embole (« bolus-tracking »), avec réalisation d’une coupe test au niveau de l’artère pulmonaire ou de l’aorte, permettant de déclencher l’acquisition au moment exact où ces vaisseaux sont parfaitement opacifiés.
Sémiologie élémentaire
Étude du médiastin
L’analyse des gros vaisseaux du médiastin nécessite une injection de produit de contraste.
On s’intéresse principalement à l’aorte thoracique (aorte ascendante, crosse aortique avec l’origine des troncs supra-aortiques et aorte thoracique descendante) et aux artères pulmonaires.
Pour chaque vaisseau, on analyse (voir figure 25.9) :
- la taille :
- aorte ascendante :
- normale < 45 mm de diamètre,
- si > 45 mm : anévrisme,
- artère pulmonaire :
- normale < 29 mm,
- si > 29 mm, forte suspicion d’hypertension pulmonaire.
- le contenu (figure 25.10) :
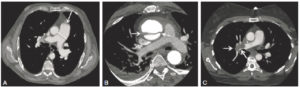
TDM thoraciques en coupe axiale et en fenêtre médiastinale, montrant différentes pathologies visibles grâce à l’injection de produit de contraste.
A. Artère pulmonaire augmentée de taille (flèche), avec un tronc mesurant 37 mm de diamètre, ce qui est un signe d’hypertension pulmonaire. B. Image hypodense linéaire au sein de l’aorte ascendante, correspondant à un flap intimal (flèches) : dissection aortique ascendante. Il existe un épanchement péricardique et pleural associé. C. Image hypodense de type défect endoluminal au sein de l’artère pulmonaire droite : une embolie pulmonaire aiguë (flèches).
- le contenu normal des vaisseaux opacifiés est homogène mais la densité est variable en fonction du temps d’injection, de la concentration et du débit d’injection du produit de contraste ;
- une image linéaire hypodense (gris sombre) au sein de l’aorte traduit un flap intimal (intima + média) de dissection aortique ;
- une image hypodense centrale au sein des artères pulmonaires est en rapport avec une embolie pulmonaire aigue.
La recherche de nœuds lymphatiques médiastinaux anormaux est facilitée par l’injection de produit de contraste, qui permet de mieux les différencier des vaisseaux. Ils sont principalement recherchés au niveau des hiles, autour de la trachée et à gauche de la crosse aortique (figure 25.11). La TDM thoracique peut aussi révéler des nœuds lymphatiques axillaires, supraclaviculaires ou jugulocarotidiens bas.
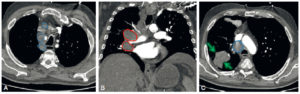
Patient de 56 ans suivi pour adénocarcinome pulmonaire.
TDM thoracique injectée en coupes axiales (A, C) et coronale (B), mettant en évidence de multiples adénomégalies médiastinales en latérotrachéal droit (A, C, ronds bleus) et en hilaire droit (B, ronds rouges) secondaires au cancer lobaire inférieur droit (C, flèches vertes).
Pour chaque nœud lymphatique décelé, on étudie :
- la taille : il est normal de voir des nœuds lymphatiques inférieurs à 10 mm de petit axe dans le médiastin et les hiles. Un nœud lymphatique dont le petit axe est supérieur à 10 mm est suspect : on parle d’adénomégalie. Plus le nœud lymphatique est de grande taille, plus le caractère pathologique est fort ;
- la morphologie : un nœud lymphatique rond, se rehaussant de manière importante ou contenant des plages hypodenses de nécrose est suspect ;
- la densité : la présence de calcifications est fréquente, témoignant soit de séquelles infectieuses (tuberculose), soit de maladies chroniques granulomateuses (sarcoïdose, silicose). Un centre graisseux est en faveur d’un nœud lymphatique bénin.
Un épanchement pleural ou péricardique se visualise facilement en TDM (figure 25.12).
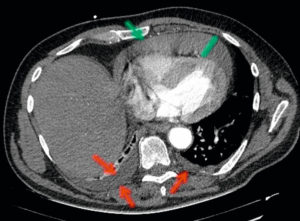
Patient de 74 ans avec syndrome inflammatoire.
TDM thoracique injectée en coupe axiale et en fenêtre médiastinale montrant un épanchement pleural bilatéral (flèches rouges) et un épanchement péricardique (flèche verte) de plus de 1 cm d’épaisseur, de forte abondance. Tous ces épanchements ont une densité faible (ils sont « gris foncé ») qui correspond à une densité liquidienne.
Son abondance peut être évaluée par la mesure de son épaisseur dans un plan horizontal ; un épanchement pleural de plus de 4 cm et un épanchement péricardique de plus de 1 cm peuvent être considérés comme abondants.
Devant tout épanchement pleural, il faut rechercher des nodules tissulaires accolés aux parois, reconnus à leur densité différente du liquide d’épanchement (figure 25.13). La constatation de tels nodules signe l’origine néoplasique de l’épanchement (soit lésion pleurale primitive type mésothéliome, soit métastase pleurale).
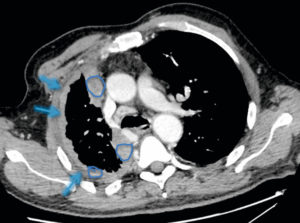
TDM thoracique injectée en coupe axiale du patient de la figure 25.6, montrant un épaississement pleural droit (flèches) dense constitué de plusieurs nodules tissulaires (ronds bleus) (a contrario des anomalies de densité liquidienne de la figure 25.12), différents d’un simple épanchement liquidien, en rapport avec un mésothéliome.
Étude du parenchyme
La condensation alvéolaire (figure 25.14) correspond à une plage de parenchyme pulmonaire dense (« blanche ») au sein de laquelle on parvient encore à distinguer des bronches normalement aérées, donc encore noires (signe du bronchogramme aérique).
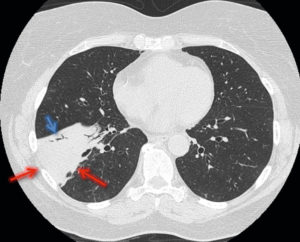
TDM thoracique en coupe axiale et en fenêtre parenchymateuse chez une patiente de 61 ans admise aux urgences pour dyspnée fébrile.
Mise en évidence d’une condensation alvéolaire bien systématisée lobaire inférieure droite (flèches rouges) avec bronchogramme aérique (flèche bleue), correspondant à une pneumopathie franche lobaire aiguë.
La condensation alvéolaire, lorsqu’elle est systématisée à un segment pulmonaire et associée à un syndrome infectieux clinique et biologique, correspond généralement à une pneumopathie infectieuse (bactérie, virus ou champignon). Mais de nombreuses autres causes sont responsables de condensations alvéolaires d’évolution aiguë : œdème pulmonaire cardiogénique ou non, pneumonie d’aspiration par fausse route, hémorragie pulmonaire, infarctus parenchymateux compliquant une embolie pulmonaire, pneumonie médicamenteuse. En présence d’une condensation alvéolaire d’évolution chronique, il faut éliminer un adénocarcinome pulmonaire à forme pneumonique ou un lymphome.
Un nodule pulmonaire correspond à une lésion tissulaire plus ou moins arrondie située au sein du parenchyme pulmonaire.
Devant un nodule pulmonaire, il faut analyser (figure 25.15) :
- sa taille : comme en radiographie, un nodule de moins de 5 mm est un micronodule ; un nodule de plus de 30 mm est appelé masse pulmonaire et est hautement suspect de lésion tumorale ;
- ses contours : réguliers ou spiculés ; l’aspect spiculé « en étoile » est également très suspect de tumeur ;
- sa densité, étudiée en fenêtre médiastinale : le nodule peut être de densité tissulaire, donc gris, prenant plus ou moins le contraste, ou être de densité graisseuse (donc noir), ou calcique (très blanc) ;
- le nombre et la localisation.
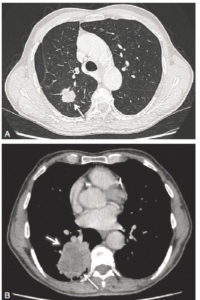
A. Patient de 69 ans, fumeur. TDM thoracique en coupe axiale et en fenêtre parenchymateuse montrant un nodule spiculé du lobe supérieur droit (flèche). Le caractère spiculé et la taille de ce nodule sont très évocateurs d’un cancer pulmonaire primitif. B. Patient de 79 ans, fumeur. TDM thoracique injectée en coupe axiale et en fenêtre médiastinale démontrant une masse de 7 cm du lobe inférieur droit, avec des contours irréguliers spiculés et un centre hypodense correspondant à de la nécrose (flèches). L’association d’une lésion de plus de 3 cm (masse), de contours irréguliers et d’un centre nécrotique est très évocatrice d’une néoplasie pulmonaire primitive. Cependant, cet aspect peut également être trouvé en présence d’un abcès pulmonaire.
Indications
La TDM thoracique utilise des rayons X, avec des doses qui sont nettement plus élevées que celles d’une radiographie du thorax : habituellement entre 5 et 100 fois plus qu’une radiographie thoracique selon le morphotype du patient. Ainsi, ses indications se doivent d’être parfaitement justifiées afin de limiter l’exposition des patients
Dans la recherche et/ou l’analyse d’anomalies parenchymateuses (pneumopathies infectieuses compliquées, nodules parenchymateux, pneumopathies interstitielles, recherche d’un pneumothorax, etc.), une TDM thoracique sans injection est suffisante.
Dans le bilan d’anomalies médiastinales, qu’elles soient tissulaires (recherche d’adénopathies médiastino-hilaires, bilan de tumeurs médiastinales, analyse d’épanchements chroniques ou cloisonnés) ou vasculaires (analyse des artères pulmonaires, analyse de l’aorte, bilan d’hémoptysies, etc.), une injection est nécessaire, avec un temps d’acquisition (artériel pulmonaire, artériel aortique ou veineux) adapté à la pathologie recherchée.
Scintigraphie pulmonaire de ventilation-perfusion
Technique
La scintigraphie pulmonaire permet de visualiser la distribution régionale des deux grands systèmes nécessaires à l’hématose : la perfusion et la ventilation pulmonaire.
L’étude de la perfusion se fait après injection dans une veine périphérique de macro-agrégats de sérum albumine marqués au 99mTc. Ces particules ont un diamètre de l’ordre de quelques dizaines de microns, supérieur au diamètre des capillaires pulmonaires. La fixation du traceur est donc mécanique, par blocage (embolisation) au niveau des précapillaires pulmonaires. Environ 1 capillaire sur 10 000 est obstrué ; l’examen ne présente donc pas de risque pour le patient.
L’étude de la ventilation se fait après inhalation d’un gaz radioactif (krypton 81mKr) ou d’aérosols (particules de carbone ou phytates) marqués avec du 99mTc, qui vont se déposer au niveau des parois bronchiques selon la ventilation régionale.
L’examen est réalisé à l’aide d’une gamma-caméra. Deux modes d’acquisition sont possibles : planaire (six incidences sont classiquement réalisées : antérieure, postérieure, deux incidences obliques postérieures et deux profils) ou tomographique, qui permet, comme pour une TDM, la reconstruction multiplanaire des images dans les trois plans de l’espace.
Sémiologie élémentaire
Dans une scintigraphie de perfusion normale, la distribution du radiotraceur est homogène sur l’ensemble du parenchyme pulmonaire. Les hiles et le médiastin ne sont pas hyperfixants (les macro-agrégats sont bloqués au niveau des précapillaires pulmonaires ; ils ne circulent plus). L’acquisition étant réalisée en décubitus dorsal, il existe fréquemment un gradient de fixation antéropostérieur du fait de la gravité.
Quand le flux sanguin est interrompu ou significativement altéré dans une région du poumon, celle-ci apparaît comme une zone hypofixante ou non fixante.
Ainsi, la scintigraphie de perfusion permet de visualiser la distribution régionale du flux sanguin artériel pulmonaire.
Dans une scintigraphie de ventilation normale, la distribution du radiotraceur est également homogène. Si un gaz radioactif est utilisé (81mKr), la trachée et les bronches proximales sont visualisées. Avec les aérosols, des foyers très hyperfixants sont parfois visualisés, correspondant à des impactions focales du radiotraceur au niveau des bifurcations bronchiques.
Comme pour les images de ventilation, une diminution ou l’absence de ventilation dans un territoire apparaît comme une zone hypofixante ou non fixante.
L’interprétation d’une scintigraphie pulmonaire de ventilation-perfusion repose sur une analyse comparative des images de ventilation et de perfusion.
Pour chaque hypofixation décelée, on précise :
- sa topographie (lobe, segment) ;
- sa taille : typiquement segmentaire ou sous-segmentaire ;
- l’intensité de l’hypofixation ;
- son aspect systématisé ou non. Pour qu’un défaut de perfusion soit évocateur d’une embolie pulmonaire, il doit être systématisé, c’est-à-dire triangulaire à base pleurale, correspondant anatomiquement à un territoire vasculaire (lobe, segment ou sous-segment) ;
- la concordance des anomalies perfusionnelles et ventilatoires.
Indications
L’indication principale de la scintigraphie pulmonaire de ventilation-perfusion est la recherche d’embolie pulmonaire (figure 25.16). L’embolie pulmonaire correspond à l’obstruction d’un ou de plusieurs vaisseaux artériels pulmonaires par un caillot de sang (thrombus). Celui-ci a le plus souvent migré depuis une veine des membres inférieurs atteinte par une phlébite, appelée aussi thrombose veineuse. Selon le niveau de l’obstruction et le diamètre du caillot, tout ou une partie du poumon est privé de sang. Cette obstruction se traduit en scintigraphie pulmonaire par une hypofixation systématisée sur les images de perfusion (absence de vascularisation en aval de l’embole), non retrouvée sur les images de ventilation (absence de conséquence sur la ventilation à la phase aiguë de l’embolie pulmonaire).
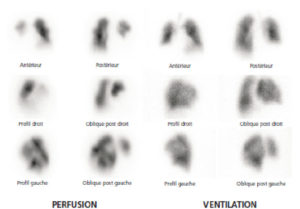
Patient de 68 ans adressé aux urgences pour dyspnée et douleur thoracique.
La scintigraphie de perfusion met en évidence de multiples hypofixations segmentaires et sous-segmentaires systématisées, bilatérales, non retrouvées sur les images de ventilation. L’examen est donc très évocateur d’une embolie pulmonaire récente.
L’examen peut également être utilisé pour évaluer la distribution régionale de la perfusion et de la ventilation pulmonaire, par exemple dans le cadre du bilan préopératoire d’un cancer pulmonaire.
TEP-TDM au 18F-FDG
Sémiologie élémentaire
De façon physiologique, les poumons, remplis d’air, apparaissent hypofixants. Le médiastin présente une hyperfixation modérée correspondant au FDG présent dans la circulation sanguine. Une hyperfixation du myocarde est fréquente et physiologique.
Lors de l’interprétation, on recherche des hyperfixations pathologiques sur les images TEP, les images TDM couplées permettant de préciser leur correspondance anatomique. Pour chaque hyperfixation, on précise son intensité, son caractère focal ou diffus, sa correspondance anatomique.
Indications
La TEP-TDM pulmonaire est indiquée pour caractériser les nodules pulmonaires de taille supérieure à 1 cm. Un nodule ne fixant pas le FDG (non hypermétabolique) peut être surveillé en tomodensitométrie. En revanche, un nodule hypermétabolique doit faire l’objet d’un contrôle histologique.
La TEP-TDM est également indiquée lors du bilan d’extension des cancers pulmonaires pour évaluer l’extension lymphatique et métastatique à distance de la maladie (figure 25.17). Elle permet de plus d’apprécier la réponse aux traitements antitumoraux et de détecter les récidives.
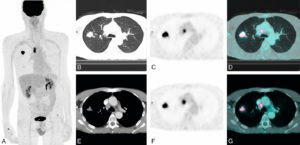
Patient de 65 ans, fumeur, adressé pour caractérisation et bilan d’extension d’une masse pulmonaire droite.
Images TDM (B et E), TEP-FDG (A, C et F) et TEP-FDG fusionnées à la TDM (D et G) montrant une hyperfixation très intense de la masse pulmonaire droite, confirmant son caractère très suspect. Il s’y associe une hyperfixation très intense d’une adénopathie latérotrachéale droite, faisant fortement suspecter une extension ganglionnaire médiastinale homolatérale. En revanche, absence d’hyperfixations évocatrices d’une atteinte ganglionnaire médiastinale controlatérale, viscérale ou osseuse.
La TEP-TDM au 18F-FDG présente aussi un intérêt pour le bilan de maladies inflammatoires (sarcoïdose par exemple) ou en pathologie infectieuse (infection de prothèse) (voir chapitre 19).
Essentiel à retenir
- La radiographie thoracique de face reste l’examen princeps en imagerie thoracique, même si ses performances en termes de sensibilité et de spécificité sont modestes. Elle doit répondre à des critères de qualité strictes afin d’être interprétable. Elle s’analyse de manière systématique.
- La TDM thoracique est l’examen de référence pour l’analyse du parenchyme (injection de produit de contraste non obligatoire) et du médiastin (injection de produit de contraste nécessaire). Elle s’analyse sur console de travail, de manière dynamique, en exploitant les possibilités de reconstructions et de modification du contraste. Elle est entre 5 et 100 fois plus exposante aux rayonnements ionisants qu’une radiographie thoracique de face.
- La scintigraphie pulmonaire permet la visualisation de la distribution régionale de la ventilation et de la perfusion pulmonaires. Sa principale indication est la suspicion d’embolie pulmonaire.
- La TEP-TDM au 18FDG est un examen essentiel en oncologie thoracique, notamment pour la caractérisation des nodules pulmonaires et le bilan d’extension des cancers pulmonaires.
Pour en savoir plus
- Lacey G, Morley S, Berman L. La radiographie thoracique. Manuel pratique. Traduction L. Arrivé. Paris: Elsevier Masson ; 2009.
 |
Chapitre suivant |
 |
Retour au sommaire |
