Les fondamentaux – Chapitre 26 – Imagerie cardiovasculaire
A. Cochet et D. Mandry
Plan du chapitre
- Introduction
- Techniques d’imagerie
- Grands syndromes et leurs moyens d’exploration
Objectifs
- Connaissance
- Connaître les spécificités des principales techniques d’exploration de l’appareil cardiovasculaire : radiographie conventionnelle, angiographie, échographie, TDM, IRM, techniques scintigraphiques.
- Connaître leurs intérêts, limites et principales indications en pathologie cardiaque et vasculaire.
- Reconnaître les principales structures anatomiques du cœur et des vaisseaux sur des images d’IRM et de TDM.
- Savoir reconnaître un œdème aigu pulmonaire sur une radiographie de thorax et sur une TDM.
- Savoir reconnaître une ischémie et une nécrose sur une scintigraphie myocardique.
- Reconnaître et savoir décrire une séquelle d’infarctus sur une IRM cardiaque.
- Reconnaître et savoir décrire les éléments sémiologiques des principales pathologies vasculaires : anévrisme (échographie, TDM, IRM) ; dissection aortique (TDM, échographie) ; sténose artérielle (TDM, IRM, échographie, angiographie).
- Communication
- Savoir expliquer les principes de réalisation des examens à un patient.
Introduction
Ce chapitre présente les différentes techniques d’imagerie utilisées pour les explorations cardiovasculaires en insistant sur les particularités de l’exploration cardiaque, et sur leur utilité dans l’exploration des grands syndromes (pathologies vasculaires, ischémie et infarctus myocardique, insuffisance cardiaque).
Les prérequis sont les bases physiques des principales techniques d’imagerie, l’anatomie et la physiologie du cœur et de l’aorte, la physiopathologie et la séméiologie élémentaire des grands syndromes cardiovasculaires.
Techniques d’imagerie
Particularités des explorations cardiovasculaires en imagerie
Les techniques d’imagerie cardiovasculaire doivent tenir compte des particularités anatomiques et physiologiques du cœur.
Orientation des plans de coupe
L’imagerie en coupes (TDM, IRM, scintigraphie) du cœur nécessite généralement une orientation selon le grand axe du ventricule gauche (VG). Celui-ci est défini comme une ligne qui passe par le centre de l’orifice mitral et par l’apex du VG. Il permet de définir trois plans de coupe : le plan dit « grand axe vertical » (ou plan « deux cavités »), le plan dit « grand axe horizontal » (ou « quatre cavités »), et le plan « petit axe », perpendiculaire aux précédents (figure 26.1). Cette orientation standardisée est commune à toutes les techniques d’imagerie en coupe du cœur, et permet en particulier une analyse précise de chacune des cinq parois du VG (parois antérieure, septale, inférieure, latérale et apicale).
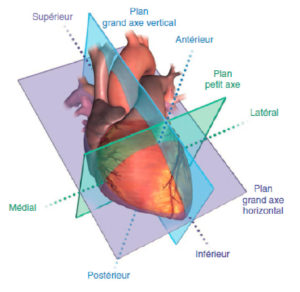
Orientation des trois principaux plans de coupe utilisés en imagerie cardiaque, définis selon le grand axe du ventricule gauche (VG).
VD : ventricule droit.
Source : Mitchell C, Rahko PS, Blauwet LA, et al. Guidelines for performing a comprehensive transthoracic echocardiographic examination in adults: recommendations from the American Society of Echocardiography. J Am Soc Echocardiogr 2019 ; 32 : 1–64..
À partir de ces trois plans standardisés, d’autres orientations sont possibles, par exemple dans le plan de la chambre de chasse du VG, ou l’infundibulum pulmonaire.
Synchronisation à l’électrocardiographie (ECG)
Le cœur présente des mouvements cycliques (cycle cardiaque). Il est parfois nécessaire, selon le type d’imagerie et l’information que l’on veut obtenir, de tenir compte de ces mouvements lors de l’acquisition des images. Cela nécessite un enregistrement de l’ECG du patient en même temps que l’acquisition des images.
La synchronisation de la séquence d’acquisition se fait généralement avec l’onde R de l’ECG ; celle-ci constitue un bon indicateur de synchronisation car elle est brève et de bonne amplitude, ce qui facilite sa détection par des algorithmes de traitement du signal. Comme les phénomènes électriques du cœur précèdent les phénomènes mécaniques, l’onde R, qui signe le début de la systole électrique, précède la systole mécanique et correspond donc à la télédiastole (TD) mécanique.
Cette synchronisation à l’ECG peut être utilisée de deux manières : 1) en réalisant une acquisition à un moment donné du cycle cardiaque, généralement lorsque le VG est le moins mobile, en milieu de diastole (mésodiastole), afin d’obtenir une image « figée » du cœur. Il s’agit d’une synchronisation prospective, c’est-à-dire que les acquisitions des données sont déclenchées par la détection de l’onde R. Cette approche est choisie pour une exploration morphologique ou anatomique du cœur et des artères coronaires ; 2) en réalisant une acquisition tout au long du cycle cardiaque pour obtenir une série d’images consécutives dans le cycle cardiaque et afin de pouvoir produire des boucles d’images en mode « ciné ». Chaque intervalle R-R, correspondant à un cycle cardiaque, est divisé en segments de durée égale (généralement entre 8 et 32). Selon le type de technique d’imagerie, il peut être nécessaire d’associer les données de plusieurs cycles cardiaques (de quelques cycles en IRM jusqu’à plusieurs centaines en ventriculographie isotopique) afin d’obtenir suffisamment de signal pour représenter un seul cycle cardiaque (figure 26.2), à partir d’un cycle cardiaque moyenné à partir de plusieurs cycles acquis. Il s’agit d’une acquisition rétrospective, c’est-à-dire que les acquisitions des données sont simultanées avec celles de l’ECG et les images reconstruites ensuite en prenant en compte cette information. Cette approche est choisie pour une exploration fonctionnelle du cœur.
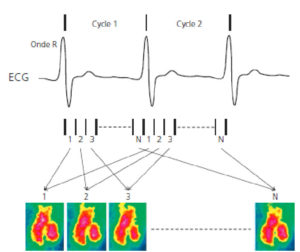
Concept d’acquisition synchronisée à l’ECG, exemple de la ventriculographie isotopique.
Une série de N images de durées égales est acquise au cours de chaque cycle cardiaque. Les premières images de chaque cycle sont associées entre elles pour obtenir une première image combinée, même chose pour les secondes images, etc. jusqu’à obtention d’une série d’images combinées représentant l’évolution du signal au cours d’un cycle.
L’analyse des images ainsi obtenues tout au long du cycle cardiaque permet d’évaluer la fonction ventriculaire gauche ou droite, en mesurant les volumes ventriculaires : volume télédiastolique (VTD) en fin de diastole, volume télésystolique (VTS) en fin de systole. La différence entre ces deux volumes, appelée volume d’éjection systolique (VES = VTD – VTS), correspond au volume sanguin éjecté par chaque ventricule à chaque contraction. Enfin, la fraction d’éjection ventriculaire (FEV) (%) est le rapport entre le volume d’éjection systolique et le volume télédiastolique (FEV = VES/VTD). La diminution de celle-ci (moins de 50 % pour le VG, moins de 45 % pour le ventricule droit [VD]) est un bon indice pour mesurer la dégradation de la fonction systolique ventriculaire dans les cardiopathies9.9..
D’autres paramètres fonctionnels sont également évaluables par l’imagerie, notamment la fonction diastolique, mais leur usage clinique est encore limité. C’est également sur ces images « ciné » que s’analyse la fonction contractile régionale, c’est-à-dire la contraction de chaque segment du cœur, en particulier du VG.
Elle s’apprécie essentiellement visuellement par l’épaississement de chaque segment :
- un segment se contractant normalement est normokinétique ;
- un segment dont la fonction est diminuée est hypokinétique ;
- un segment ne se contractant pas est akinétique ;
- un segment présentant une expansion en systole au lieu d’une contraction est dyskinétique.
De nouvelles modalités d’analyse automatisée de ces mouvements se développent afin de quantifier ce mouvement et cette déformation, ou analyse du strain.
Angiographie
Étymologiquement, l’angiographie est l’exploration des vaisseaux par imagerie. Sans précision, elle désigne les techniques radiographiques avec opacification directe des vaisseaux. Par extension, on parle également d’angiographie par TDM ou d’angiographie par IRM pour les explorations à visée vasculaire par ces techniques (ou plus simplement d’angio-TDM ou d’angio-IRM), voire en précisant les vaisseaux cibles (coroscanner, coro-IRM par exemple).
L’angiographie « classique » par rayons X concerne désormais quasi exclusivement les artères (artériographie), dont les artères du cœur (coronarographie) (figure 26.3A), et plus rarement les veines (phlébographie) ou les lymphatiques (lymphographie). Cet examen nécessite une ponction vasculaire, pour l’introduction d’un guide et d’un cathéter qui seront ensuite amenés sous contrôle radioscopique jusqu’au vaisseau à analyser (voir chapitres 15 et 21), ou le plus près possible de celui-ci ; il est alors procédé à l’acquisition des images concomitamment à une injection de produit de contraste iodé. Progressivement, l’angiographie par projection bidimensionnelle, qui requiert la réalisation de plusieurs incidences, est remplacée par des techniques d’acquisition tridimensionnelle. Cela reste néanmoins une analyse uniquement de la lumière du vaisseau, c’est-à-dire de l’intérieur, sans visualisation de sa paroi ; pour pallier cette limite, des techniques d’échographie endovasculaire et de mesures locales de pression se développent.
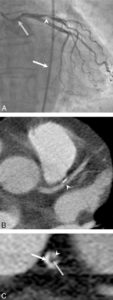
Exploration des coronaires par coronarographie et par coroscanner.
A. Coronarographie montrant un rétrécissement du calibre de l’artère interventriculaire antérieure proximale (tête de flèche). Cathéter dans l’aorte (flèche blanche) et extrémité (flèche grise) à l’ostium du tronc coronaire gauche pour une injection sélective du vaisseau. B. Coroscanner en coupe fine (< 1 mm) montrant la même sténose (tête de flèche) par une plaque d’athérome mixte (composante hypodense, thrombus, et composante hyperdense calcifiée). C. Coroscanner avec reconstruction perpendiculaire à l’axe du vaisseau montrant la lumière circulante, excentrique (tête de flèche), et la plaque d’athérome mixte (thrombus, flèche grise) et calcifiée (flèche blanche).
L’artériographie, en raison de son caractère invasif, est de moins en moins réalisée dans un but purement diagnostique, mais après un (des) examen(s) diagnostique(s) non invasif(s). Elle est utilisée dans un but thérapeutique : angioplastie, qui consiste à dilater un vaisseau, voire à y placer une endoprothèse (stent) pour le maintenir ouvert, ou embolisation pour stopper une hémorragie, par exemple. Cet aspect thérapeutique explique pourquoi l’artériographie reste l’examen de première intention dans certaines situations d’urgence, comme dans un tableau clinique et biologique de syndrome coronarien aigu (SCA).
Échographie et Doppler
L’échographie cardiaque transthoracique (figure 26.4) est l’examen d’imagerie de première intention dans les cardiopathies en raison de son innocuité, de sa disponibilité, et aussi grâce à son excellente résolution temporelle, particulièrement adaptée à l’exploration de cet organe ; en effet, l’échographie est une technique « temps réel », qui ne requiert donc pas le moyennage de données acquises sur plusieurs cycles cardiaques. Il est également possible de la réaliser lors d’un effort ou d’une épreuve de stress pharmacologique, pour analyser les modifications induites (recherche d’ischémie notamment, de modifications de gradients de pression dans certaines cardiomyopathies hypertrophiques).
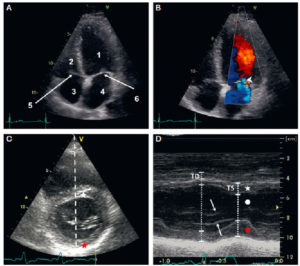
Échographie cardiaque par voie transthoracique.
A. Coupe apicale quatre cavités (grand axe horizontal) en niveaux de gris. 1. VG ; 2. VD ; 3. atrium droit ; 4. atrium gauche ; 5. valve tricuspide ; 6. valve mitrale. B. Même coupe, avec mode Doppler couleur, pour étudier les flux de remplissage ventriculaire et évaluer la sévérité d’une valvulopathie ; noter d’ailleurs ici une insuffisance mitrale physiologique (tête de flèche). C. Repérage, sur la coupe petit axe, de la ligne analysée en mode TM. D. Les segments permettent de mesurer la paroi septale (étoile blanche), la cavité ventriculaire gauche (rond blanc), et la paroi latérale (étoile rouge) en télédiastole (TD) et télésystole (TS), et ainsi de calculer une fraction de raccourcissement – diamètre de la cavité en TD-diamètre en TS)/diamètre en TD ; feuillets valvulaires mitraux (flèches).
La fenêtre acoustique (région de l’espace qui n’est pas masquée par les obstacles aux ultrasons), réduite par la présence des poumons, du sternum et des côtes, est la principale limite de cette technique ; cette limite est majorée chez les patients corpulents, ayant une déformation du thorax ou atteints de bronchopneumopathie chronique obstructive (BPCO).
Dans certains cas, l’échographie transthoracique est complétée par une échographie cardiaque transœsophagienne ; cette voie permet une meilleure appréciation des structures anatomiques proches de l’œsophage : atrium gauche, septum interatrial, valve mitrale, aorte descendante.
De nombreux paramètres fonctionnels peuvent être mesurés en échographie cardiaque, en utilisant différents modes : bidimensionnel, TM (temps-mouvement), Doppler.
En mode bidimensionnel, on analyse la morphologie du cœur, et on apprécie le fonctionnement des valves ainsi que la cinétique segmentaire et globale des ventricules ; la mesure des dimensions des cavités permet de calculer les volumes de celles-ci et la fraction d’éjection. Une autre façon d’apprécier la fonction systolique du VG est de calculer la fraction de raccourcissement entre télédiastole et télésystole de son diamètre interne (mode unidimensionnel TM). Le
Doppler est utilisé pour caractériser la sévérité des valvulopathies, fuyantes ou sténosantes.
De plus, de nouvelles approches d’acquisition et d’analyse se développent, permettant une description plus objective. On citera notamment l’échographie tridimensionnelle et des méthodes d’étude de la cinétique segmentaire (strain pariétal).
L’échographie est également un examen très utile en pathologie vasculaire (figure 26.5), notamment pour les vaisseaux superficiels (troncs supra-aortiques, vaisseaux des membres). En revanche, l’analyse des vaisseaux profonds et l’exploration « corps entier » sont limitées ; l’échographie est donc un examen de première intention, ou bien elle est réalisée pour préciser l’atteinte d’une zone localisée. Ses avantages cités précédemment en font par exemple un examen adapté au dépistage des anévrismes de l’aorte abdominale.
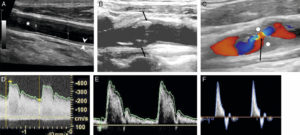
A. Échographie en niveaux de gris d’une artère carotide commune normale montrant la lumière normalement anéchogène (étoile blanche), la paroi (entre les deux têtes de flèche) avec la ligne hyperéchogène côté lumière correspondant à l’intima et la bande hypoéchogène à la média ; ici a été mesurée l’épaisseur intima-média, marqueur d’athérosclérose (valeur normale < 1 mm). B. Présence d’une plaque athéromateuse du bulbe carotidien avec une composante calcifiée (flèche blanche ; cône d’ombre acoustique postérieur) et une composante hypoéchogène (flèche grise). C. Sténose serrée d’une artère carotide interne par une plaque hypoéchogène (rond blanc) avec étude en Doppler couleur montrant un phénomène d’aliasing (flèche noire). D. Spectre Doppler correspondant avec mesure de la vitesse maximale à 4,1 m/s (sténose significative si > 2 m/s). E. Spectre Doppler normal d’une artère à faible résistivité, type carotide commune (vitesse maximale systolique autour de 1 m/s ici). F. Spectre Doppler normal d’une artère à haute résistivité, musculaire.
En mode bidimensionnel, le vaisseau se présente comme une structure à contenu anéchogène, avec une paroi fine hyperéchogène. Avec des sondes à très haute fréquence permettant une très bonne résolution spatiale, il est même possible de distinguer les différentes couches de la paroi artérielle de vaisseaux superficiels comme les carotides et de mesurer l’épaisseur intima-média, qui traduit une atteinte athéromateuse lorsqu’elle est augmentée. Les plaques d’athérome apparaissent, quant à elles, comme des épaississements focaux de la paroi ; selon leur composition, elles seront hypoéchogènes (plaques « molles » et thrombus), ou hyperéchogènes avec cône d’ombre acoustique postérieur en cas de calcifications (voir figure 26.5B, C). Les modes Doppler couleur et pulsé permettent de mesurer les vitesses circulatoires localement.
Les modes utilisés sont le bidimensionnel – pour une analyse morphologique d’un vaisseau, d’une sténose artérielle ou d’un anévrisme par exemple, de varices veineuses – et le Doppler, en mode couleur et/ou en mode pulsé – pour une analyse fonctionnelle avec par exemple la mesure de la vitesse de circulation au sein d’un vaisseau.
TDM
Les explorations de l’appareil cardiovasculaire par TDM nécessitent quasi systématiquement une injection intraveineuse de produit de contraste iodé. Pour une opacification satisfaisante, le débit d’injection doit être assez élevé (4 à 6 mL/s en général), et l’acquisition des images réalisée après un délai adapté au vaisseau à explorer (figures 26.6 et 26.7). Les acquisitions en contraste spontané (sans injection) sont rarement utiles en pathologie cardiovasculaire, en dehors des contextes d’urgence pour chercher du sang frais spontanément hyperdense – exemple du syndrome aortique aigu avec possiblement un hématome intramural de l’aorte, ou des accidents de la voie publique. Une exception est la mesure du « score calcique » qui permet de quantifier la charge calcique, c’est-à-dire la quantité de calcifications dans les parois des artères coronaires d’un patient, qui est un facteur pronostique du risque cardiovasculaire d’un sujet (voir figure 26.3B, C).
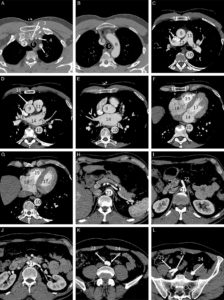
A-L. Anatomie normale en angio-TDM thoraco-abdominale (coupes axiales) au temps artériel.
1. Veine brachiocéphalique gauche ; 2. Veine brachiocéphalique droite ; 3. tronc artériel brachiocéphalique ; 4. artère carotide commune gauche ; 5. artère subclavière gauche ; 6. trachée ; 7. veine cave supérieure ; 8. crosse de l’aorte ; 9. aorte ascendante (segment 1) ; 10. aorte thoracique descendante (segment 3) ; 11. tronc de l’artère pulmonaire ; 12. branche droite de l’artère pulmonaire ; 13. branche gauche de l’artère pulmonaire ; 14. atrium gauche ; 15. auricule gauche ; 16. veines pulmonaires ; 17. ventricule gauche ; 18. atrium droit ; 19. ventricule droit ; 20. sinus coronaire ; 21. aorte abdominale ; 22. artère mésentérique supérieure ; 23. artère iliaque commune droite ; 24. artère iliaque commune gauche ; 25. artère iliaque externe droite ; 26. artère iliaque interne droite.
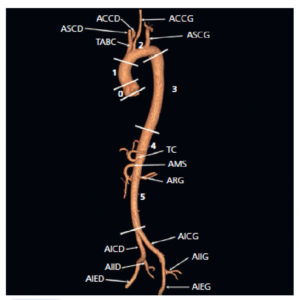
Aorte normale en angio-TDM au temps artériel avec reconstruction tridimensionnelle de type rendu volumique.
Segment 0 : racine de l’aorte, de l’anneau à la jonction sinotubulaire ; segment 1 : aorte ascendante ; segment 2 : crosse de l’aorte ou arc aortique ; segment 3 : aorte thoracique descendante ; segment 4 : aorte abdominale suprarénale ; segment 5 : aorte abdominale intrarénale. ACCD : artère carotide commune droite ; ACCG : artère carotide commune gauche ; AICD : artère iliaque commune droite ; AICG : artère iliaque commune gauche ; AIED : artère iliaque externe droite ; AIEG : artère iliaque externe gauche ; AIID : artère iliaque interne droite ; AIIG : artère iliaque interne gauche ; AMS : artère mésentérique supérieure ; ARG : artère rénale gauche (sous cette incidence, l’artère rénale droite n’est pas visible) ; ASCD : artère subclavière droite ; ASCG : artère subclavière gauche ; TABC : tronc artériel brachiocéphalique ; TC : tronc cœliaque.
Pour les explorations cardiaques, et également de l’aorte ascendante, il faut recourir à la synchronisation à l’ECG. L’acquisition est alors réalisée en systole pour l’anneau aortique, par exemple avant remplacement valvulaire (transcatheter aortic valve implantation [TAVI]), en diastole pour l’exploration des autres segments de l’aorte thoracique, l’imagerie des coronaires notamment, ou sur tout le cycle cardiaque pour l’analyse des valves par exemple. L’acquisition reste relativement longue par rapport au cycle cardiaque et donc au déplacement des artères coronaires, et la résolution spatiale est actuellement limitée pour les vaisseaux de moins de 1 mm. Aussi, cet examen peut requérir une préparation du patient pour réduire ou simplement stabiliser sa fréquence cardiaque (utilisation de bêta-bloquants) et dilater ses vaisseaux (dérivés nitrés par voie sublinguale par exemple).
L’analyse des images sur une console de post-traitement adaptée est une étape cruciale de l’examen. En particulier, pour mesurer correctement le calibre d’un vaisseau, il est impératif de procéder à une reconstruction de l’image perpendiculairement à son axe.
Parmi les techniques d’imagerie en coupes, la TDM est l’examen de référence pour l’exploration non invasive des vaisseaux de gros (voir figure 26.7) et moyen calibres (y compris les coronaires) (voir figure 26.3).
En pathologie cardiovasculaire, les principaux examens scanographiques sont :
- l’angio-TDM pulmonaire (suspicion d’embolie pulmonaire, ou de bilan malformatif) ;
- l’angio-TDM de l’aorte (recherche et suivi d’anévrisme, de coarctation, de dissection) ;
- l’angio-TDM des artères coronaires (diagnostic non invasif de la maladie coronaire).
Techniques scintigraphiques
Comme toutes les techniques de médecine nucléaire, les techniques scintigraphiques dédiées aux explorations cardiaques nécessitent l’administration d’un
MRP, dont les propriétés biologiques détermineront l’information qui sera obtenue sur les images. Comme la plupart des MRP, leur administration est contre-indiquée chez la femme enceinte.
Ventriculographie isotopique
La ventriculographie isotopique consiste en l’administration d’un MRP se distribuant uniquement mais de manière homogène dans l’espace vasculaire. On utilise généralement des globules rouges autologues marqués au 99mTc.
L’étude des variations temporelles de la radioactivité du sang contenu dans les cavités cardiaques permet d’obtenir des informations qualitatives et quantitatives sur la fonction ventriculaire gauche et droite, et surtout de manière fiable et reproductible la mesure des FEV.
Les images peuvent être acquises en mode bidimensionnel, en position oblique antérieure gauche afin d’être perpendiculaire à l’axe du septum interventriculaire et ainsi de bien séparer les deux ventricules (figure 26.8), ou en mode tomographique (tridimensionnel). La synchronisation à l’ECG permet d’obtenir une série d’images (16 voire 32) tout au long du cycle cardiaque.
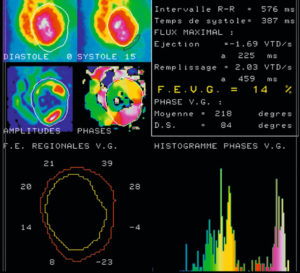
Ventriculographie isotopique.
Traceurs de la perfusion myocardique
Pour évaluer la perfusion myocardique, les MRP les plus utilisés sont des cations lipophiles marqués au 99mTc, le sestamibi et la tétrofosmine. Ils traversent la membrane cellulaire passivement dans le sens du gradient de potentiel électrique transmembranaire et vont s’accumuler préférentiellement dans les cardiomyocytes proportionnellement aux débits coronaires locaux. Cette captation est rapide, dès la première minute suivant l’injection.
Tous ces traceurs sont émetteurs monophotoniques et les images sont donc obtenues en scintigraphie conventionnelle, les acquisitions étant réalisées en mode tomographique, avec orientation des coupes selon les trois plans principaux du cœur.
Il est généralement réalisé une synchronisation à l’ECG pour améliorer la qualité de l’image et obtenir des informations fonctionnelles du VG (évaluation de la FEVG et de la contractilité des différentes parois du VG).
Le 201Tl, un cation monovalent dont le comportement est proche de celui du potassium, est plus irradiant et donc moins utilisé.
D’autres MRP aux caractéristiques biologiques proches ont également été développés pour la TEP (en particulier le rubidium-82 et le 18F-Flurpiridaz) avec un avantage en termes de qualité d’image, mais ces MRP ne sont pas encore employés en routine en France.
Autres traceurs
Le métabolisme glucidique du myocarde peut être exploré grâce au 18F-FDG, traceur TEP largement disponible. Dans ce cas, les territoires myocardiques non viables ne présenteront pas de fixation du 18F-FDG, tandis qu’au contraire les territoires ischémiques présenteront une hyperfixation relative, la glycolyse anaérobie étant dans ce cas la source d’énergie privilégiée du fait du manque d’O2.
Le 18F-FDG peut également être utile pour la détection de foyers infectieux cardiaques (endocardite infectieuse) ou vasculaires (anévrisme mycotique) ou encore pour le diagnostic de certaines pathologies inflammatoires pouvant atteindre le myocarde (sarcoïdose).
La scintigraphie à la MIBG marquée à l’123I (123I-MIBG), un analogue de la noradrénaline, permet d’évaluer et de quantifier l’innervation sympathique du myocarde, qui est altérée dans de nombreuses affections cardiaques, mais la place de cet examen en routine clinique reste encore à préciser.
IRM
Pour les explorations du cœur et des gros vaisseaux en IRM, la synchronisation à l’ECG est indispensable, et il est nécessaire également de tenir compte des mouvements respiratoires (réaliser une synchronisation aux mouvements respiratoires ou bien, le plus souvent, procéder à l’acquisition des images en apnée).
Cette synchronisation est généralement combinée avec des séquences d’acquisition très rapides ; de nombreuses sont disponibles qui permettent une exploration très complète du cœur et des gros vaisseaux.
Séquences ciné
La cinétique cardiaque peut être explorée avec une assez grande précision en IRM, en répétant l’acquisition du même plan de coupe à différents moments du cycle cardiaque. Les séquences utilisées sont des séquences d’écho de gradient segmentées rapides présentant un contraste très particulier avec une pondération T2/T1 (figure 26.9). Cette pondération se révèle intéressante en imagerie cardiaque car elle montre un fort contraste entre le myocarde (hyposignal) d’une part, et les espaces liquidiens et la graisse (hypersignal) d’autre part, de sorte que les contours endocardiques et épicardiques des ventricules sont nets.
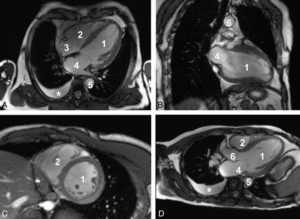
Séquences ciné-IRM dans les plans grand axe horizontal (A), grand axe vertical (B), petit axe (C) et un plan passant par la chambre de chasse du VG (D).
1. VG ; 2. VD ; 3. atrium droit ; 4. atrium gauche ; 5. aorte descendante ; 6. aorte ascendante. À noter qu’il existe un épanchement pleural droit liquidien, apparaissant en hypersignal sur ces images pondérées en T2/T1 (astérisque).
Ces séquences sont à la base des mesures fonctionnelles des VG et VD. L’excellente résolution spatiale et la bonne résolution temporelle de ces séquences, l’absence de zone muette font de l’IRM une technique de référence pour la mesure de la fraction d’éjection des deux ventricules, de la masse myocardique et des volumes télédiastolique et télésystolique. La masse et les volumes sont généralement indexés à la surface corporelle du patient.
Séquences d’imagerie morphologique « sang noir »
L’IRM permet également de caractériser les composantes tissulaires autour ou au sein du myocarde et des parois des gros vaisseaux. On utilise pour cela des séquences morphologiques dérivées de l’écho de spin, pondérées en T1 ou T2, pour lesquelles le signal du sang circulant apparaît en noir (figure 26.10).
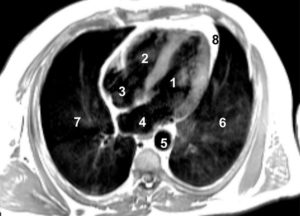
Séquence d’IRM morphologique « sang noir » pondérée en T1, dans le plan grand axe horizontal.
Le myocarde apparaît en isosignal, la graisse en hypersignal. Le sang circulant ayant quitté le plan de coupe entre l’impulsion préparatoire de 90° et l’impulsion refocalisatrice de 180°, les cavités cardiaques apparaissent en noir (vide de signal). 1. VG ; 2. VD ; 3. atrium droit ; 4. atrium gauche ; 5. aorte descendante ; 6. poumon gauche ; 7. poumon droit ; 8. graisse péricardique.
Les acquisitions sont réalisées lorsque le myocarde a un mouvement minimal, c’est-à-dire durant la mésodiastole ventriculaire.
Séquences d’imagerie de phase (cartographie des flux)
La cartographie des flux est possible avec l’IRM tout comme avec le Doppler en échographie. En contraste de phase, le signal mesuré est proportionnel à la vitesse des protons qui traversent le plan de coupe. Quand on pondère cette mesure par la surface de la zone d’intérêt (coupe du vaisseau selon son petit axe), on peut obtenir une mesure des débits (antéro- et rétrograde). Le contraste de phase permet donc une approche quantitative des flux vasculaires ou valvulaires. Le codage tridimensionnel des flux permet de visualiser ceux-ci au sein des gros vaisseaux et d’analyser les shunts, les fuites et les turbulences (technique dite « de flux 4D ») (figure 26.11).

Imagerie de cartographie des flux dans un plan axial passant par l’aorte ascendante (en blanc) et l’aorte descendante (en noir).
Le niveau de gris de chaque point représente une vitesse et une direction (blanc et noir correspondent aux vitesses maximales, gris correspond à une vitesse nulle). 1. Aorte ascendante ; 2. aorte descendante ; 3. artère pulmonaire ; 4. poumon gauche ; 5. poumon droit.
Séquences de perfusion et de rehaussement tardif
L’imagerie de la perfusion myocardique en IRM repose essentiellement sur l’utilisation de séquences rapides fortement pondérées en T1, associées à l’injection d’un produit de contraste à base de gadolinium qui augmente le contraste T1 dans son volume de distribution.
Dans des conditions normales, le signal du myocarde augmente rapidement au moment du passage du produit de contraste dans la circulation coronaire, puis dans le milieu extravasculaire du myocarde, pour ensuite diminuer progressivement au fur et à mesure que le produit de contraste quitte le secteur extravasculaire pour retourner dans le secteur vasculaire et être progressivement éliminé par voie rénale. Cependant, une altération locale de la perfusion se traduit par un rehaussement moindre et/ou un retard dans ce territoire lors de la phase initiale (figure 26.12). Cette analyse de la perfusion myocardique est notamment utilisée avec des agents pharmacologiques vasodilatateurs pour diagnostiquer une ischémie myocardique.
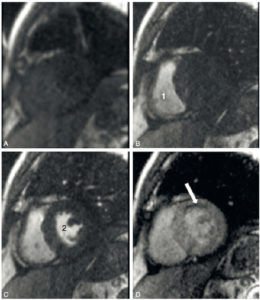
Images IRM successives d’un même plan de coupe petit axe au cours du premier passage d’un agent de contraste à base de gadolinium (séquence turbo FLASH précédée d’une impulsion saturation-récupération).
A. Avant le passage de l’agent de contraste. Les seules zones en hypersignal (blanc) correspondent à la graisse sur cette séquence fortement pondérée en T1. B. Arrivée de l’agent de contraste dans la cavité ventriculaire droite (1). C. Passage de l’agent de contraste dans la cavité ventriculaire gauche (2). D. Passage de l’agent de contraste dans le myocarde dont le signal augmente, sauf dans la région antérieure (flèche). L’hyposignal correspond à un déficit de perfusion du myocarde.
Plus tardivement, dans les minutes qui suivent l’injection, certaines régions du myocarde peuvent présenter un ralentissement de la phase d’évacuation du produit de contraste, voire une stagnation, et donc un hypersignal T1 par rapport au myocarde normal (figure 26.13). Ces mécanismes d’accumulation sont probablement liés à l’altération de la membrane capillaire, à l’augmentation du volume du liquide interstitiel, voire à la rupture des membranes cellulaires, qui augmente le volume de distribution du produit de contraste. Cela concerne donc toutes les situations pathologiques qui entraînent une destruction des cardiomyocytes (nécrose), une augmentation du volume interstitiel (maladies infiltratives de type amylose) et/ou la présence d’œdème (maladies inflammatoires de type myocardite).
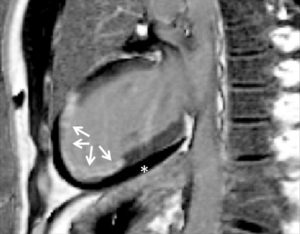
Séquence IRM de rehaussement tardif, 10 minutes après injection d’un agent de contraste à base de gadolinium.
Orientation grand axe vertical. On observe un hypersignal dans le tiers distal du VG, transmural, correspondant à une rétention du traceur du fait d’une large séquelle d’infarctus myocardique (flèches). Il existe également un épanchement péricardique liquidien, apparaissant en noir sur cette séquence fortement pondérée en T1 (astérisque).
Il est donc possible de réaliser des acquisitions dynamiques précoces, immédiatement après injection, permettant d’évaluer la perfusion myocardique (voir figure 26.12), et des acquisitions plus tardives (généralement 5 à 10 minutes après injection), appelées de « rehaussement tardif » pour dépister des anomalies structurelles du myocarde (voir figure 26.13).
Séquences de caractérisation tissulaire : T1 et T2 mapping
Toujours pour la caractérisation des anomalies structurelles myocardiques, ont été développées récemment des séquences produisant des images paramétriques fondées sur les temps de relaxation (T1, T2, T2⁎), appelées par exemple T1 mapping ou cartographie T1. De nombreux processus pathologiques peuvent entraîner des modifications des temps de relaxation : la présence d’œdème ou de fibrose entraîne une augmentation du T1 et du T2, tandis que l’infiltration lipidique ou la surcharge en fer entraînent leur diminution. Ces processus affectent également le volume extracellulaire myocardique, qui peut être calculé en comparant les valeurs de T1 avant et après injection d’un produit de contraste à base de gadolinium. Ces séquences complètent et précisent ainsi l’analyse tissulaire myocardique par IRM.
Angiographie par résonance magnétique (ARM)
Les séquences d’ARM peuvent utiliser un produit de contraste (chélate de gadolinium) ou le signal spontané du sang (séquence sang blanc). Dans le premier cas, on réalise une acquisition 3D millimétrique ou submillimétrique centrée sur le passage artériel du produit de contraste. Cette technique est excellente pour les vaisseaux peu mobiles, plus délicate pour les segments mobiles comme l’aorte ascendante qui produisent des artefacts de mouvement. La technique sang blanc sans injection est de plus en plus utilisée ; elle permet une acquisition en mode ciné et des mesures très précises en systole ou en diastole.
Compte tenu de ses capacités, l’IRM est devenue un examen de référence pour l’analyse des maladies du myocarde, des atteintes péricardiques et des cardiopathies congénitales opérées.
Grands syndromes et leurs moyens d’exploration
Pathologie des vaisseaux
Sténose artérielle
Une sténose, synonyme de rétrécissement localisé, est une diminution permanente du calibre d’un conduit anatomique, comme un vaisseau ou une valve cardiaque ; cela exclut donc les diminutions transitoires comme dans un spasme artériel. La cause principale des sténoses artérielles est l’athérosclérose.
L’imagerie (échographie et/ou TDM) permet de caractériser les sténoses en mesurant le degré de sténose (voir figure 26.3), souvent exprimé en pourcentage d’un calibre de référence (diamètre du vaisseau ou surface), et leur longueur. Une sténose d’au moins 70 % en diamètre est généralement à l’origine d’une diminution du débit d’aval, et est un seuil opératoire dans les sténoses de l’artère carotide interne par exemple, y compris chez les patients asymptomatiques.
Une autre approche est fondée sur les modifications hémodynamiques induites par la sténose, avec une accélération du flux sanguin à la zone de sténose maximale, mesurable en échographie-Doppler (voir figure 26.5).
Le degré ultime de sténose est la thrombose, ou occlusion de la lumière vasculaire, qui peut se constituer progressivement ou survenir brutalement en raison d’une rupture de plaque.
Un thrombus est un caillot sanguin qui se forme dans le cœur ou dans un vaisseau (figure 26.14) ; il peut ne pas être obstructif. Un des risques principaux de ces thrombus est leur migration dans la circulation sanguine, avec occlusion d’un vaisseau en aval ; on parle alors d’embolie – par exemple, un AVC ischémique secondaire à l’embolie d’un thrombus auriculaire gauche, classique dans la fibrillation atriale et justifiant le traitement anticoagulant au long cours. À noter que l’on parle également d’embolie avec d’autres « corps étrangers » migrés : embolie graisseuse, embolie gazeuse, embolie de cristaux de cholestérol, embolie de tout ou partie d’une tumeur, etc.
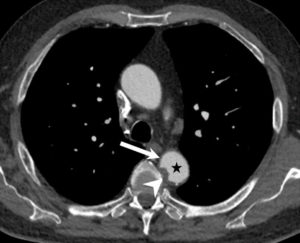
Angio-TDM aortique dans le plan axial.
Dans la lumière circulante de l’aorte thoracique descendante (étoile), il existe une hypodensité correspondant à un thrombus (tête de flèche). Noter également la paroi aortique (flèche) visible sur cet examen, modérément épaissie.
Anévrisme
Un anévrisme (figure 26.15) se définit comme une augmentation localisée et permanente du calibre d’un vaisseau d’au moins 50 %, ce qui engendre une perte de parallélisme des bords. Il est exploré en TDM. Il se distingue des méga-artères dont le calibre est augmenté de façon généralisée.
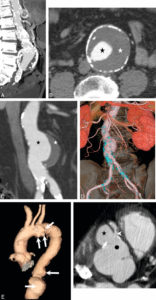
Anévrismes.
A. Reconstruction en MIP épaisse en sagittal oblique d’une angio-TDM de l’aorte abdominale, montrant un anévrisme fusiforme de celle-ci. Noter les calcifications pariétales diffuses (athérome), la lumière et le thrombus. B. Coupe axiale du même patient, à environ mi-hauteur de cet anévrisme ; lumière circulante (étoile noire) et thrombus (étoile blanche). C, D. Anévrisme sacciforme de l’aorte abdominale en angioTDM en reformation (C) et rendu volumique 3D (D). Noter le développement unilatéral à gauche de cet anévrisme (étoile noire : lumière circulante ; étoile blanche : thrombus). E. Rendu volumique 3D d’un angioTDM de l’aorte chez un patient présentant de multiples anévrismes sacciformes (flèches blanches). F. Coupe axiale au niveau de la racine de l’aorte montrant un de ces anévrismes (étoile noire) développé aux dépens du sinus antérieur droit (rond noir), et situé à côté de l’ostium de la coronaire droite (tête de flèche).
Un anévrisme se caractérise par : sa localisation (vaisseau et partie du vaisseau atteints), sa forme (sacciforme, en sac, ou fusiforme, en fuseau), son diamètre maximal et sa longueur.
La zone de communication entre la lumière vasculaire normale et l’anévrisme s’appelle le collet ; il y en a un seul en cas d’anévrisme sacciforme et deux en cas de fusiforme.
Les anévrismes peuvent être uniques ou multiples, et toucher les vaisseaux de tout calibre ainsi que les cavités cardiaques, mais concernent principalement les artères. Il est important de considérer l’état du vaisseau atteint, ainsi que celui des autres vaisseaux, pour guider la prise en charge thérapeutique.
Il existe également des faux anévrismes (ou pseudo-anévrismes) qui se distinguent des anévrismes car leur paroi est constituée par un autre tissu que celui de la paroi artérielle (par exemple par du péricarde en cas de rupture ventriculaire gauche après un infarctus du myocarde).
Dissection
Une dissection (figure 26.16) est un clivage dans la paroi artérielle (entre l’intima et la média), avec création d’un hématome, spontanément hyperdense en TDM, voire d’un faux chenal qui peut être circulant ou thrombosé. Elle peut survenir sur toutes les artères, mais le cas le plus emblématique est la dissection de l’aorte. La classification de Stanford distingue les dissections de l’aorte de type A lorsque l’aorte ascendante est atteinte, et celles de type B lorsque l’atteinte débute au-delà de l’artère subclavière gauche. La dissection aortique est une urgence diagnostique, et s’intègre dans le syndrome aortique aigu avec l’hématome intramural de l’aorte et l’ulcère athéromateux pénétrant. Une dissection de type A, avec atteinte de l’aorte ascendante donc, est aussi une urgence chirurgicale (risque de rupture et de tamponnade).
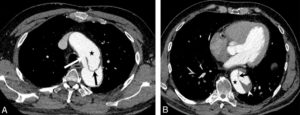
Dissection.
Coupes axiales d’angio-TDM au temps artériel passant par la crosse aortique (A) et l’aorte thoracique descendante distale (B). Brèche intimale (flèche blanche) située ici au niveau de la crosse aortique, au pied de l’artère subclavière gauche (dissection de type B selon Stanford), se présentant comme une discontinuité dans la paroi aortique ; il peut exister une ou plusieurs réentrées, qui se présentent de la même façon et situées plus en distalité sur l’aorte ou ses collatérales. Existence d’un vrai chenal (étoiles noires) et d’un faux, séparés par le flap intimal (flèches noires et blanche) ; noter le thrombus (tête de flèche blanche) qui obstrue partiellement la lumière du faux chenal de l’aorte thoracique descendante distale dans ce cas.
Dans un contexte d’urgence, pour l’étude de l’aorte et des gros vaisseaux, l’examen de première intention est la TDM en raison de sa disponibilité, de sa rapidité de réalisation, de la couverture corps entier possible et de sa résolution spatiale. Elle permet de visualiser le voile intimal, la porte d’entrée et celles de réentrée, l’état du faux chenal (perméable ou thrombosé), l’extension aux collatérales, les signes de rupture et les éventuels retentissements parenchymateux (ischémie).
En cas d’instabilité hémodynamique majeure, une échocardiographie transthoracique, voire transœsophagienne, permet souvent de confirmer ou d’infirmer le diagnostic de dissection de type A, sans toutefois permettre un bilan d’extension et de retentissement aussi exhaustif.
Pour le suivi des atteintes connues (anévrisme, dissection au stade chronique), l’IRM peut être choisie en raison de l’absence d’exposition du patient aux radiations ionisantes ; le choix peut également s’orienter vers la TDM, pour la reproductibilité des mesures et une couverture anatomique plus large actuellement (des troncs supra-aortiques aux iliaques en quelques secondes par exemple).
Thrombose veineuse profonde
La thrombose veineuse profonde des membres inférieurs (phlébite) est explorée en échographie en première intention. Les signes directs sont l’absence de flux en Doppler et la visibilité d’un caillot complètement ou partiellement occlusif dans la lumière du vaisseau. Les signes indirects sont l’absence de compressibilité de la veine sous la sonde et la présence de voies de suppléance.
Une embolie pulmonaire est une complication classique d’une thrombose veineuse profonde des membres inférieurs et est explorée préférentiellement en angio-TDM (en scintigraphie plus rarement) (voir chapitre 25).
Pathologies des coronaires : ischémie myocardique et infarctus
Rappels physiopathologiques
L’ischémie myocardique est liée à une inadéquation entre besoins et apports en oxygène au myocarde. Elle est généralement provoquée par une diminution de la perfusion myocardique, secondaire à une occlusion partielle ou totale d’une artère coronaire ou d’une de ses branches.
Si cette ischémie se prolonge, elle évoluera soit vers une ischémie chronique (on parle d’hibernation myocardique), soit vers une nécrose cellulaire, irréversible.
Le myocarde ischémique présente une dysfonction contractile, qui est généralement réversible si le débit sanguin est restauré, après un passage par une phase de sidération myocardique (dysfonction contractile transitoire malgré la restauration de la perfusion). On parle de myocarde viable. En revanche, en cas de nécrose, la dysfonction contractile est irréversible (tableau 26.1).
Tableau 26.1 – Tableau comparatif des caractéristiques des différents états du myocarde
|
Perfusion |
Fonction contractile |
Métabolisme glucidique |
Viabilité |
|
|
Myocarde normal |
Normale |
Normale |
Normal |
Oui |
|
Ischémie |
Diminuée |
Altérée |
Augmenté |
Oui |
|
Nécrose |
Diminuée ou stoppée |
Altérée |
Stoppé |
Non |
|
Hibernation (ischémie chronique) |
Diminuée |
Altérée |
Augmenté |
Oui |
|
Sidération |
Normalisée |
Altérée |
Normal ou augmenté |
Oui |
La vascularisation coronaire présente plusieurs caractéristiques qui sont importantes à rappeler pour comprendre la physiopathologie de l’ischémie myocardique :
- dans des conditions normales, le réseau coronaire est terminal, c’est-à-dire qu’en situation normale il n’y a pas de suppléance entre les territoires coronaires ;
- la distribution du flux coronaire dans l’épaisseur du muscle cardiaque n’est pas homogène : les artères coronaires et leurs branches cheminent à la surface épicardique du muscle cardiaque et donnent naissance à des artères perforantes qui pénètrent dans l’épaisseur du myocarde et qui sont, elles, terminales. Le myocarde sous-endocardique est donc moins bien perfusé que le myocarde sous-épicardique, et est plus sensible à l’ischémie. Ainsi, la nécrose cellulaire résultant de l’infarctus apparaît au niveau de l’endocarde pour s’étendre progressivement en front de vague vers l’épicarde ;
- dans des conditions normales, le débit sanguin coronaire peut s’adapter de manière quasi linéaire aux besoins en oxygène et nutriments du myocarde et, ainsi, lors d’un effort important, être multiplié par un facteur 3 à 5 par rapport au repos. Cette adaptation se fait essentiellement grâce aux capacités vasomotrices des artérioles (propriété de se dilater ou de se contracter et ainsi de moduler leur rayon). Le rapport entre le débit coronaire au repos et à l’effort est appelé « réserve de débit coronaire », ou « réserve coronaire ».
L’atteinte des artères coronaires est le plus souvent la conséquence de l’athérosclérose, avec constitution de plaques d’athérome dans les parois des artères.
Ces plaques évoluent de deux manières :
- soit elles se développent lentement et entraînent une sténose d’aggravation progressive de la lumière coronaire. Cette sténose est dans un premier temps compensée par une vasodilatation des artérioles coronaires en aval, voire la constitution d’un réseau collatéral d’importance variable. Ce type de lésion entraîne alors une ischémie qui n’apparaît initialement qu’à l’effort, du fait de la diminution de la réserve coronaire. L’expression clinique est un angor stable d’effort. Lorsque la sténose devient trop importante, l’ischémie survient même au repos ; l’expression clinique évoluera vers un angor de repos ;
- soit elles se fracturent ou se fissurent, ce qui entraîne la formation d’un thrombus intracoronaire au contact, une réduction brutale du diamètre artériel, voire une occlusion complète aboutissant à une ischémie ou une nécrose. L’expression clinique est la survenue d’un syndrome coronarien aigu (SCA) : angor instable ou infarctus du myocarde. La nécrose résultant de l’infarctus apparaît au niveau de l’endocarde pour s’étendre progressivement vers l’épicarde. La plaque d’athérome instable est donc plus à risque qu’une simple sténose progressive.
Indications de l’imagerie
Les examens complémentaires viennent en complément de l’analyse clinique, qui doit toujours se situer en amont de leur prescription.
Le choix des examens complémentaires d’imagerie varie donc en fonction de la situation et de la question posée. De manière schématique, il peut s’agir de détecter une pathologie des coronaires (et d’en apprécier l’importance), d’évaluer la présence de viabilité myocardique (généralement chez un patient coronarien connu) ou, enfin, de réaliser un diagnostic différentiel.
Test d’ischémie et imagerie des coronaires
Il existe deux approches possibles, qui peuvent être complémentaires : la réalisation d’un test d’ischémie couplé à une imagerie (échographie, IRM ou scintigraphie), ou l’imagerie des coronaires pour détecter directement une lésion coronarienne.
Test d’ischémie couplé à l’imagerie
Trois techniques d’imagerie peuvent être utilisées : l’échographie, l’IRM et la scintigraphie myocardique, permettant d’évaluer la contractilité et/ou la perfusion myocardique (tableau 26.2). Ces examens sont très fréquemment utilisés pour confirmer ou non le diagnostic de maladie coronaire, pour établir un pronostic de cette maladie et pour orienter les indications thérapeutiques.
Tableau 26.2 – Tableau comparatif des performances des différentes techniques d’imagerie couplées à un test d’ischémie
|
Paramètre myocardique explorable |
Test d’ischémie associé |
|||
|
Contractilité |
Perfusion |
Viabilité |
||
|
IRM |
++ |
++ |
+++ |
Vasodilatateur, dobutamine |
|
Scintigraphie au 201Tl |
+ |
++ |
++ |
Épreuve d’effort, vasodilatateur, dobutamine |
|
Scintigraphie au 99mTc-MIBI |
+ |
++ |
– |
Épreuve d’effort, vasodilatateur, dobutamine |
|
Échographie |
++ |
– |
– |
Épreuve d’effort, dobutamine |
Ces examens sont réalisés non seulement au repos, mais également au cours d’un test d’ischémie, dont l’objectif est de reproduire ou simuler les conditions d’un stress myocardique. Cela permet ainsi de comparer la contractilité et/ou la perfusion myocardique au repos et au cours d’un stress.
Les principales anomalies recherchées sont donc :
- l’existence de zones d’ischémie ou de nécrose myocardique et leur étendue (pourcentage de myocarde concerné) ;
- les paramètres de fonction ventriculaire gauche segmentaire et globale, notamment la FEVG et les volumes ventriculaires gauches.
L’absence d’anomalie (de contraction ou de perfusion) en post-stress comme au repos est en faveur de l’absence d’ischémie ou de nécrose.
La présence d’une anomalie uniquement après stress, réversible au repos, est en faveur d’une ischémie (figure 26.17).
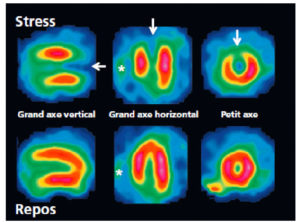
Scintigraphie myocardique au 99mTc-MIBI : ischémie.
L’injection du traceur et l’acquisition des images sont réalisées au décours d’un effort (stress) et quelques heures plus tard au repos, après réinjection. On constate une absence de perfusion dans le territoire apical et antérieur distal en post-stress (flèches), qui se rétablit au repos. Il s’agit d’un aspect d’ischémie myocardique dans ce territoire. À noter que le myocarde du VD (astérisque) n’est pas explorable en scintigraphie myocardique, sa perfusion étant beaucoup plus faible que celle du myocarde du VG et sa paroi beaucoup plus mince.
La présence d’anomalies en post-stress et non réversibles au repos est en faveur d’une nécrose ou d’une ischémie chronique (hibernation), sans pouvoir toujours faire la distinction entre les deux (figure 26.18).
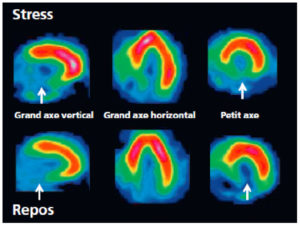
Scintigraphie myocardique au 99mTc-MIBI : nécrose.
L’injection du traceur et l’acquisition des images sont réalisées au décours d’un effort (stress) et quelques heures plus tard au repos, après réinjection. On constate une absence de perfusion dans le territoire inférieur en post-stress (flèches), non réversible au repos. Il s’agit d’un aspect évocateur de nécrose myocardique dans ce territoire. Cependant, une ischémie « chronique » non réversible au repos (hibernation) ne peut pas être exclue.
En pratique, aucune de ces techniques n’est clairement supérieure aux autres. Le choix se fait en fonction de la situation. L’échographie et la scintigraphie ont l’avantage de pouvoir être couplées à une épreuve d’effort, contrairement à l’IRM (il est effectivement difficile de faire réaliser un effort au patient lorsqu’il est confiné dans l’aimant). En revanche, l’IRM est une technique très complète permettant d’obtenir des informations fonctionnelles (contractilité, perfusion), mais également anatomiques et structurelles (voir tableau 26.2).
Il existe trois types de test d’ischémie, qui sont tous réalisés sous la responsabilité d’un cardiologue et couplés à un enregistrement de l’ECG en continu :
- l’épreuve d’effort, qui est la technique qui se rapproche le plus des conditions physiologiques ; elle permet à elle seule d’apporter des éléments diagnostiques en faveur d’une atteinte ischémique. L’effort entraîne des effets inotropes et chronotropes positifs, qui augmentent les besoins du myocarde et, en conséquence, la perfusion partout où c’est possible. En aval d’une sténose, les capacités vasodilatatrices sont déjà mobilisées et une ischémie apparaît. L’épreuve d’effort doit être dans la mesure du possible « maximale », c’est-à-dire conduire à une augmentation de la fréquence cardiaque jusqu’à obtention de la fréquence maximale théorique (FMT) qui est égale à 220 moins l’âge du patient ;
- perfusion de dobutamine à dose croissante dont les effets chronotrope et inotrope stimulent les conditions d’un effort ;
- l’injection d’un vasodilatateur coronaire (dipyridamole ou régadénoson), qui va augmenter le débit de perfusion en aval des coronaires saines, alors qu’en aval d’une sténose, les artérioles sont déjà dilatées pour compenser la diminution du débit coronaire. Le vasodilatateur ne pourra donc pas augmenter autant la perfusion que dans les autres territoires, d’où la visualisation d’une diminution relative de la perfusion myocardique en aval d’une sténose hémodynamiquement significative.
Imagerie des coronaires : TDM et coronarographie
Il s’agit dans ce cas de mettre en évidence directement une éventuelle sténose ou occlusion sur le réseau coronaire soit de manière non invasive (TDM), soit de manière invasive (coronarographie).
La TDM des coronaires (coro-TDM ou « coroscanner ») est un examen qui bénéficie d’une excellente valeur prédictive négative, c’est-à-dire qu’un examen normal permet d’éliminer avec une quasi-certitude la présence d’une lésion. Elle permet de préciser l’anatomie, notamment en cas d’anomalie de connexion (« de naissance ») ou de trajet des artères coronaires, de localiser et de quantifier de manière non invasive d’éventuelles lésions coronariennes sténosantes. Une de ses limites principales reste la résolution spatiale, en particulier en cas de calcifications coronaires ou de stent, avec une quantification alors souvent imprécise de la lumière. Mais les progrès technologiques repoussent régulièrement cette limite.
La coronarographie n’est réalisée en première intention que dans un contexte d’urgence (tableau de syndrome coronarien aigu), sinon pour confirmer les résultats d’un examen non invasif. Elle permet surtout de réaliser, si c’est possible, un traitement endoluminal (angioplastie) de la ou des lésions.
Une autre limite de cette approche morphologique est que l’on ne connaît pas l’impact fonctionnel réel d’une lésion : certaines sténoses en apparence importantes n’auront que peu d’impact du fait d’un bon réseau collatéral ; d’autres sténoses plus modérées auront au contraire un impact significatif, avec apparition d’une ischémie d’effort en aval. C’est tout l’intérêt des mesures complémentaires (pression intra-artérielle pour mesure de la réserve coronaire, directe ou simulée, et des approches fonctionnelles).
Évaluation de la viabilité myocardique
Il s’agit dans ce cas d’une maladie coronarienne connue : lésion coronaire occlusive ou pré-occlusive, et anomalies de la contractilité du myocarde en aval de cette lésion. L’objectif est de savoir si le myocarde atteint est viable ou non viable (nécrosé) et donc si une reperfusion de l’artère en cause permettrait d’obtenir un rétablissement fonctionnel.
Trois techniques d’imagerie permettent de différencier myocarde viable et myocarde nécrosé : l’IRM avec injection de chélates de gadolinium et séquences de rehaussement tardif, la scintigraphie myocardique au 201Tl, et enfin la TEP au FDG.
Parmi ces trois techniques, l’IRM est à considérer en priorité car c’est une technique sans exposition aux radiations ionisantes permettant une exploration complète du cœur (fonctionnelle et morphologique). De plus, son excellente résolution spatiale permet de faire la distinction entre séquelle de nécrose sous-endocardique et transmurale. Les techniques scintigraphiques sont à considérer en fonction de leur disponibilité.
Diagnostic différentiel
Certaines maladies non ischémiques peuvent se présenter cliniquement comme un syndrome coronarien. Le tableau 26.3 résume les principaux diagnostics différentiels et leurs techniques privilégiées d’exploration en imagerie.
Tableau 26.3 – Principaux diagnostics différentiels des syndromes coronariens aigus, et leurs moyens d’exploration en imagerie
|
Échographie |
IRM |
TDM |
Scintigraphie |
|
|
Péricardite |
++ |
++ |
+ |
– |
|
Myocardite |
– |
++ |
– |
– |
|
Dissection aortique |
++ (ETO) |
++ |
++ |
– |
|
Embolie pulmonaire |
±⁎ |
± |
++ |
++⁎⁎ |
ETO : échographie transœsophagienne.
⁎ L’échographie peut mettre en évidence des thrombus très proximaux au niveau des artères pulmonaires.
⁎⁎ Scintigraphie pulmonaire de ventilation/perfusion (voir chapitre 25).
Insuffisance cardiaque
L’insuffisance cardiaque est un syndrome clinique caractérisé par des symptômes typiques qui peut s’accompagner de signes localisateurs (augmentation de la pression jugulaire, crépitants pulmonaires et œdèmes périphériques), et qui est causé par une anomalie cardiaque structurelle ou fonctionnelle.
Rappels physiopathologiques
L’insuffisance cardiaque correspond à une réduction du débit cardiaque et/ou des pressions intracardiaques élevées au repos ou au cours d’un stress (définition 2016 de la Société européenne de cardiologie). Ses causes principales sont l’athérosclérose coronaire (insuffisance cardiaque post-infarctus ou au cours de l’ischémie) et l’HTA. D’autres causes plus rares sont possibles (pathologie valvulaire, cardiomyopathies primitives, cardiomyopathies infectieuses, inflammatoires ou infiltratives, etc.).
Indication des examens d’imagerie
Le diagnostic de l’insuffisance cardiaque repose sur l’examen clinique. L’imagerie a pour but :
- de confirmer le diagnostic de l’insuffisance cardiaque et d’établir la surveillance ;
- de rechercher des signes de complication dont l’œdème aigu du poumon ;
- de faire un diagnostic étiologique.
Estimation de la fraction d’éjection ventriculaire gauche (FEVG)
L’un des meilleurs paramètres pour évaluer l’insuffisance cardiaque est la FEVG, qui témoigne de l’efficacité de la contraction cardiaque. Dans la plupart des cas, l’insuffisance cardiaque entraîne une baisse de la FEVG proportionnelle à la gravité de l’atteinte. L’IRM et la ventriculographie isotopique constituent les techniques les plus robustes pour évaluer la FEVG, mais l’échographie est souvent privilégiée du fait de sa disponibilité et de sa portabilité. L’évaluation de la FEVG est également importante pour apprécier la gravité de l’atteinte, et assurer le suivi sous traitement. D’autres paramètres (VTD et VTS, débit cardiaque) peuvent aussi être utiles pour le suivi.
Évaluation de l’œdème aigu du poumon
La radiographie thoracique peut jouer un rôle pour diagnostiquer une décompensation aiguë de l’insuffisance cardiaque. Souvent, les cavités cardiaques, notamment gauches, sont dilatées, ce qui se traduit sur la radiographie thoracique par un élargissement de la silhouette médiastinale, objectivé par un index cardiothoracique supérieur à 0,5 (figure 26.19). L’œdème pulmonaire cardiogénique, présentation aiguë de l’insuffisance cardiaque, se présente sur la radiographie thoracique par des opacités floconneuses bilatérales, des lignes de Kerley de type B, qui sont de fines lignes (2 à 3 mm) d’environ 1 cm de longueur, perpendiculaires à la plèvre et qui prédominent aux bases, et/ou de type C (lignes B vues de face) et par un épanchement pleural le plus souvent bilatéral. En TDM, les éléments sémiologiques s’expliquent par la physiopathologie de cet œdème pulmonaire : épaississement des septums interlobulaires à prédominance apicale lié à la dilatation veineuse pulmonaire, verre dépoli par engorgement alvéolaire et épanchement pleural (figure 26.20).
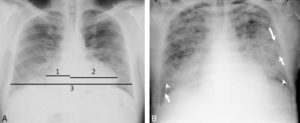
Insuffisance cardiaque.
A. L’index cardiothoracique se mesure sur une radiographie thoracique de face, rayon incident postéro-antérieur, bien inspirée. Il correspond au rapport de la somme des deux diamètres des arcs médiastinaux inférieurs droit et gauche depuis la ligne médiane (ligne des processus épineux) par le plus grand diamètre interne du thorax : (1 + 2)/3. Dans ce cas, il a été mesuré à 0,58 (valeur normale < 0,50). Cette augmentation traduit la cardiomégalie. Les culs-de-sac latéraux sont libres. B. Œdème pulmonaire cardiogénique : élargissement médiastinal ; opacités floconneuses bilatérales par comblement alvéolaire ; quelques lignes de Kerley B (flèches) et C (têtes de flèche)
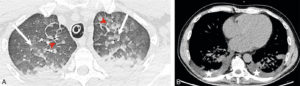
Insuffisance cardiaque.
A. Coupe axiale de TDM thoracique en fenêtre parenchymateuse pulmonaire. Épaississement des septums interlobulaires par dilatation veineuse pulmonaire (têtes de flèche) et verre dépoli intralobulaire (flèches) traduisant l’engorgement alvéolaire. Condensations parenchymateuses pulmonaires postérieures. B. Coupe axiale de TDM thoracique en fenêtre médiastinale. Épanchement pleural bilatéral (étoiles), hypodense, avec concavité vers l’avant (déclivité).
Bilan étiologique
L’insuffisance cardiaque survient le plus souvent dans un contexte étiologique connu (par exemple un patient développant une insuffisance cardiaque dans les suites d’un infarctus). Cependant, il est parfois nécessaire de faire un diagnostic étiologique. Dans ce contexte, l’échographie et surtout l’IRM jouent un rôle prépondérant. L’IRM permet de rechercher des anomalies myocardiques structurelles (présence de fibrose, de nécrose) dont l’importance et la topographie permettent d’orienter le diagnostic étiologique.
Enfin, dans le cas particulier de l’insuffisance cardiaque à FEVG préservée, l’imagerie est utile pour évaluer la fonction diastolique (capacités de remplissage du VG durant la diastole) qui est altérée. L’échographie est l’examen de choix, et à un moindre degré la ventriculographie isotopique et l’IRM.
Essentiel à retenir
- L’échographie Doppler permet d’explorer les structures vasculaires des membres et du cou en prodiguant des informations morphologiques et fonctionnelles hémodynamiques (vitesses circulatoires locales). Elle est plus limitée pour l’exploration des structures vasculaires abdominales, thoraciques et intracérébrales.
- L’échographie cardiaque transthoracique, disponible, non invasive et facile d’utilisation, constitue l’examen d’imagerie de première intention pour l’exploration du cœur. Sa bonne résolution temporelle, associée à l’étude de l’effet Doppler, permet d’analyser très finement les mouvements du myocarde et des valves.
- L’angiographie est une technique d’exploration des vaisseaux par leur opacification directe. Il s’agit d’une technique invasive mais qui présente le grand avantage de pouvoir être associée à un geste thérapeutique (angioplastie pour traitement d’une sténose, embolisation pour stopper une hémorragie, etc.).
- En imagerie en coupes (TDM et IRM), il est le plus souvent nécessaire de synchroniser l’acquisition des images avec l’ECG du patient, afin de tenir compte des mouvements cycliques du cœur, pour s’en affranchir ou au contraire les étudier.
- La TDM, du fait de son excellente résolution spatiale, est surtout utilisée pour l’exploration morphologique des artères de gros calibre (aorte et ses branches, notamment les artères coronaires), après injection d’un agent de contraste à base d’iode pour rehausser le contenu des vaisseaux. Elle est souvent l’examen de première intention dans un contexte d’urgence avec atteinte des grosses artères (aorte et branches), sauf dans l’infarctus du myocarde (coronarographie première pour traitement simultané par désobstruction de l’artère responsable).
- En médecine nucléaire, il existe de multiples MRP permettant d’explorer au choix la contractilité des ventricules, la perfusion et la viabilité myocardique, le métabolisme des cardiomyocytes ou l’innervation sympathique du cœur.
- L’IRM permet une analyse de la contractilité myocardique, de la perfusion myocardique sous couvert de l’injection d’un chélate de gadolinium, mais également de la morphologie et de la structure du myocarde (détection de la nécrose ou de la fibrose myocardique), ainsi qu’une exploration morphologique et fonctionnelle de l’aorte.
 |
Chapitre suivant |
 |
Retour au sommaire |
