Les fondamentaux – Chapitre 29 – Imagerie des seins et du pelvis féminin
I. Thomassin-Naggara et O. Humbert
Plan du chapitre
- Gynécologie
- Sénologie
Objectifs
Gynécologie
- Connaître les différentes techniques d’exploration pour la pathologie gynécologique.
- Connaître quelques éléments d’anatomie et de séméiologie normales en imagerie gynécologique.
- Connaître les différents éléments sémiologiques échographiques et tomodensitométriques (TDM) des principales urgences gynécologiques.
- Connaître le signal des principaux liquides et solides rencontrés dans les tumeurs ovariennes en imagerie par résonance magnétique (IRM).
Sénologie
- Connaître les techniques d’exploration de la pathologie mammaire. Savoir expliquer à la patiente la technique de la mammographie.
- Connaître l’existence du dépistage de masse organisé et sa cible.
- Connaître les principales indications des examens sénologiques diagnostiques.
- Connaître les principaux éléments sémiologiques en imagerie mammaire.
- Connaître les principaux examens sénologiques interventionnels.
- Connaître le principe et les principales modalités du bilan d’extension du cancer du sein.
- Comprendre l’intérêt et les perspectives de l’imagerie TEP dans le cancer du sein.
- Connaître la technique du nœud lymphatique sentinelle.
La place de l’imagerie dans l’exploration en pathologie gynécologique et mammaire est centrale, permettant de diagnostiquer, de surveiller la patiente sous traitement et de dépister des patientes asymptomatiques. Nous avons à notre disposition une large gamme de techniques d’imagerie utilisant les rayons X, les ultrasons, l’IRM ou les isotopes.
Gynécologie
Techniques d’exploration pour la pathologie gynécologique
L’examen de première intention, quel que soit le symptôme présenté par la patiente en gynécologie, est l’échographie pelvienne par voie sus-pubienne et par voie endovaginale avec Doppler. Cet examen se fait dans la continuité de l’examen clinique et permet parfois à lui seul de diagnostiquer une maladie ou d’orienter la patiente vers d’autres techniques d’imagerie. L’échographie par voie endovaginale présente une excellente résolution spatiale en raison de l’utilisation d’une sonde à haute fréquence placée au contact des structures utéro-ovariennes, sans l’interposition des muscles et de la graisse de la paroi abdominale. De plus, il s’agit d’un examen dynamique permettant de réaliser une palpation abdominale en même temps que l’examen échographique. Cet examen est réalisé avec l’accord de la patiente après l’avoir interrogée sur une virginité éventuelle, sur ses traitements en cours et sur ses antécédents médicaux, notamment allergiques (latex, antibiotiques, etc.).
Les examens pouvant compléter l’échographie endovaginale et sus-pubienne sont tout d’abord l’IRM pelvienne avec ou sans injection de produit de contraste à base de gadolinium. Elle permet d’explorer l’anatomie du pelvis féminin et est très utile pour la caractérisation des structures liquidiennes et solides situées dans le pelvis féminin. Cette technique permet de combiner des séquences morphologiques pondérées en T2, T1, T1 avec suppression de graisse, T1 après injection de gadolinium, ainsi que l’utilisation de séquences fonctionnelles permettant de différencier une tumeur bénigne d’une tumeur maligne (IRM avec injection dynamique de gadolinium, étude de la perfusion, imagerie de diffusion).
La TDM abdominopelvienne est parfois utile dans un contexte d’urgence, car une douleur pelvienne n’est pas toujours d’origine gynécologique, mais peut aussi être d’origine digestive ou urinaire. Elle présente un moins bon contraste tissulaire que l’IRM pelvienne mais une meilleure résolution spatiale. La TDM abdominopelvienne se fait le plus souvent sans et après injection de produit de contraste à base d’iode. La TDM est l’examen de référence du bilan d’extension des cancers ovariens car il permet la visualisation des métastases péritonéales sous la forme de petits implants péritonéaux.
En imagerie gynécologique, deux examens permettent d’analyser la morphologie des trompes ainsi que leur perméabilité : l’hystéro-salpingographie et l’HyFoSy ou hysterosalpingo-foam-sonography. Le premier examen se fait à l’aide de rayons X après opacification rétrograde des trompes par l’injection d’un produit de contraste radio-opaque à travers le col utérin. Le second se fait par injection d’un mélange d’air et d’eau sous échographie dans la cavité utérine pour évaluation tubaire. Leurs principales indications sont le bilan d’infertilité et le bilan de méno-métrorragies.
La TEP-TDM au 18F-FDG peut être indiquée pour réaliser le bilan d’extension initial de certaines tumeurs pelviennes (col utérin, endomètre, ovaires), lorsqu’elles sont localement avancées. La TEP au 18F-FDG est surtout utile pour réaliser le bilan d’extension régional et à distance, c’est-à-dire détecter un éventuel envahissement des nœuds lymphatiques régionaux (diffusion lymphogène) ou la présence de localisations secondaires (métastases) plus à distance (diffusion hématogène).
Éléments d’anatomie et de séméiologie normales en imagerie gynécologique
L’utérus est situé au-dessus et en arrière de la vessie et en avant du rectum. Chez la femme en âge de procréer, il a une forme de poire inversée, il est médian, plus ou moins dévié latéralement et anté- ou rétroversé. Ses quatre segments (col, isthme, corps et fond utérin) sont identifiables en échographie et en IRM (figure 29.1). L’utérus est composé de trois structures : la cavité utérine, l’endomètre, qui correspond à la muqueuse recouvrant la cavité utérine et le myomètre, qui est la portion la plus épaisse de l’utérus, correspondant à du muscle lisse. Au cours du cycle menstruel, l’échostructure et l’épaisseur de l’endomètre se modifient de façon physiologique : il est fin et plutôt hypoéchogène en première partie de cycle, et s’épaissit et devient progressivement plus hyperéchogène en seconde partie de cycle. Les trompes ne sont pas visibles à l’état normal en raison de leur finesse.
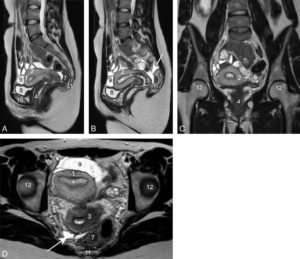
Coupes IRM en pondération T2 du pelvis d’une femme de 30 ans.
1. Fond de l’utérus ; 2. corps de l’utérus ; 3. col de l’utérus ; 4. vagin ; 5, 6. ovaires droit et gauche (plusieurs follicules sont visibles sous la forme de structures arrondies et hyperintenses) ; 7. rectum ; 8. vessie ; 9. anse grêle ; 10. corps du pubis ; 11. coccyx ; 12. têtes fémorales. Les étoiles sont dans la lumière utérine bordée par l’endomètre ; les flèches blanches montrent un seul récessus recto-utérin (cul-de-sac de Douglas), point déclive de la cavité péritonéale où s’accumulent les petits épanchements liquidiens. A. Coupe sagittale. B. Coupe parasagittale droite. C. Coupe frontale. D. Coupe horizontale. L’utérus est antéversé, un peu dévié à droite.
Les ovaires sont le plus souvent situés de part et d’autre de l’utérus, en dedans des vaisseaux iliaques externes. Ils sont de forme ovalaire et contiennent plusieurs follicules (figure 29.2). En échographie, les follicules apparaissent ronds et anéchogènes, mesurant entre 2 et 10 mm environ, harmonieusement répartis au sein du parenchyme ovarien. Le volume de l’ovaire varie en fonction de l’âge et du cycle.
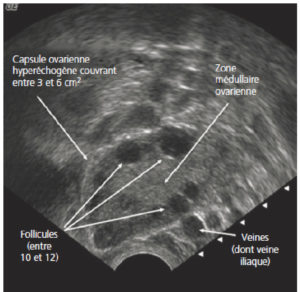
Ovaire normal d’une patiente en période d’activité génitale en échographie par voie endovaginale.
Éléments sémiologiques échographiques et tomodensitométriques des principales urgences gynécologiques
Les deux principaux symptômes motivant une consultation en urgence en gynécologie sont la douleur pelvienne aiguë et le saignement d’origine gynécologique.
Douleurs pelviennes
Grossesse extra-utérine
Chez la femme en période d’activité génitale, la survenue d’une douleur pelvienne aiguë nécessite de rechercher avant tout une grossesse extra-utérine. Si le dosage de l’hormone chorionique gonadotrope humaine (hCG) est positif, l’examen à pratiquer en première intention et en urgence est une échographie endovaginale à la recherche d’une grossesse évolutive. Les signes échographiques en faveur d’une grossesse extra-utérine sont la présence d’un utérus vide, d’un pseudo-sac ou de kystes dans l’endomètre associés à des signes annexiels que sont un embryon extra-utérin, un sac gestationnel ou plus fréquemment une masse tubaire (figure 29.3). On peut retrouver un épanchement pelvien non spécifique qui est non prédictif de rupture et dont l’échogénicité est variable. Une grossesse extra-utérine est habituellement très vascularisée en mode Doppler couleur.
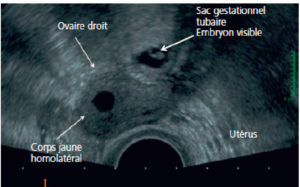
Grossesse extra-utérine en échographie par voie endovaginale.
En cas de doute diagnostique, un contrôle échographique toutes les 24 à 48 heures et une surveillance du taux de bêta-hCG sont proposés.
L’un des principaux diagnostics différentiels est la rupture de kyste lutéal hémorragique qui se traduit par la présence également d’un hémopéritoine, mais avec un rehaussement annulaire aplati caractéristique du kyste ovarien.
Torsion d’annexe
Devant des douleurs pelviennes aiguës, le second diagnostic à évoquer est celui de torsion d’annexe. Celle-ci est plus fréquente chez la femme enceinte, mais peut également survenir en l’absence de grossesse, parfois parce qu’une tumeur de l’ovaire (tumeur organique bénigne, kyste fonctionnel) a entraîné la torsion.
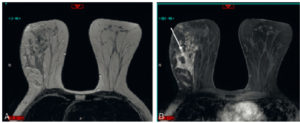
Les signes à rechercher sont, en échographie, une masse annexielle, un déplacement de l’annexe du côté controlatéral ou en position médiane, un épaississement de la trompe et la présence d’un tour de spire de la trompe tordue. Il existe des torsions d’annexe sur ovaire sain chez la patiente jeune (en raison d’un défaut de fixation de la gonade ou d’une augmentation de son volume) ; dans ce cas, le diagnostic est suspecté devant un œdème ovarien important avec déviation périphérique des follicules. En cas de doute diagnostique en échographie endovaginale, on peut proposer de réaliser une IRM pelvienne (figure 29.4) ou une TDM abdominopelvienne.
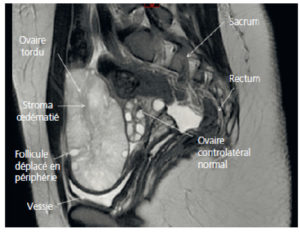
Torsion d’annexe (coupe sagittale en IRM en pondération T2).
Infection génitale haute (salpingite aiguë)
Le troisième diagnostic par ordre de gravité à évoquer devant des douleurs pelviennes aiguës est celui d’infection génitale haute. L’infection est d’origine endométriale et s’étend à la trompe et éventuellement à l’ovaire. En imagerie, les signes sont le plus souvent bilatéraux, asymétriques et centrés sur la trompe.
Il existe des images tubulées bilatérales dont la paroi est épaissie, correspondant aux trompes infectées. Elles sont très vascularisées en Doppler en échographie et se rehaussent de façon importante en IRM ou en TDM. Il s’y associe une infiltration de la graisse sous-péritonéale se traduisant par des plages de contours flous et de densité plus élevée de la graisse en TDM.
Endométriose
L’endométriose pelvienne est habituellement responsable de douleurs pelviennes chroniques souvent rythmées par les menstruations (dysménorrhées), de douleurs pelviennes lors des rapports sexuels (dyspareunie) et d’infertilité. Elle est explorée en échographie (idéalement par voie endovaginale, après information de la patiente) et en IRM.
Saignement d’origine gynécologique
Dans le cadre de l’urgence et devant des saignements abondants d’origine gynécologique, l’échographie par voie endovaginale recherche une anomalie endométriale ou myométriale. L’utilisation du Doppler est fondamentale dans cette indication à la recherche d’une malformation artérioveineuse, qui correspond à une image intramyométriale très vascularisée avec présence de foyers à haute vitesse (> 1 m/s). Une embolisation des artères utérines est réalisée sous guidage par rayons X (voir chapitre 21).
Éléments sémiologiques IRM des tumeurs annexielles (signal des principaux liquides et solides)
Une masse ovarienne peut être uni- ou pluritissulaire, être purement liquidienne, purement solide ou mixte. L’IRM est l’examen de choix car la combinaison des différentes séquences permet d’approcher une caractérisation de la masse.
Ainsi, les masses liquidiennes pures sont homogènes, en hypersignal en T2, en hyposignal en T1 et en hyposignal en diffusion. La graisse est en hypersignal T1, disparaissant après saturation du signal de la graisse ; cet aspect est retrouvé dans le kyste dermoïde ou le tératome ovarien. Le sang est également en hypersignal T1, mais ne disparaît pas après saturation du signal de la graisse ; cet aspect est retrouvé dans l’endométriome ovarien ou dans le kyste lutéal hémorragique.
Une tumeur ovarienne maligne présente une composante tissulaire qui est en hypersignal en diffusion et qui se rehausse de façon intense et précoce après injection de gadolinium.
Le risque de malignité de toute masse annexielle (ovarienne ou tubaire) s’évalue selon la classification O-RADS™ de l’American College of Radiology (ACR).
Toute masse annexielle considérée comme complexe ou indéterminée en échographie doit bénéficier d’une IRM. En IRM, les masses annexielles bénignes sont le plus souvent classées O-RADS™ IRM 2 (< 2 % de malignité) ou O-RADS™ IRM 3 (< 5 % de malignité) alors que les masses annexielles malignes (borderline ou invasive) sont classées O-RADS™ IRM 4 ou O-RADS™ IRM 5 (> 90 % de malignité) (figure 29.5).
![Figure 29.5 Masse ovarienne (coupes axiales en IRM en pondération T2/T1/T1 avec injection dynamique de gadolinium/courbe de perfusion IRM). Masse ovarienne uniloculaire avec végétations en signal T2 intermédiaire (flèche), se rehaussant après injection de gadolinium selon une courbe de type 2 (rehaussement modéré avec un plateau courbe rouge comparativement au myomètre [courbe verte]). Il s'agissait d'une tumeur borderline séreuse de l'ovaire.](https://www.cnp-mn.fr/wp-content/uploads/2023/01/Les-fondamentaux-29.5-300x223.jpg)
Masse ovarienne (coupes axiales en IRM en pondération T2/T1/T1 avec injection dynamique de gadolinium/courbe de perfusion IRM).
Masse ovarienne uniloculaire avec végétations en signal T2 intermédiaire (flèche), se rehaussant après injection de gadolinium selon une courbe de type 2 (rehaussement modéré avec un plateau courbe rouge comparativement au myomètre [courbe verte]). Il s’agissait d’une tumeur borderline séreuse de l’ovaire.
En cas de masse annexielle classée O-RADS™ IRM 5 ou de carcinose péritonéale, il est nécessaire de pratiquer un bilan d’extension par une TDM thoraco-abdomino-pelvienne avec injection pour évaluer la résécabilité de la maladie.
Sénologie
Techniques d’exploration en pathologie mammaire
En imagerie mammaire, nous disposons de trois types d’examen d’imagerie diagnostique : la mammographie fondée sur les rayons X, l’échographie fondée sur les ultrasons et l’IRM. Nous abordons essentiellement les deux premières techniques dans cette section.
La mammographie est une technique d’imagerie par rayons X qui permet de détecter les principales anomalies évocatrices d’un cancer du sein qui sont, par ordre de fréquence, des masses, des microcalcifications, des distorsions architecturales ou des asymétries de densité, soit des masses, soit des non-masses (asymétrie de densité, distorsion architecturale ou foyer de microcalcifications).
La nécessité de détecter des anomalies de très petite taille et la mobilité normale du sein rendent nécessaire l’utilisation d’un système de compression permettant de bloquer le sein contre un détecteur dont la résolution spatiale est excellente (< 100 μm). Deux incidences sont réalisées, l’une de face et l’autre oblique (à 45°) pour couvrir l’ensemble de la glande mammaire et repérer les anomalies dans l’espace.
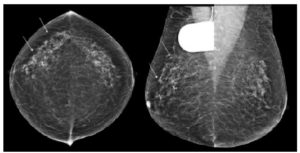
L’aspect d’un sein en mammographie est très variable en fonction des patientes et de leur statut hormonal. Dans un sein normal, on décrit quatre composantes anatomiques principales qui expliquent le signal radiologique : l’unité ductulolobulaire terminale et les canaux lactifères qui constituent le tissu glandulaire, le tissu fibreux et le tissu adipeux. En fonction de la proportion de tissu fibroglandulaire et de tissu adipeux de chacun de ces éléments, le sein est dense (tissu majoritairement fibreux et/ou glandulaire) ou radiotransparent (tissu majoritairement graisseux). La majorité des femmes présentent des seins de densité intermédiaire (densité types B et C selon le lexique Breast Imaging-Reporting And Data System® [BI-RADS®] de l’ACR). Les seins graisseux (densité type A) représentent 20 % de la population et les seins très denses (densité type D) représentent 10 % de la population. Avec l’âge, il existe une disparition progressive du tissu fibroglandulaire et donc une diminution progressive de la densité mammaire (figure 29.6). C’est la raison pour laquelle les seins des femmes jeunes, classiquement plus denses, sont plus facilement explorés en échographie, tandis que les seins des femmes plus âgées, classiquement moins denses, s’explorent plus aisément en mammographie.
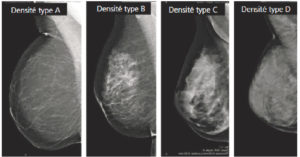
Densité mammaire.
Clichés mammographiques obliques montrant les différents types de densité mammaire.
Le cancer du sein naît dans l’unité ductulolobulaire terminale et se traduit le plus souvent par une masse dense. Il est donc facile à détecter dans un sein graisseux, mais plus difficile à détecter dans un sein dense ou très dense (densité types C et D) (figure 29.7).
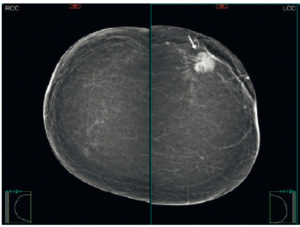
Mammographie bilatérale montrant une masse dense de forme ronde de contours spiculés correspondant à un carcinome canalaire invasif (flèche).
Dans ce cas, il est nécessaire de compléter la mammographie par une échographie mammaire.
En échographie mammaire, un cancer du sein se traduit par un nodule hypoéchogène qui se voit mieux dans le tissu fibroglandulaire (hyperéchogène) que dans la graisse qui est hypoéchogène (figure 29.8). L’échographie mammaire est donc un examen complémentaire de la mammographie. Elle permet de plus d’analyser la dureté des tissus, ce qui aide à reconnaître les cancers qui sont classiquement durs à la palpation, caractéristique retrouvée en mode élastographique échographique.
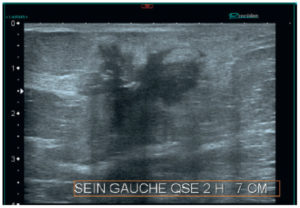
Échographie mammaire montrant une masse irrégulière de contours spiculés avec un halo hyperéchogène.
Cette masse est classée ACR5.
Dépistage de masse organisé et sa cible
Le dépistage organisé du cancer du sein repose en France sur la réalisation d’une mammographie bilatérale pour les femmes âgées entre 50 et 74 ans, une fois tous les 2 ans. Ce dépistage a montré sa capacité de détecter précocement le cancer du sein et d’améliorer la survie des patientes. La mammographie bilatérale doit être accompagnée d’un examen clinique. Cet examen fait l’objet de règles strictes d’acquisition (contrôle qualité des mammographes) et d’interprétation (lexique BI-RADS®). Afin de limiter les erreurs diagnostiques, une double lecture est organisée à l’échelon régional.
Principales indications des examens sénologiques diagnostiques
Outre le dépistage systématique chez des patientes indemnes qui se fait par mammographie bilatérale éventuellement associée à une échographie si la patiente a des seins denses ou très denses, ou si une anomalie est détectée sur la mammographie, la patiente peut se présenter d’emblée avec un symptôme mammaire nécessitant une exploration.
- En cas de masse palpable chez une patiente de moins de 35 ans, une échographie mammaire est réalisée en première intention. Chez les patientes de plus de 35 ans, une mammographie avec une échographie mammaire est recommandée.
- En cas d’écoulement mamelonnaire, une mammographie et une échographie sont réalisées, éventuellement complétées par une galactographie (opacification d’un canal lactifère par produit de contraste) en cas d’écoulement unipore. Si la réalisation de la galactographie est impossible, une IRM mammaire est une bonne alternative pour faire le diagnostic de toute atteinte intragalactophorique.
- En cas d’adénopathie axillaire suspecte, une exploration de la glande mammaire est réalisée par mammographie et échographie. Si ces examens sont normaux, une IRM mammaire est pratiquée.
- En cas de rétraction cutanée ou d’anomalie de la plaque aréolo-mamelonnaire, le bilan commence par une mammographie suivie d’une échographie. Si ces examens sont normaux, une IRM mammaire est pratiquée.
Éléments sémiologiques en imagerie mammaire
En imagerie mammaire, il existe deux types d’anomalies :
- les masses correspondent à un volume tissulaire envahissant l’espace. Une masse est décrite en fonction de ses contours (critère ayant la plus grande valeur diagnostique), sa forme et ses caractéristiques internes. En échographie, on ajoute des critères de déformabilité (élastographie, technique d’imagerie permettant d’analyser la déformabilité des tissus sous l’impulsion d’une onde ultrasonore). En IRM, on ajoute des critères de néovascularisation (courbe de rehaussement après injection de gadolinium) ;
- les anomalies sans masse correspondent à différentes entités en fonction de la modalité d’imagerie considérée. En mammographie, les non-masses sont les foyers de microcalcifications, les asymétries de densité et les distorsions architecturales. En échographie, il s’agit de zones hypoéchogènes mal limitées. En IRM, il s’agit de rehaussement sans masse dont on décrit la distribution et les caractéristiques internes de rehaussement après injection de gadolinium.
En fonction de ces différents critères descriptifs, les anomalies sont classées selon la classification BI-RADS® de l’ACR en cinq catégories. Ces catégories sont directement en lien avec la valeur prédictive positive de malignité (le risque que la lésion soit un cancer).
Un cancer du sein invasif se présente typiquement en mammographie sous la forme d’une masse hyperdense irrégulière de contours spiculés. En IRM, elle se rehausse précocement et intensément avec lavage secondaire (chute du signal après un pic de plus de 15 %). Les deux principaux diagnostics différentiels sont :
- l’adénofibrome qui est une tumeur bénigne solide intramammaire de contours lisses de forme ovale en mammographie et en échographie se rehaussant en IRM de façon peu intense et progressive (figure 29.9) ;
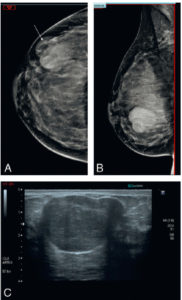
Diagnostic différentiel du cancer du sein : adénofibrome.
En mammographie (A, B), il existe une masse peu dense de contours lisses de forme ovale (flèche) correspondant en échographie (C) à la présence d’un nodule hypoéchogène homogène de contours macrolobulés typique.
- le kyste intramammaire qui peut être simple et se présenter sous la forme d’une structure liquidienne anéchogène ou complexe échogène.
Un cancer du sein in situ (strictement intracanalaire) se présente typiquement sous la forme d’anomalies sans masse, sous forme le plus souvent d’un foyer de calcifications (figure 29.10) dont la topographie suit les canaux lactifères (donc segmentaire orienté vers le mamelon). Certaines formes de cancers in situ de haut grade se traduisent en IRM sous la forme d’anomalies sans masse de trajet des canaux lactifères (figure 29.11).
Foyer de microcalcifications (flèches) en mammographie correspondant à un carcinome canalaire in situ du sein droit.
Carcinome canalaire in situ en IRM mammaire.
Non-masse de distribution triangulaire orientée vers le mamelon (segmentaire) (flèche).
En cas de cancer du sein, il est important de faire le bilan d’extension locorégional du cancer en appréciant la taille tumorale, la présence d’une extension à la peau, à la plaque aréolo-mamelonnaire ou au muscle grand pectoral. De plus, l’imagerie permet d’apprécier l’envahissement lymphatique axillaire et de guider d’éventuels prélèvements percutanés. Le meilleur examen d’imagerie pour ce bilan est l’IRM mammaire.
En cas de tumeur localement avancée (stade > IIB), le bilan associera également une TEP-TDM (voir paragraphe ci-dessous).
Examens sénologiques interventionnels
En sénologie, les biopsies percutanées des lésions mammaires sont relativement aisées. Plusieurs imageries sont possibles pour guider ce geste : guidage mammographique, échographique, IRM, voire TDM. On privilégiera toujours une biopsie sous guidage échographique, car elle est précise et permet de suivre en temps réel la procédure. Lorsque l’anomalie n’est pas visible en échographie mais en mammographie, elle peut être biopsiée sous guidage stéréotaxique.
Lorsqu’une anomalie est visible avec plusieurs modalités d’imagerie et que l’on veut s’assurer qu’il s’agit bien de la même lésion, on peut disposer des marqueurs métalliques en fin de procédure, de façon à pouvoir les visualiser à la fois en mammographie, en échographie et en IRM.
Enfin, lorsqu’une chirurgie conservatrice est envisagée (tumorectomie), le radiologue réalise un repérage préalable dans la glande mammaire par un fil ou un clip métallique pour aider le chirurgien à faire l’exérèse d’une zone tumorale visible sur l’imagerie, mais parfois difficilement repérable à l’examen clinique et en peropératoire (figure 29.12).
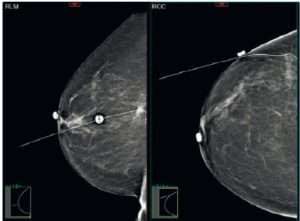
Repérage préopératoire d’un cancer du sein en mammographie.
Grâce à un fil métallique, positionné par voie percutanée, le chirurgien peut retrouver l’anomalie à opérer.
Modalités du bilan métastatique d’extension du cancer du sein
Le bilan d’extension vise à rechercher les localisations métastatiques d’un cancer du sein évolué. Il convient de rechercher en premier les métastases osseuses, pulmonaires et hépatiques, les autres sites de métastases étant des diagnostics cliniques (nœuds lymphatiques, peau, etc.) ou n’ayant qu’une incidence faible.
Cette recherche s’effectue en combinant différentes modalités d’imagerie qui explorent un ou plusieurs de ces organes à risque : radiographie de thorax, échographie abdominale, scintigraphie osseuse, TDM thoraco-abdominale, TEP au 18F-FDG, etc.
Un bilan d’extension par imagerie n’est pas systématique lors de la découverte d’un cancer du sein. En effet, pour les petites tumeurs asymptomatiques, la prévalence des métastases est faible et les examens d’imagerie exposent surtout au risque de résultats « faux positifs ». Citons l’exemple de la découverte fortuite d’un nodule pulmonaire bénin faisant suspecter à tort une métastase pulmonaire. Ce résultat faux positif risque d’inquiéter inutilement la patiente, d’aboutir à des gestes invasifs supplémentaires (biopsie du nodule pulmonaire) et de retarder la mise en route de son traitement.
Intérêt et perspectives de l’imagerie TEP dans le bilan des cancers pelviens et des cancers du sein
La TEP au 18F-FDG peut être utilisée pour le bilan d’extension des cancers du col utérin de stade avancé, de l’endomètre en cas de risque élevé de métastases (figure 29.13), de l’ovaire et du sein. Elle est utile au suivi de la réponse à la chimiothérapie et à la recherche de récidive.
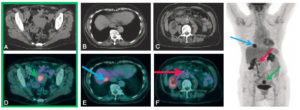
Examen TEP au 18F-FDG dans le bilan d’extension d’une tumeur du corps utérin grade 2, avec infiltration inférieure à 50 % du myomètre à l’IRM.
L’examen montre la lésion du corps utérin (flèches vertes) (A, D) associée à une lésion du segment VIII du foie (flèches bleues) (B, E) et à une atteinte lymphatique précave (flèches roses) (C, F).
Par ailleurs, dans les perspectives pour la prise en charge initiale du cancer du sein, de nouveaux médicaments radiopharmaceutiques (MRP) émergent. Leur objectif est d’identifier l’expression par les cellules tumorales de la cible moléculaire d’un agent thérapeutique, afin de mieux prédire son efficacité et d’adapter de façon individuelle le traitement. Parmi ces nouveaux MRP, citons l’exemple de l’imagerie de l’expression cellulaire des récepteurs aux œstrogènes. Le 16α-18F-fluoro-17β-œstradiol (18F-FES) est un analogue de l’œstradiol marqué au 18F ; il se fixe aux récepteurs des œstrogènes s’ils sont exprimés in vivo par les cellules tumorales. La TEP au 18F-FES permet alors de visualiser l’expression globale des récepteurs des œstrogènes par la maladie métastatique (figure 29.14). Elle est indiquée chez les patientes ayant un cancer du sein exprimant initialement les récepteurs des œstrogènes, métastatique, en rechute précoce après un traitement par hormonothérapie et lorsque la biopsie est jugée impossible. L’hormonothérapie est un traitement par anti-hormone permettant de stopper la croissance des cellules tumorales en s’opposant aux effets stimulants des estrogènes.
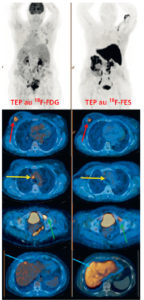
Examens TEP au 18F-FDG et au 18F-FES pour une même patiente présentant un cancer du sein métastatique.
Les lésions cancéreuses, visibles sur la TEP au 18F-FDG (images de gauche), ont une expression hétérogène des récepteurs aux œstrogènes sur la TEP au 18F-FES (images de droite) : la lésion mammaire droite fixe intensément le 18F-FES (flèches rouges), les adénopathies médiastinales ne le fixent pas (flèches jaunes), la métastase osseuse de la branche ischiopubienne gauche le fixe faiblement (flèches vertes). Enfin, la métastase hépatique n’est pas évaluable du fait du métabolisme hépatique physiologique du 18F-FES (flèches bleues).
Technique du « ganglion sentinelle » (ou du nœud lymphatique sentinelle)
Principe
La recherche du nœud lymphatique sentinelle est une technique qui vise à identifier le nœud lymphatique le plus à risque d’envahissement par les cellules malignes d’une tumeur (voir chapitre 17).
Au cours de leur évolution, certaines cellules tumorales se « détachent » de la tumeur primitive et se propagent dans l’organisme par la circulation lymphatique.
Elles vont alors être arrêtées par les nœuds lymphatiques qui se trouvent sur ce réseau lymphatique et qui fonctionnent comme des filtres. Les cellules tumorales s’y multiplient et infiltrent le tissu lymphatique. La connaissance de cet envahissement lymphatique est indispensable pour guider le choix du traitement optimal. Cette information peut être obtenue grâce à la technique du nœud lymphatique sentinelle.
Le principe du nœud lymphatique sentinelle repose sur la progression ordonnée des cellules tumorales au sein des nœuds du système lymphatique, de proche en proche, sans saut de relais lymphatique. Le premier nœud lymphatique sur cette chaîne lymphatique est appelé nœud lymphatique sentinelle. Si ce premier relais n’est pas envahi, alors les nœuds lymphatiques suivants seront également indemnes. S’il est envahi, alors les cellules tumorales ont pu diffuser dans les autres nœuds lymphatiques.
La technique du nœud lymphatique sentinelle vise à identifier le nœud lymphatique sentinelle parmi tous les autres nœuds lymphatiques locorégionaux et à permettre une exérèse/analyse sélective de ce seul nœud lymphatique. Si son analyse histologique ne montre pas d’infiltration tumorale, alors le curage lymphatique extensif (exérèse de tous les nœuds lymphatiques de cette même région) n’est pas nécessaire. L’intérêt pour la patiente est d’éviter la morbidité postopératoire d’un curage lymphatique étendu (risque de lymphœdème). Si l’analyse histologique du nœud lymphatique sentinelle révèle la présence de cellules tumorales, un curage lymphatique complet doit généralement compléter l’exérèse du nœud lymphatique sentinelle.
Indications
Son indication la plus fréquente est le cancer du sein de moins de 3 cm. Cette technique peut également être appliquée au mélanome ou, plus occasionnellement, à d’autres localisations telles que les cancers de la vulve, du col utérin, de la prostate, certains cancers ORL. Aucun envahissement lymphatique ne doit être suspecté à l’examen clinique ou à l’échographie (sinon, un curage lymphatique complet est plutôt réalisé directement).
Réalisation
La recherche du nœud lymphatique sentinelle du cancer mammaire peut se faire selon différentes méthodes.
Repérage visuel colorimétrique
Pendant l’intervention chirurgicale, le chirurgien injecte un traceur lymphotrope coloré (du bleu patenté) au sein de la tumeur ou au niveau du mamelon. Après quelques minutes, le colorant est drainé par le système lymphatique jusqu’au nœud lymphatique sentinelle, qui le « bloque » et se colore. Le nœud lymphatique sentinelle peut être repéré visuellement par le chirurgien qui fait son exérèse et l’adresse pour un examen anatomopathologique extemporané (c’est-à-dire au cours de l’acte chirurgical).
Repérage par la méthode isotopique
Quelques heures avant l’intervention, le MRP est injecté à proximité de la tumeur du sein (le plus souvent quatre injections sous-cutanées péri-aréolaires). Il s’agit de petites particules dont le diamètre va de 50 à 100 nm (sulfure de rhénium colloïdal ou nanocolloïdes d’albumine humaine), marquées au 99mTc. La taille de ces particules leur permet de circuler dans le système lymphatique, sans passer dans le système sanguin. Le transport vers les nœuds lymphatiques est rapide (quelques minutes à quelques heures).
Une lymphoscintigraphie (visualisation du drainage lymphatique du radiotraceur grâce à une gamma-caméra) est ensuite réalisée. Les images statiques sont centrées sur les régions mammaire et axillaire homolatérales afin de visualiser la ou parfois les voie(s) de drainage lymphatique amenant vers le nœud lymphatique. Le ganglion sentinelle va apparaître comme un foyer hyperfixant intense au sein de la région lymphatique axillaire, du fait de la concentration du traceur (figure 29.15). Une sonde de détection de la radioactivité permettra au chirurgien de repérer le nœud lymphatique sentinelle pendant l’intervention chirurgicale. Le nœud lymphatique sentinelle est souvent unique, mais peut parfois être multiple du fait de plusieurs conduits lymphatiques émanant de la région mammaire. Il est observé dans la région axillaire, parfois également dans la région thoracique interne.
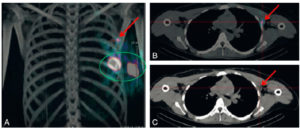
Lymphoscintigraphie aux nanocolloïdes d’albumine marquée au 99mTc d’un cancer du sein gauche.
Repérage par tomoscintigraphique couplée à une TDM : visualisation des deux points d’injection (cercle vert) et d’un nœud lymphatique sentinelle axillaire (flèches).
Essentiel à retenir
- L’exploration des affections gynécologiques se fait en première intention par une échographie pelvienne par voie sus-pubienne et endovaginale avec Doppler.
- L’exploration en pathologie mammaire se fait par mammographie et échographie. Dans certains cas, on complète le bilan par une IRM.
- L’anatomie du sein permet un accès simple aux techniques de biopsies percutanées qui peuvent se faire sous guidage mammographique, échographique ou IRM.
 |
Chapitre suivant |
 |
Retour au sommaire |
