Les fondamentaux – Chapitre 30 – Imagerie des glandes endocrines
F.-Z. Mokrane et D. Taïeb
Plan du chapitre
- Thyroïde
- Parathyroïdes
- Surrénales
- Pancréas
Objectifs
- Connaître les principales techniques d’exploration et la radio-anatomie de la thyroïde, des parathyroïdes, des surrénales et du pancréas.
- Connaître la place relative des techniques d’imagerie fonctionnelle et morphologique dans les principales pathologies endocrines.
- Connaître en TDM et en IRM les signes élémentaires des pathologies tumorales endocrines (nodule thyroïdien, adénome surrénalien, insulinome).
Thyroïde
Généralités
Les examens d’imagerie sont demandés lors du diagnostic clinique ou biologique d’une affection thyroïdienne. Il peut s’agir soit d’un trouble fonctionnel (hyperthyroïdie ou hypothyroïdie), soit d’une anomalie morphologique (palpation d’une masse ou d’un goitre, recherche d’un cancer primitif thyroïdien).
L’imagerie de la thyroïde repose sur deux techniques principales : l’échographie et la scintigraphie thyroïdienne.
Techniques et séméiologie normale
Échographies
La thyroïde est un organe superficiel, dont l’exploration est essentiellement réalisée en échographie, souvent à l’aide de sondes de haute fréquence, qui offrent une excellente résolution spatiale. À l’état normal, la thyroïde est homogène et hyperéchogène par rapport aux muscles adjacents. Les dimensions et la morphologie des deux lobes et de l’isthme thyroïdiens sont explorées dans le plan axial et dans le plan longitudinal (figure 30.1). Lorsqu’il existe un goitre plongeant en intrathoracique, l’échographie peut être insuffisante et il faut avoir recours à l’IRM ou à la TDM.
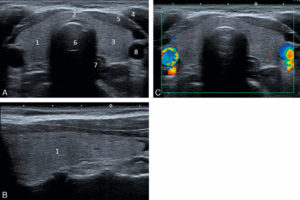
Échographie d’une thyroïde normale en coupes transversale (A) et longitudinale (B), et en coupe transversale en mode Doppler couleur (C).
Le parenchyme thyroïdien est homogène, hyperéchogène par rapport aux muscles adjacents et les contours de la glande sont réguliers. Absence d’hypervascularisation en Doppler couleur. 1. lobe droit ; 2. isthme ; 3. lobe gauche ; 4. muscle sternocléidomastoïdien gauche ; 5. muscles sternothyroïdien et sternohyoïdien gauches ; 6. trachée ; 7. œsophage ; 8. artère carotide commune gauche.
Scintigraphie
Les traceurs utilisés sont l’iode-123 (123I) et le pertechnétate-Tc-99m. L’123I a l’avantage de permettre une quantification plus fiable de la fixation, ce qui est précieux lorsque la concentration de TSH (thyroid-stimulating hormone ou thyréostimuline) n’est pas effondrée. Le pertechnétate est souvent plus largement utilisé du fait de sa disponibilité (produit à partir de générateurs présents dans les services de médecine nucléaire). La scintigraphie est classiquement indiquée en cas de TSH abaissée (< 0,50 mU/L) et a fortiori en présence d’une hyperthyroïdie d’origine périphérique avec une TSH inférieure à 0,1 mU/L. La fixation physiologique d’123I est inférieure à 2 % en présence d’une TSH effondrée. La scintigraphie permet de distinguer les hyperthyroïdies vraies (fixation de l’123I préservée), des hyperthyroïdies par relargage des stocks hormonaux préformés (thyroïdites) ou factices (fixation basse d’123I), et participe au bilan étiologique des hyperthyroïdies.
Séméiologie pathologique élémentaire
Nodule
Échographie
Le but de l’échographie thyroïdienne est de mesurer la taille de la glande, d’évaluer son échogénicité et de rechercher des nodules/masses. Le nodule thyroïdien correspond à une masse localisée dans la glande thyroïde. Il existe plusieurs types de nodules thyroïdiens classés en fonction de leurs aspects échographiques.
L’échographie ne permet pas de faire un diagnostic anatomopathologique, mais les critères échographiques péjoratifs sont pris en compte dans la classification Thyroid Imaging-Reporting and Database System (TI-RADS®), analogue pour la pathologie thyroïdienne de la classification Breast Imaging-Reporting And Data System (BI-RADS®) des lésions mammaires.
En France, la classification EU-TIRADS® (classification européenne TI-RADS®) est celle communément utilisée. Elle va d’un grade 1 (absence de nodule) à un grade 5 (risque élevé de malignité). La classification TI-RADS® permet donc de mieux appréhender le risque cancéreux et de guider la prise en charge.
Les lésions kystiques pures thyroïdiennes sont fréquentes et facilement diagnostiquées à l’échographie, apparaissant sous la forme d’un nodule anéchogène bien limité avec renforcement postérieur, en faveur d’un contenu liquidien (figure 30.2). Un kyste simple est classé EU-TIRADS® 2. Un nodule ovalaire iso- ou hyperéchogène par rapport au reste de la glande et de contours réguliers est classé EU-TIRADS® 3 (figure 30.3).
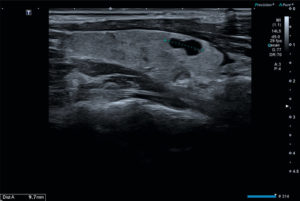
Coupe longitudinale du lobe droit thyroïdien.
Visualisation d’une formation kystique liquidienne anéchogène pure de 9 mm de grand axe. Il s’agit d’un kyste thyroïdien, classé EU-TIRADS® 2.
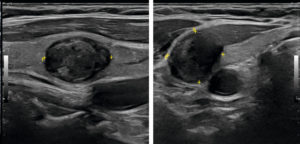
Nodules thyroïdiens solides présentant différents risques de malignité.
Coupe transversale du lobe thyroïdien gauche montrant un nodule de 40 mm hyperéchogène homogène, classé EU-TIRAD® 3, à faible risque de malignité.
Les nodules tissulaires peuvent être malins s’ils comportent certains critères échographiques : nodule hypoéchogène, présence de microcalcifications, contours irréguliers (figure 30.4).
Coupes longitudinale (A) et transversale (B) du lobe thyroïdien droit montrant un nodule de 14 mm de grand axe fortement hypoéchogène.
Ce nodule est classé EU-TIRAD® 5, à risque élevé de malignité.
L’échographie est également utile pour détecter d’éventuelles adénomégalies cervicales et pour guider la cytoponction d’un nodule échographiquement suspect.
Scintigraphie
La scintigraphie n’est pas indiquée en cas de TSH normale. Quand elle est réalisée, les nodules hypofixants ou isofixants (dits « froids ») doivent être considérés comme suspects. En revanche, les nodules hyperfixants sont presque toujours bénins. Il n’existe pas de traceur de référence pour le diagnostic de cancer. On utilise parfois le méthoxy-isobutyl-isonitrile (MIBI)-99mTc qui a une forte valeur prédictive négative de cancer, en cas d’absence de fixation.
Dysthyroïdies
Maladie de Basedow
Échographie
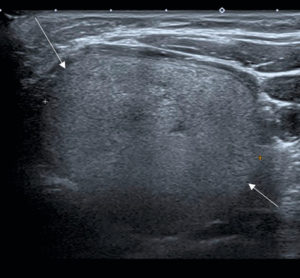
La glande est généralement de volume augmenté, parfois normal. L’échostructure glandulaire devient hétérogène de façon diffuse, avec des plages hypoéchogènes mal systématisées au sein de lobes globuleux (figure 30.5). Le mode Doppler met en évidence une riche vascularisation parenchymateuse.
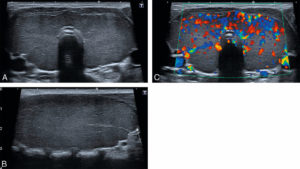
Goitre chez une enfant de 14 ans, suivie pour une maladie de Basedow.
Coupe transversale (A) sur la thyroïde montrant les deux lobes et l’isthme, augmentés de taille et de parenchyme discrètement hétérogène. Sur la coupe longitudinale du lobe thyroïdien droit (B), les bords de la thyroïde sont globuleux (flèche). En doppler couleur (C), la glande est globalement hypervascularisée.
Scintigraphie
La scintigraphie montre, selon le cas, un goitre ou une thyroïde de volume normal. Le captage de l’123I est classiquement diffus et intense (figure 30.6A). La valeur de fixation est souvent supérieure à 20 % à 2 heures et peut dépasser 80 %.
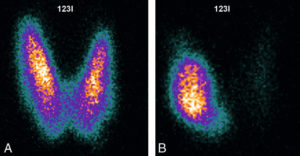
Hyperthyroïdie, scintigraphie à l’123I.
A. Hyperfixation diffuse en rapport avec une maladie de Basedow. B. Hyperfixation focale en rapport avec un adénome toxique.
Thyroïdite auto-immune de Hashimoto
Échographie
La thyroïde apparaît d’abord globuleuse, de contours lobulés, d’échostructure hypoéchogène, avec des travées hyperéchogènes en rapport avec l’infiltration lymphocytaire. Dans un deuxième temps, la glande se fibrose, s’atrophie et conserve une échostructure hétérogène à prédominance hypoéchogène.
Scintigraphie
La scintigraphie n’est classiquement pas indiquée dans ce contexte. Elle montrerait une fixation hétérogène (en damier).
Adénome et goitre multinodulaire toxique
Échographie
L’imagerie du goitre relève en première intention d’une échographie qui confirmera l’impression clinique d’augmentation du volume thyroïdien. Les nodules toxiques sont généralement tissulaires, hypoéchogènes et richement vascularisés.
En cas de retentissement œsophagien ou trachéal, une IRM analyse les rapports anatomiques ; elle est préférée à la TDM car l’injection de produit de contraste iodé est susceptible d’aggraver une hyperthyroïdie.
Scintigraphie
La scintigraphie met en évidence un ou plusieurs nodules hyperfixants (dits autonomes) malgré la présence d’une TSH abaissée (figure 30.6B) ; on parle alors d’adénome toxique ou de goitre multinodulaire toxique. Parfois, la forme multinodulaire peut coexister avec une hyperfixation thyroïdienne diffuse (variété dite « mixte »).
Thyroïdite de De Quervain
Échographie
L’échographie peut mettre en évidence des micronodules hypoéchogènes diffus ou une hypoéchogénicité bilatérale. La glande est globalement atrophiée.
Scintigraphie
La scintigraphie montre une fixation diminuée, en rapport avec la baisse de la TSH et l’atteinte tissulaire. Les thyroïdites de De Quervain ont souvent une évolution triphasique, bien visible en scintigraphie. La phase débutante montre l’atteinte d’un lobe, la phase d’état un effondrement du contraste global et de la fixation (« scintigraphie blanche ») et la phase de récupération une image bien fixante. Les thyroïdites factices ont également une fixation effondrée (« scintigraphie blanche »).
Parathyroïdes
Généralités
Le diagnostic d’hyperparathyroïdie est un diagnostic clinique et biologique. Comme souvent en pathologie endocrinienne, le rôle de l’imagerie est essentiellement topographique, permettant d’identifier la ou les glandes pathologiques en position eutopique ou ectopique. L’imagerie va donc influencer la tactique opératoire (abord mini-invasif versus cervicotomie exploratrice). L’atteinte est uni- ou bilatérale. Elle peut concerner une seule (adénome) ou plusieurs glandes (adénomes multiples ou hyperplasie). L’échographie et la scintigraphie sont souvent réalisées en première intention.
Séméiologie pathologique
Échographie, IRM, TDM
Les glandes parathyroïdes sont difficilement visibles en échographie lorsqu’elles sont normales. Elles apparaissent comme des nodules rétrothyroïdiens lorsqu’elles sont pathologiques. L’exploration doit concerner toute l’aire cervicale à la recherche d’une parathyroïde en position atypique et être complétée, en cas de négativité, par une TDM ou une IRM thoracique car certaines parathyroïdes de topographie atypique siègent dans le médiastin (figure 30.7).
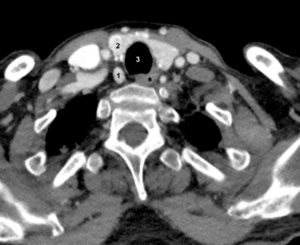
Coupe TDM axiale après injection d’un adénome parathyroïdien inférieur droit (1) ; thyroïde (2), trachée (3).
Scintigraphie
Le MIBI-99mTc (sestamibi technétié) est le traceur utilisé pour visualiser les glandes parathyroïdes hyperfonctionnelles. Toutefois, ce n’est pas un traceur spécifique et il existe aussi une fixation thyroïdienne. Deux méthodes ont été développées pour éliminer l’image thyroïdienne « parasite ». La première méthode (soustraction) consiste à soustraire l’image thyroïdienne grâce à la réalisation conjointe d’une image avec un traceur thyroïdien (123I) (figure 30.8). L’utilisation de 99mTc comme traceur thyroïdien imposerait une acquisition asynchrone (car même isotope que le sestamibi). La deuxième méthode (double phase) nécessite des acquisitions tardives car il existe une rétention prolongée du MIBI-99mTc dans la parathyroïde comparativement à la thyroïde. Les adénomes ont une fixation intense et précoce du MIBI-99mTc. Les acquisitions tomoscintigraphiques cervico-médiastinales couplées à une TDM permettent de dépister les adénomes en position ectopique, parfois développés aux dépens de glandes surnuméraires (notamment dans les hyperparathyroïdies secondaires). Une TEP à fluorocholine peut être réalisée en seconde intention. Elle permet un gain en sensibilité, mais son interprétation peut être délicate (ganglions cervico-médiastinaux ou nodules thyroïdiens hyperfixants).
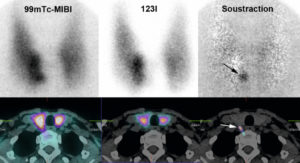
Hyperparathyroïdie primaire, scintigraphie par méthode de soustraction.
Après soustraction sur les images planaires et tomoscintigraphiques, il existe un foyer parathyroïdien unique en position eutopique.
Surrénales
Généralités
L’exploration morphologique des glandes surrénales est indiquée lorsqu’il existe des anomalies biologiques ou une lésion découverte de façon fortuite (incidentalome). Alors que l’imagerie nucléaire explore séparément les anomalies des sécrétions glucocorticoïde et minéralocorticoïde, l’imagerie morphologique décrit les anomalies de taille (tumeur, hyperplasie, atrophie) et aide à la caractérisation d’une éventuelle tumeur. La TDM est prescrite en première intention, parfois complétée par une IRM. L’échographie est d’un intérêt limité car les surrénales sont profondes et difficilement accessibles chez l’adulte.
Séméiologie normale
TDM, IRM
Les surrénales normales sont situées au-dessus, en avant et en dedans du pôle supérieur des reins. Elles sont constituées d’un corps et de deux jambes, et peuvent présenter plusieurs formes : V inversé, Y inversé, linéaire (figure 30.9A, B). L’aspect varie selon le plan de coupe. Le meilleur critère de normalité morphologique d’une surrénale est le caractère rectiligne ou concave de ses bords, qui deviennent convexes lorsque la glande est déformée par un processus pathologique tumoral, infectieux ou inflammatoire (figure 30.9C).
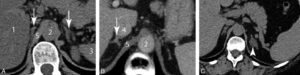
Coupes TDM dans le plan axial des glandes surrénales normales (A, B) et d’une masse surrénalienne gauche (C).
1. Foie ; 2. aorte ; 3. rate ; 4. veine cave inférieure ; 5. diaphragme. Les flèches montrent des glandes normales de morphologies différentes ; la tête de flèche en C désigne une masse surrénalienne.
Scintigraphie
Le choix du traceur dépend de la pathologie surrénalienne. On distingue classiquement les traceurs de la corticosurrénale et de la médullosurrénale, 131I-6-iodométhyl-19-norcholestérol (131I-iodocholestérol) dans le premier cas et 123I-MIBG ou 18F-DOPA dans le second cas. Les masses surrénaliennes non sécrétantes et non typiques d’adénome en imagerie conventionnelle peuvent être explorées par TEP au 18F-FDG.
Séméiologie pathologique
Hypercortisolisme
TDM, IRM
La première étape du diagnostic étiologique d’un hypercortisolisme doit déterminer si la sécrétion est adrenocorticotropic hormone (ACTH)-dépendante ou ACTH-indépendante.
Les hypersécrétions ACTH-dépendantes sont pour la plupart dues à un adénome hypophysaire, à explorer par IRM (voir chapitre 23). Il s’agit plus rarement, dans le cadre d’un syndrome paranéoplasique, d’une sécrétion ectopique par une tumeur carcinoïde (généralement bronchique), à rechercher par une TDM thoraco- abdomino-pelvienne.
Les hypersécrétions ACTH-indépendantes ont pour origine un adénome surrénalien (dit « adénome de Cushing »), un corticosurrénalome malin ou, plus rarement, une hyperplasie bilatérale des surrénales (micro- ou macronodulaire). L’adénome de la surrénale est un nodule bénin, homogène, arrondi et bien limité. Sur la TDM sans injection de produit de contraste, sa densité est pseudo-liquidienne, proche de 0 UH, traduisant son riche contenu en graisse. La traduction IRM de ce contenu graisseux est la chute du signal du nodule sur la séquence en opposition de phase en comparaison avec la séquence en phase (imagerie par déplacement chimique).
Scintigraphie
En cas d’adénome cortisolique, la fixation de 123I-iodocholestérol est intense avec extinction de la fixation surrénalienne controlatérale (du fait de la baisse de l’ACTH). En cas d’hyperplasie, la fixation est bilatérale et équilibrée. La scintigraphie a un intérêt limité dans les corticosurrénalomes malins, où la fixation tumorale est préservée dans la moitié des cas.
Hyperaldostéronisme primaire
TDM, IRM
La TDM est réalisée dans cette indication pour rechercher un adénome de Conn, qui est souvent de petite taille et qui présente les mêmes caractéristiques densitométriques et de signal que l’adénome de Cushing. En l’absence d’une image typique d’adénome unilatéral, le diagnostic s’oriente vers une hyperplasie bilatérale de la zone glomérulée. Toutefois, afin de s’assurer de l’absence de latéralisation de la sécrétion d’aldostérone, qui justifierait une intervention, un cathétérisme sélectif des veines surrénaliennes peut être réalisé recherchant une différence de sécrétion entre les deux glandes surrénales.
Scintigraphie
La scintigraphie au 131I-iodocholestérol peut participer au diagnostic étiologique des hyperaldostéronismes primaires, notamment en cas d’échec du cathétérisme veineux. L’examen doit être réalisé sous freination corticotrope puissante (Dectancyl® 2 mg/j, débuté 48 heures avant l’injection) et après saturation iodée de la thyroïde (pour protéger la glande thyroïde de l’effet potentiellement délétère de l’131I libre). Une fixation surrénalienne unilatérale est en faveur d’un adénome de Conn. Une fixation bilatérale oriente vers une hyperplasie bilatérale.
Tumeurs de la médullosurrénale
TDM, IRM
L’imagerie a un rôle topographique, après diagnostic clinique et biologique d’une hypersécrétion de catécholamines. Il s’agit dans 80 % des cas d’une tumeur de la surrénale (phéochromocytome) et plus rarement d’une tumeur extrasurrénalienne (paragangliome), qu’il faut rechercher « du clivus à l’anus », notamment à l’étage cervical, à proximité du cœur, de la vessie et dans le rétropéritoine médian.
Dans la mesure où le rôle de l’imagerie est topographique, les caractéristiques morphologiques de la tumeur ne sont pas déterminantes. Il s’agit habituellement de tumeurs hypervasculaires présentant parfois une composante kystique (figure 30.10).
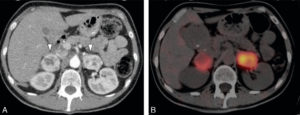
Imagerie du phéochromocytome.
A. TDM abdominale au temps artériel montrant deux masses surrénaliennes hypervasculaires avec une composante kystique. B. Image scintigraphique à la MIBG fusionnée à la TDM montrant une hyperfixation intense des syndromes de masses surrénaliens, compatibles avec un phéochromocytome bilatéral.
Scintigraphie
La scintigraphie à la 123I-MIBG ou la TEP à la 18F-DOPA constituent les imageries isotopiques de référence dans l’exploration des phéochromocytomes et paragangliomes (PPGL) (figure 30.11). La fixation est en règle générale intense pour les deux traceurs. L’imagerie isotopique permet de rechercher des atteintes multifocales (notamment dans les formes héréditaires) ou des métastases (notamment en cas de volumineuses tumeurs). La TEP aux analogues de la somatostatine ciblant les récepteurs de la somatostatine peut être indiquée en cas de PPGL, notamment dans les formes héréditaires liées à une mutation germinale d’un des gènes de la succinate déshydrogénase (SDHA-D).
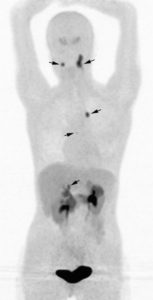
TEP à la 18F-DOPA dans un phéochromocytome/paragangliome héréditaire.
Multiples lésions tumorales développées aux dépens des paraganglions vagaux cervico-médiastinaux (paragangliomes) et de la médullosurrénale droite (phéochromocytome).
Insuffisance surrénale primaire
L’imagerie est réalisée à la recherche de métastases bilatérales ou d’un processus infectieux ou infiltratif.
La scintigraphie n’a pas d’indication. Une TEP au 18F-FDG peut être indiquée dans certains cas à la recherche d’une affection infectieuse, inflammatoire ou néoplasique.
Pancréas
Généralités
L’exploration d’un diabète de type 1 ou de type 2 ne nécessite aucune imagerie. En revanche, lorsqu’une maladie endocrine du pancréas est suspectée sur des arguments cliniques et biologiques, une TDM est réalisée en première intention.
Séméiologie normale
En échographie, le pancréas a une échostructure homogène et hypoéchogène par rapport à la graisse péritonéale. Cependant, compte tenu de sa localisation profonde, rétropéritonéale, il est difficilement exploré en totalité chez l’adulte du fait de l’interposition des gaz digestifs et du fait parfois de l’obésité du patient. En TDM, le pancréas normal est homogène et se rehausse de façon homogène (figure 30.12A, B). En IRM, le pancréas est de signal intermédiaire en T1 et en T2 ; il se rehausse également de façon homogène après injection de produit de contraste (figure 30.13). Les contours du pancréas sont bosselés. Cette lobulation est plus marquée avec l’âge en raison de l’infiltration graisseuse de la glande (figure 30.12C).
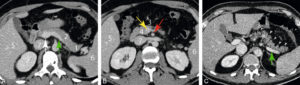
Aspect normal du pancréas en TDM : coupes TDM injectées axiales chez un patient de 25 ans (A, B) et chez un autre patient de 57 ans (C).
1. Queue du pancréas ; 2. corps du pancréas, séparé de la queue par le croisement de l’artère splénique ; 3. isthme du pancréas (en avant des vaisseaux mésentériques supérieurs) ; 4. tête du pancréas ; 5. foie ; 6. rate ; 7. veine cave inférieure. Flèche blanche : veine porte ; flèche jaune : veine mésentérique supérieure ; flèche rouge : artère mésentérique supérieure ; flèche verte : veine splénique. C. Aspect d’atrophie physiologique avec l’âge : les contours du pancréas deviennent plus irréguliers (têtes de flèche).
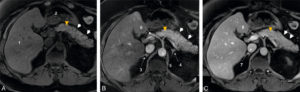
Aspect normal du pancréas en IRM : coupes IRM axiales en séquence T1 avec saturation de la graisse (Fat Sat), sans injection de produit de contraste (A) et après injection de produit de contraste au temps artériel (B) et au temps portal (C) chez un patient de 50 ans.
Le corps et la queue du pancréas sont bien visible sur ces coupes (têtes de flèche blanches). Le pancréas est en signal intermédiaire spontané sur la séquence T1 sans injection de produit de contraste (A), de rehaussement homogène, sans lésion focale sur les séquences réalisées aux temps artériel et portal (B, C). Le conduit pancréatique (de Wirsung) est très fin, à peine visible (tête de flèche orange). 1. Foie ; 2. estomac ; 3. surrénale droite ; 4. surrénale gauche ; 5. aorte abdominale ; 6. artère hépatique ; 7. veine cave inférieure ; 8. veine porte.
Séméiologie pathologique : exploration d’une tumeur endocrine du pancréas
TDM, IRM
Les tumeurs neuroendocrines pancréatiques sont des tumeurs relativement peu fréquentes, souvent de découverte fortuite, dont l’incidence augmente en raison de l’utilisation généralisée de l’imagerie en coupe. Elles représentent une entité hétérogène, caractérisée par une grande variation dans la présentation clinique, le caractère fonctionnel ou non, un éventuel contexte génétique et une agressivité variable. La localisation préopératoire d’une tumeur endocrine du pancréas diagnostiquée sur des arguments cliniques et biologiques n’est pas toujours aisée, notamment lorsque la lésion est de petite taille, ce qui est fréquemment le cas avec les insulinomes.
La TDM avec injection de produit de contraste iodé, au temps artériel, est l’examen à réaliser en première intention, à la recherche d’un nodule classiquement hypervasculaire et sans retentissement canalaire, à la différence de l’adénocarcinome pancréatique, plutôt hypovasculaire et rapidement responsable d’une sténose du canal pancréatique et/ou de la voie biliaire (figure 30.14).
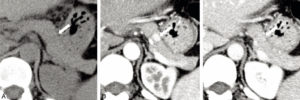
Tumeur neuro-endocrine du pancréas (insulinome) chez une patiente de 35 ans.
TDM abdominale en coupe axiale sans injection de produit de contraste (A), puis au temps artériel (B) et au temps portal (C) après injection. Visualisation d’un nodule pancréatique situé sur le corps, mesuré à 1 cm, visible uniquement au temps artériel. Cette image est très évocatrice de tumeur neuroendocrine pancréatique, ce d’autant qu’il n’existe pas de retentissement canalaire, c’est-à-dire que le conduit pancréatique n’est pas dilaté par la présence de la tumeur et reste très fin, non visible comme habituellement en TDM.
L’IRM est indiquée en deuxième intention, en cas de négativité de la TDM. Si elle-même est en échec, l’écho-endoscopie peut être proposée. L’écho-endoscopie n’est pas indiquée en première intention car elle nécessite une anesthésie générale et ne permet pas de réaliser le bilan d’extension, notamment hépatique.
Médecine nucléaire
Un large éventail de techniques d’imagerie moléculaire est également utilisé chez les patients atteints de tumeurs neuro-endocrines pancréatiques, comme l’imagerie des récepteurs de la somatostatine par tomographie à émission monophotonique (TEMP-TDM) et TEP, le 18F-DOPA et le 18F-FDG par TEP.
L’examen moléculaire de choix est la TEP aux analogues de la somatostatine (68Ga-DOTATATE en France). Il permet localiser la tumeur primitive devant un syndrome endocrinien (hypoglycémie hyperinsulinique, syndrome de Cushing ectopique et syndrome carcinoïde) ou des métastases prévalentes (hépatiques notamment), de déterminer des critères pour affirmer la nature neuroendocrine d’une lésion évocatrice sur l’imagerie conventionnelle, d’évaluer l’extension locorégionale et à distance, de déterminer la nature agressive ou non des lésions identifiées (biomarqueur pronostique), d’assurer le suivi évolutif des patients et, enfin, de sélectionner les patients pour un éventuel traitement par radiothérapie interne vectorisée. Pour les insulinomes, la sensibilité de la TEP est plus faible (60–70 %). La TEP aux analogues du GLP-1 (glucagon-like peptide 1) est très sensible (approchant 100 %), mais elle n’est pas disponible en routine en France.
Essentiel à retenir
- Le rôle de l’imagerie radiologique en pathologie endocrine est de localiser le site d’une sécrétion hormonale anormale, diagnostiquée sur des arguments cliniques et biologiques.
- L’échographie et la scintigraphie sont essentielles au diagnostic des affections thyroïdiennes et parathyroïdiennes.
- L’exploration morphologique des lésions surrénaliennes et pancréatiques s’effectue essentiellement en TDM et en IRM.
- L’imagerie métabolique (TEP ou scintigraphie) peut être spécifique d’une tumeur endocrine.
 |
Chapitre suivant |
 |
Retour au sommaire |
