Les fondamentaux – Chapitre 4 – Tomodensitométrie (TDM)
F. Pontana , B. Longère et A. Lalande
Plan du chapitre
- Introduction
- Principes de base
- Formation de l’image
- Principaux artefacts
- Produits de contraste
- Radioprotection en TDM
- Indications cliniques
- Conclusion
Objectifs
- Connaître les principes physiques et les risques de la tomodensitométrie (TDM).
- Connaître les bases de la formation et du traitement de l’image.
- Connaître les principes de prescription des TDM et des produits de contraste iodés.
- Connaître les indications et les limites de cette technique.
Introduction
Depuis l’apparition de la radiographie conventionnelle, consécutive à la découverte des rayons X par Wilhelm C. Röntgen en 1895, d’autres techniques d’imagerie permettant de visualiser plus de structures anatomiques de manière volumique ont été développées. En effet, la principale limitation de la radiographie conventionnelle est liée au principe même de cette technique qui repose sur la projection en deux dimensions d’un ensemble tridimensionnel de structures traversées par le faisceau de rayons X incident. Par conséquent, une partie des informations contenues dans l’image formée demeure inexploitable, masquée par les superpositions. De plus, la position des différentes structures les unes par rapport aux autres peut être ambiguë. La multiplication des incidences radiographiques, plus ou moins complexes à mettre en œuvre, permet par déduction de dégager certaines structures sans être néanmoins exhaustif.
L’ancêtre de la TDM, la tomographie, quant à elle, créait un flou cinétique permettant d’effacer du cliché radiographique toutes les structures situées hors du plan que l’on cherchait à imager, au prix d’une dose d’exposition plus importante et de la perte de toute information contenue dans les plans effacés (par exemple orthopantomographie ou panoramique dentaire).
La tomographie laissait entrevoir jusque dans son nom les prémices de la TDM qui permet d’explorer un volume en réalisant de multiples projections de plans selon des angles différents, au sein desquelles les structures sont différenciées en fonction de leur densité radiologique, c’est-à-dire leur capacité à absorber plus ou moins les rayons X. La discrimination à l’œil nu de leurs différentes densités nécessite une aide informatique permettant de voir les équivalents en densité des tonalités osseuse, hydrique et aérique de la radiographie conventionnelle.
Il revient à Godfrey Hounsfield d’avoir décrit et réalisé en 1972 la première TDM alors qu’Allan Cormack avait bâti 15 ans plus tôt le corpus mathématique nécessaire à son développement ; ils se partagèrent le prix Nobel de médecine de 1979.
Depuis les premières images TDM acquises en 1972, cette technique a connu un important et rapide essor technologique permettant d’abord une diminution du temps d’acquisition (de 6 coupes de 13 mm chacune en 35 minutes initialement à 384 coupes contiguës de 0,6 mm en 66 ms en 2016). Les principales innovations se sont efforcées récemment d’apporter une diminution notable de la dose d’exposition délivrée au patient tout en améliorant la qualité de l’image.
En 2012, en France, près de 82 millions d’actes diagnostiques utilisant des rayonnements ionisants ont été réalisés. Les examens TDM représentaient 10,5 % des actes réalisés mais 71 % de la dose efficace collective délivrée à la population française. La dose individuelle moyenne a augmenté de 20 % environ entre 2007 et 2012, du fait notamment d’une augmentation de 12 % du nombre d’examens TDM pendant cette période. Rapporté au nombre d’habitants, en 2019, la France était le troisième pays de l’Union européenne à prescrire le plus d’examens TDM. Ces données illustrent l’importance de maîtriser la dose délivrée au patient. Ce concept s’intègre dans le principe de radioprotection que le radiologue est, entre autres, en charge de faire respecter et de faire appliquer (voir « Radioprotection en TDM »).
L’augmentation du recours à la TDM ne doit pas faire négliger l’importance de l’examen clinique, prérequis indispensable afin de guider la demande.
Après avoir expliqué la formation de l’image à partir des principes de base de la TDM, l’utilisation des produits de contraste, quelques exemples d’indications de la TDM en pratique courante seront abordés dans ce chapitre.
Principes de base
« Anatomie » d’un scanner
Élément mobile tournant au sein d’un support fixe
Afin de pouvoir reconstruire les images dans le plan axial, il est nécessaire d’obtenir de multiples projections de rayons X réalisées selon les incidences couvrant de 0 à 180° autour de l’axe craniocaudal du patient. Ces incidences en projections multiples sont rendues possibles par deux grandes structures de la mécanique d’un scanner (figure 4.1) : le stator (statique) servant de support au rotor (rotation) de forme annulaire qui tourne autour du stator (rotor à ne pas confondre avec celui de l’anode tournante citée dans le chapitre 3).
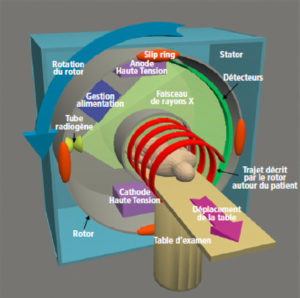
Représentation schématique simplifiée d’un scanner multidétecteur simple source de troisième génération.
Représentation du rotor (en gris) embarquant le système de gestion de l’alimentation électrique, le tube radiogène et les détecteurs. Il tourne au sein du stator auquel il est relié par les « slip rings » de sorte que le faisceau de rayons X décrit autour du patient installé sur la table en mouvement une trajectoire hélicoïdale (en rouge).
Au fil de l’évolution technologique de la TDM, il s’est avéré plus efficace d’appliquer une rotation continue au couple tube radiogène-détecteur autour du patient de manière à ne pas perdre de temps avec de multiples accélérations et décélérations du rotor (de l’ordre de ± 100 m/s2). Le poids de ce dernier (une tonne environ pour un scanner classique) implique d’importantes contraintes mécaniques, liées notamment aux frottements et à la force centrifuge générée par des vitesses de rotation de plus en plus élevées (actuellement jusqu’à quatre tours/seconde) pour des machines qui peuvent, pour certains modèles non présentés dans ce chapitre ici car bien moins répandus, embarquer sur leur rotor deux couples tube-détecteur (scanners bitubes). Compte tenu du grand nombre de tours effectués, il n’est pas possible de conduire l’alimentation électrique du système par un câblage classique ; la conduction électrique se fait par un système de bagues et de frotteurs (système « slip rings »). Le transfert de données peut s’effectuer par leur biais ou, plus fréquemment de nos jours, par une communication sans fil.
Le rotor électriquement relié au stator par les slip rings supporte la majorité des éléments de la chaîne radiologique :
- le tube à rayons X ou tube radiogène (dont les principes de fonctionnement ont été décrits dans le chapitre 3). Plus performant et donc plus onéreux qu’en radiologie classique, il doit répondre aux contraintes inhérentes à la technique TDM. Du fait d’une durée de balayage de l’anode tournante par le faisceau d’électrons plus importante qu’en radiologie conventionnelle, celle-ci doit pouvoir supporter un échauffement plus intense (capacité thermique élevée). Par ailleurs, elle doit être en mesure de se refroidir suffisamment rapidement pour permettre les acquisitions successives (dissipation thermique élevée) ;
- les filtres et collimateur primaire situés à la sortie du tube radiogène. Les premiers sont constitués d’une fine couche de métal (aluminium, étain) et ont pour objectif d’absorber les rayons X les moins énergétiques qui sont à l’origine d’une irradiation inutile (ils ne ressortiraient pas du patient et n’apporteraient donc aucune information). Le collimateur primaire, quant à lui, permet de modifier la géométrie du faisceau de rayons X afin de s’adapter aux largeurs d’exploration et aux épaisseurs de coupes désirées ;
- le système de détection. Son but est de restituer en signal électrique l’information contenue dans le faisceau de photons X ayant traversé le patient. De nos jours, les détecteurs les plus répandus consistent en des cristaux de céramique photoluminescents qui transforment les photons X en photons de lumière visible. Ces derniers sont captés par une photodiode située juste sous le cristal scintillant et convertis en courant électrique. Le cristal constitue l’unité élémentaire du système de détection. Ces cristaux de taille millimétrique sont disposés sur un arc de cercle dont le centre est occupé par le tube radiogène, de manière à couvrir le secteur angulaire du faisceau divergent de rayons X. Les scanners contemporains sont dits « multibarrettes » ou « multidétecteurs », par opposition aux scanners dits « monocoupes » désormais disparus. On désigne par « barrette » (ou par abus de langage « détecteur ») une rangée de cristaux scintillants disposés en arc de cercle. La juxtaposition de ces barrettes de détecteurs permet d’augmenter le nombre de coupes axiales acquises simultanément (16, 32, 64, 128, voire jusqu’à 320 coupes), la totalité de la surface de cristaux scintillants ainsi formée étant couverte par le faisceau. Les scanners de dernière génération utilisent des cristaux de 0,5 à 0,625 mm. Un scanner de 128 barrettes par exemple permet donc l’acquisition simultanée de 128 coupes couvrant une hauteur de 6 à 8 cm dans l’axe craniocaudal du patient. L’augmentation de la sensibilité des détecteurs est un enjeu important puisqu’elle permet une réduction significative de la dose d’exposition délivrée au patient pour une qualité d’image au moins équivalente.
Autres éléments
- L’alimentation électrique, de l’ordre de 150 kV, doit permettre le fonctionnement d’un circuit à basse tension et d’un circuit à haute tension pour le fonctionnement du tube.
- La table d’examen sur laquelle le patient est allongé est mobile, aussi transparente aux rayons X que possible et elle permet un mouvement de translation longitudinale au sein de l’anneau formé par le rotor.
- La console d’acquisition est un poste informatisé qui permet non seulement de programmer l’acquisition, mais également de reconstruire et visualiser les images. Le reconstructeur d’images de la console nécessite une importante puissance de calcul informatique car il pourrait constituer un facteur limitant aux avancées technologiques, notamment logicielles (un système informatique mal adapté retardant la disponibilité immédiate des images par un temps de reconstruction trop long).
Interaction des rayons X avec la matière
Les principes d’interaction des photons X avec la matière sont les mêmes qu’en radiographie conventionnelle (voir chapitre 3).
Réalisation en pratique d’une TDM
Le patient est accueilli au secrétariat et son identité est vérifiée. Il est ensuite pris en charge par un manipulateur en électroradiologie médicale (MER) qui l’installe dans une cabine s’il est valide. Le patient se déshabille partiellement en fonction du type d’examen. On s’assure qu’il n’y a pas de métal (bouton pression sur une chemise, boucle de ceinture par exemple), susceptible d’entraîner des artefacts sur l’image. La recherche de contre-indications à l’injection de produit de contraste, effectuée préalablement par le demandeur d’examen, est confirmée lors de l’examen. En fonction de la demande transmise par le médecin demandeur, le radiologue, s’il valide l’indication, détermine la (ou les) zone(s) anatomique(s) à explorer et la nécessité ou non d’utiliser un produit de contraste iodé. Des acquisitions successives peuvent être réalisées au cours d’un même examen sur tout ou partie du volume d’étude ; il s’agit du protocole d’acquisition. Si une injection intraveineuse de produit de contraste iodé est nécessaire, une voie veineuse périphérique est alors mise en place. Le patient est allongé sur la table d’examen et le manipulateur lui explique si une apnée est nécessaire pendant l’acquisition. L’anneau étant peu profond, il n’y a pas de problème lié à une éventuelle claustrophobie.
Depuis la console d’acquisition, le manipulateur, sous la responsabilité du radiologue, programme les différentes phases de l’examen selon le protocole :
- topogramme ou mode radio réalisé de face et parfois de profil : des radiographies (voir plus loin « Mode radio ») sont réalisées de manière à définir les limites du ou des volumes d’acquisition, représentés sous la forme de « boîtes » que l’on ajuste sur les clichés de repérage ;
- pour chaque volume d’acquisition programmé, plusieurs paramètres techniques doivent être ajustés afin d’optimiser le compromis entre la dose délivrée et la qualité de l’image qui devra rester compatible avec le diagnostic. Il est alors possible de modifier la quantité de rayons X émis (charge du tube, dépendant du milliampérage utilisé), l’énergie des photons X (en keV, dépendant du kilovoltage utilisé), les vitesses de rotation du tube autour du patient (en seconde par tour) et d’avancée de la table d’examen (définissant le pas de l’hélice décrite par le faisceau de rayons X autour du patient) ;
- l’acquisition est réalisée selon les paramètres précédemment renseignés. Une injection ou une ingestion de produit de contraste est réalisée si besoin. Le temps d’acquisition est très court (quelques secondes) sur les appareils récents ;
- les données obtenues, dites « données brutes », ne sont pas des images mais un profil global d’atténuation. Un traitement informatique est nécessaire pour générer les images (voir plus loin « Formation de l’image »). Cette phase de reconstruction des images peut nécessiter plus ou moins de temps (ancienneté du système informatique, nombre de coupes, protocoles spécifiques). Le radiologue consulte rapidement les images reconstruites afin de déterminer si des acquisitions complémentaires sont nécessaires ou si, au contraire, l’examen est terminé ;
- les images acquises sont traitées puis interprétées par le radiologue. Le temps de l’interprétation est plus long que celui de l’acquisition car une TDM peut générer plusieurs centaines de coupes auxquelles on applique des filtres divers (voir plus loin « Filtres ») et un traitement particulier en fonction de la question posée (voir plus loin «Traitement des images en TDM »). Les images produites lors de l’examen sont archivées afin d’être sauvegardées (voir chapitre 2).
Formation de l’image
Modes d’acquisition
Les mouvements de la table d’examen, associés ou non à la rotation du tube, permettent différents modes d’acquisition.
Mode radio
Le couple tube-détecteur restant fixe (pas de rotation), la translation de la table permet un balayage du patient par un faisceau de rayons X selon une incidence donnée et produit une image radiographique (dite « topogramme » ou « scout view »). Ce cliché permet notamment de repérer et de délimiter les volumes à explorer.
Le profil d’atténuation du topogramme permet de déterminer les variations d’absorption des photons X le long du volume exploré et de moduler automatiquement le flux de rayons X émis lors de l’acquisition. Cette modulation automatique de dose permet d’augmenter automatiquement le flux de rayons X lors du passage sur les structures plus absorbantes (ceintures scapulaire et pelvienne par exemple) et de le diminuer automatiquement au cours de la même acquisition lors de l’exposition de structures moins atténuantes comme le parenchyme pulmonaire.
Mode séquentiel
Ce mode d’acquisition était le seul utilisé sur les scanners des générations précédentes. La table étant immobile, le couple tube-détecteur effectue une rotation autour du patient et génère autant de coupes que de « barrettes ». À l’arrêt de la rotation, la table se déplace de manière à présenter au flux de rayons X la suite du volume à explorer. Un « tir » de rayons X est donc effectué autour du patient à chaque palier d’avancée de table (mode « step and shoot »).
Ce principe reste appliqué en imagerie cardiaque, en radiologie interventionnelle scanoguidée et en angioscanographie pour surveiller l’arrivée du bolus de produit de contraste dans les vaisseaux et déclencher l’acquisition au temps artériel approprié.
Mode hélicoïdal
Ce mode d’acquisition a presque complètement remplacé le mode séquentiel et constitue le mode habituel d’un scanner contemporain. La table d’examen effectue une translation à vitesse continue au centre du rotor, de sorte que le couple tube-détecteur décrit une hélice autour de l’axe craniocaudal du patient (figure 4.1). La vitesse d’avancée de table est déterminée lors de la programmation et dépend de la région anatomique explorée. Le terme de « scanner spiralé » est parfois employé, bien que la trajectoire décrite autour du patient ne soit pas une spirale mais bien une hélice.
De nos jours, une acquisition thoraco-abdomino-pelvienne peut être réalisée en une seconde sur quelques appareils récents (vitesse d’avancée de table de plus de 70 cm/s), permettant, entre autres, de diminuer les quantités de produit de contraste iodé injectées pour l’exploration d’une aorte complète et de limiter les artefacts induits par les mouvements du patient (mouvements respiratoires du patient confus ou dyspnéique, battements cardiaques). Cette accélération conséquente permet également la réalisation d’une étude multiphasique consistant en la répétition des acquisitions après injection de produit de contraste (voir plus loin « Produits de contraste ») avec en corollaire l’augmentation inévitable de la dose d’exposition délivrée au patient.
Densité
La densité « radiologique » a été définie par G. Hounsfield. Parfois appelée « densité » par abus de langage, elle n’a rien à voir avec la grandeur physique que représente le rapport de la masse volumique d’un corps à celle de l’eau pure.
La capacité d’un milieu à atténuer les photons X est représentée par son coefficient d’atténuation linéique (μ, ou coefficient linéaire d’atténuation, dont l’unité est l’inverse d’une longueur). Ce coefficient ne dépend pas de la quantité de photons l’abordant mais de leur énergie. Une définition plus simple et indépendante de l’énergie des rayons X est proposée : comme pour la densité physique, c’est l’eau pure qui a été retenue comme référence et tous les tissus ou éléments susceptibles d’être rencontrés dans l’organisme sont situés sur l’échelle dite « de Hounsfield », s’étalant initialement de –1000 à + 1000 Unités Hounsfield (UH) définie par :
Densite Hounsfield = 1000 x (µ – µH2O) / µH2O
(où μ est le coefficient d’atténuation linéique du volume étudié, et μH2O celui de l’eau pure).
Le coefficient d’atténuation de l’air étant très proche de zéro (qui est le coefficient du vide), l’atténuation des photons X dans les épaisseurs d’air, séparant le patient du tube radiogène d’une part, et du capteur d’autre part, est considérée comme nulle et la densité Hounsfield d’un tissu ne dépend ni de la largeur de l’anneau du rotor, ni de la corpulence du patient. On en déduit par ailleurs que l’air présente une densité radiologique de –1000 UH ; il s’agit de la limite inférieure de l’échelle de Hounsfield. Les structures moins denses que l’eau (air, graisse) présentent une densité Hounsfield négative.
En revanche, la limite supérieure de l’échelle de Hounsfield, qui avait initialement été fixée de façon symétrique mais arbitraire à + 1000 UH, a été repoussée en fonction des capacités matérielles à discriminer d’importantes atténuations. Ainsi, l’os très dense (comme le rocher) ou les prothèses métalliques peuvent présenter, vu leur coefficient d’atténuation, des densités bien supérieures à 1000 UH (si μ > 2 × μH2O). La répartition des densités rencontrées dans le corps humain est représentée dans la figure 4.2.
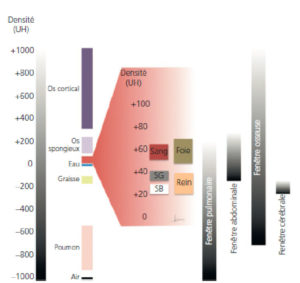
Échelle de Hounsfield.
Représentation schématique de la répartition des densités rencontrées dans l’organisme sur l’échelle de densité arbitraire utilisée en pratique. Les densités TDM sont exprimées en UH. Les densités correspondant aux parties molles et organes pleins sont très proches les unes des autres si l’on considère toute l’amplitude de l’échelle (de –1000 à + 1000 UH). L’utilisation de fenêtres, représentées à droite, permet de ne se concentrer que sur une plage donnée de l’échelle afin d’accentuer le contraste et de rendre perceptibles par l’œil humain ces faibles différences de densité. Les pixels situés en dessous de la borne inférieure de la fenêtre apparaissent tous en noir tandis que ceux situés au-dessus de la borne supérieure apparaissent tous en blanc. SB : substance blanche ; SG : substance grise.
La description des images TDM et leur interprétation feront donc référence à des structures hypodenses, isodenses ou hyperdenses (par rapport à la structure normale) et à des éléments de densités aérique, graisseuse, hydrique, osseuse, etc. Les termes de « tonalité » ou d’« opacité » sont à réserver à la radiographie conventionnelle, tandis que ceux de « signal » ou d’« intensité » sont propres à l’IRM.
Traitement des images en TDM
Les images natives sont les coupes axiales obtenues lors de l’acquisition et reconstruites par rétroprojection filtrée ou par itérations à partir des données brutes.
Le traitement des images désigne l’ensemble des applications effectuées à partir des images natives afin d’en tirer davantage d’informations, aboutissant à la formation d’images dites « reconstruites ». Ces reconstructions ne dispensent pas de l’analyse des images natives qui restituent plus fidèlement l’information contenue dans les données brutes (voir chapitre 10).
Filtres
La reconstruction des données brutes en images s’accompagne de l’application de filtres numériques. Ceux-ci vont intensifier sélectivement certaines données, dans le but notamment de mieux définir les contours au prix d’une augmentation du bruit (voir chapitre 2) dans l’image (filtre « dur ») ou, au contraire, de privilégier le contraste en acceptant d’induire une part de flou dans les contours (filtre « mou »). Le rapport signal/bruit (S/B, en anglais S/N) rend compte de cet effet : un filtre mou améliore le rapport S/B aux dépens de la résolution spatiale, et inversement pour un filtre dur (figure 4.3, figure 4.4). Il existe donc différents types de filtres selon les structures anatomiques que l’on souhaite étudier ; on peut reconstruire plusieurs jeux d’images successifs à partir des mêmes données brutes en leur appliquant le filtre souhaité. Une seule acquisition est effectuée pour reconstruire par exemple des images thoraciques en filtre mou dit « médiastinal » ou en filtre dur dit « parenchymateux pulmonaire »).
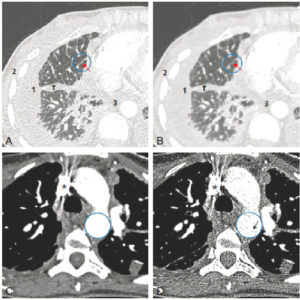
Angio-TDM thoracique réalisée chez une patiente souffrant d’une néoplasie mammaire évoluée (coupes axiales).
A. Reconstruction en filtre dur affichée en fenêtre parenchymateuse pulmonaire. Le filtre dur autorise une bonne résolution spatiale permettant de bien mettre en évidence les épaississements des lignes septales comportant de petites formations micronodulaires (flèche) dans le cadre de cette lymphangite carcinomateuse. Le contraste spontané avec l’air étant élevé, une fenêtre large est utilisée. En revanche, le faible contraste de cette fenêtre ne permet pas la distinction entre l’épanchement pleural (1) ou sa composante scissurale (1′), le muscle dentelé antérieur (2) et la graisse médiastinale (3). B. Même coupe qu’en A reconstruite en filtre mou et affichée en fenêtre parenchymateuse pulmonaire. Le filtre mou diminue le bruit au sein de l’image au détriment de la résolution spatiale, rendant moins évidente la composante micronodulaire au sein de l’épaississement septal (flèche). L’amélioration du rapport S/B par ce filtre ne permet néanmoins pas d’améliorer la différenciation entre les structures hydriques, musculaires et graisseuses (1 à 3) qui dépend du fenêtrage. C. Autre plan de coupe avec reconstruction en filtre mou affichée en fenêtre médiastinale. Le filtre mou offre un rapport S/B meilleur (zone agrandie au sein du cercle), permettant de bien étudier les structures tissulaires ou vasculaires. Noter la présence d’artefacts de durcissement du faisceau (atténuation des photons de basse énergie, laissant une forte proportion de photons de haute énergie) autour de la veine cave supérieure et liée au bolus de produit de contraste très dense (astérisque). D. Même coupe qu’en C reconstruite en filtre dur et affichée en fenêtre médiastinale. Bien qu’affichée en fenêtre médiastinale, l’étude du médiastin et des vaisseaux n’est pas optimale car le rapport S/B est faible. Le bruit davantage présent dans l’image se manifeste sous la forme d’un aspect granuleux visible (flèche au sein de la zone agrandie).
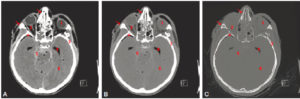
TDM cérébrale sans injection réalisée dans le cadre d’un traumatisme craniofacial sévère (même coupe axiale reconstruite selon différents filtres en utilisant différents fenêtrages).
1. Corps vitré de l’œil gauche (densité hydrique : 0 UH) ; 2. graisse rétro-orbitaire (densité graisseuse : –80 UH) ; 3. écaille temporale (densité osseuse : 950 UH) ; 4. air au sein de la corne temporale du ventricule latéral gauche (densité aérique : –980 UH) ; 5. sang au sein de la citerne prépontique (densité hématique : 65 UH) ; 6. parenchyme cérébral (densité tissulaire : 30 UH). A. Reconstruction en filtre mou affichée en fenêtre parenchymateuse cérébrale. Le fenêtrage permet la bonne visibilité de l’hémorragie sous-arachnoïdienne traumatique diffuse moulant les sillons corticaux et les citernes droites (5) ainsi que la différenciation entre les substances blanche et grise (6). La pneumencéphalie (astérisque) en temporopolaire droit est également bien visible et signe la présence d’au moins une fracture. B. Reconstruction en filtre mou affichée dans une fenêtre proche d’une fenêtre parenchymateuse pulmonaire. Cette fenêtre est plus large que la précédente, diminuant ainsi le contraste. L’hémorragie est nettement moins visible (5) et la distinction entre les substances blanche et grise n’est plus possible (6), la rendant inappropriée pour l’étude du parenchyme cérébral. La nuance entre les densités graisseuse (2) et aérique (4) est mieux visible qu’en A. C. Reconstruction en filtre dur affichée en fenêtre osseuse. Cette fenêtre est centrée sur les densités plus élevées et est large. Le contraste naturel entre l’os cortical et les autres structures ne nécessite pas une fenêtre étroite (3). Le filtre dur augmente par ailleurs la résolution spatiale, rendant ainsi visibles les fins traits de fracture du processus frontal de l’os zygomatique droit et des os nasaux (flèches). Ces fractures ne sont pas décelables sur les reconstructions en filtre mou, d’autant plus qu’elles ne sont pas affichées en fenêtre osseuse.
Un autre exemple est l’utilisation d’un filtre dur pour étudier l’os. En effet, bien que le contraste naturel entre les tissus mous et l’os ne nécessite pas d’être amplifié, dans l’os lui-même, les anomalies recherchées (fin trait de fracture par exemple) nécessitent un filtre dur pour une délimitation très nette des contours sur des coupes très fines. À l’inverse, un filtre parenchymateux cérébral est mou car l’étude TDM du parenchyme cérébral va s’attacher à rechercher, sur des coupes volontiers épaisses, des faibles différences de densité et non de très fines anomalies structurelles (voir figure 4.4).
Fenêtrage
À chaque pixel, structure élémentaire de l’image, est attribuée une valeur numérique proportionnelle à la densité moyenne qu’il représente et apparaît en nuances de gris. Sur un écran, plusieurs centaines de niveaux de gris sont représentées alors que l’œil humain ne peut en discerner qu’entre 20 et 30. Il est donc nécessaire de compenser les limites imposées par notre physiologie par un artifice numérique nommé « fenêtrage ».
L’ensemble des pixels d’une image peut être réparti sur un histogramme présentant en abscisse les valeurs numériques que peuvent prendre les pixels (216 valeurs de 0 à 65 535 pour une image codée sur 2 octets) et en ordonnée le nombre de pixels présentant cette valeur. Afin de représenter sous forme d’image ces valeurs numériques, on attribue à l’histogramme une table de correspondance (look-up table [LUT]) qui affecte un gradient de niveaux de gris à l’abscisse, de son origine à sa valeur maximale ; elle fait donc correspondre des niveaux de gris à l’écran avec la valeur numérique du pixel. Par convention, la LUT utilisée en TDM va du noir au blanc de sorte que les pixels présentant de faibles valeurs apparaissent plus sombres, et inversement (voir chapitre 11).
En diminuant la largeur d’abscisse le long de laquelle la LUT s’étend, tous les pixels présentant une valeur au-delà des bornes inférieure ou supérieure de la LUT apparaissent respectivement noirs ou blancs. Aux pixels situés entre ces bornes, une nouvelle nuance de gris est attribuée, permettant à l’œil de discriminer davantage de valeurs et donc de densités, tandis que l’information située hors de cet intervalle est volontairement masquée. Le terme de « fenêtre » désigne la largeur de la LUT. Une fenêtre large permettra d’afficher une vaste palette des densités explorées, quitte à ne pas en percevoir toutes les nuances, tandis qu’une fenêtre plus étroite n’affichera qu’un échantillon des densités explorées mais en permet une meilleure discrimination. Ainsi, la largeur de la fenêtre définit le contraste de l’image restituée.
Une fois la largeur de fenêtre fixée, il est également possible d’en définir le centre (appelé aussi niveau) le long de l’axe des abscisses. Une fenêtre centrée sur les valeurs les plus faibles sera propice à l’étude détaillée des structures les moins denses, et inversement. La modification du centre de la fenêtre permet donc de modifier la luminosité de l’image.
Le fenêtrage désigne le réglage de la largeur et du centre de la fenêtre pour optimiser l’étude d’une région donnée (voir figure 4.2).
Les notions de fenêtre et de filtre sont à bien distinguer (voir figures 4.3 et 4.4) : le filtre permet la reconstruction des images à partir des données brutes en accentuant certaines informations (contours ou contraste), tandis que la fenêtre permet de modifier l’affichage des images reconstruites selon un filtre donné. Ainsi, une acquisition thoracique reconstruite en filtre dur pourra être affichée en fenêtre dite « parenchymateuse », relativement large et centrée sur les très faibles densités aériques, tandis que le cadre osseux apparaîtra très « blanc » et de façon homogène ; les mêmes images en filtre dur peuvent également être affichées en fenêtre dite « osseuse », cette fois-ci centrée sur les hautes densités afin de pouvoir distinguer l’os cortical des trabéculations, tandis que le parenchyme pulmonaire apparaîtra uniformément « noir ». En revanche, l’analyse du médiastin et des vaisseaux nécessitera des images reconstruites selon un filtre mou afin de limiter le bruit dans l’image et affichées avec une fenêtre dédiée à l’étude des parties molles (plus étroite et centrée sur les densités hydriques).
Mesures
La reconstruction des images sur la matrice se fait selon les lois de la géométrie (symétrie centrale, projections, rotations, agrandissements), de sorte qu’il est possible de calculer et d’afficher des paramètres géométriques. En effet, il est possible d’effectuer diverses mesures, par l’intermédiaire d’outils graphiques, sur les images affichées : longueurs (rectilignes ou non), aires, angles, volumes. Par ailleurs, il est possible de mesurer en UH la densité d’une région dite « région d’intérêt » (region of interest [ROI]) afin de caractériser un tissu ou d’en quantifier le rehaussement après injection de produit de contraste.
Reconstructions de données volumiques
Du fait des dimensions inframillimétriques des récepteurs actuels, regroupés en barrettes couvrant de larges hauteurs, l’empilement des coupes permet l’obtention de véritables volumes d’acquisitions. Le passage d’un objet bidimensionnel à un niveau tridimensionnel implique de redéfinir l’unité élémentaire qu’est le pixel ; on lui ajoute une dimension qui ne correspond plus à un carré mais à un cube appelé « voxel » (volume element).
Il est alors possible de reconstruire une coupe du volume selon n’importe quel plan de l’espace : il s’agit des reconstructions multiplanaires (multiplanar reconstruction ou multiplanar reformating [MPR]) (figure 4.5). Ces reconstructions multiplanaires peuvent également permettre de suivre la trajectoire d’une structure (un vaisseau par exemple) afin de la dérouler et ainsi de permettre la visualisation d’une structure curviligne sur une seule image (MPR curviligne). D’autres modes de reconstructions sont disponibles : sommation dans l’épaisseur des structures les plus denses (maximal intensity projection [MIP]), sommation dans l’épaisseur des structures les moins denses (minimal intensity projection [MinIP]), reconstruction du volume, en affectant une texture, un jeu de lumière et une couleur à chaque structure reconstruite (rendu surfacique, surface rendering, mode SR, ou rendu volumique, volume rendering, mode VR) (voir chapitre 10).
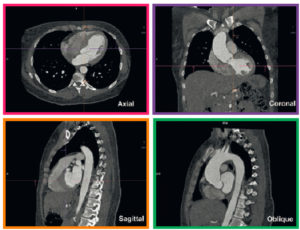
MPR d’une angio-TDM thoracique.
Le mode MPR permet l’affichage d’une même série d’images natives dans les plans axial (cadre rose), coronal (cadre violet) et sagittal (cadre orange) de manière simultanée ou dans tout autre plan de l’espace. Ici, une reconstruction sagittale oblique dans le plan de la crosse aortique permet d’afficher le vaisseau sur toute sa longueur (cadre vert).
Traitements spécifiques
Ces applications sont dérivées des reconstructions sur les acquisitions volumiques : endoscopie digestive ou bronchique virtuelle permettant de naviguer dans les organes creux pour rechercher des structures bourgeonnantes, détection automatisée de lésions pulmonaires ou hépatiques (par exemple computer-aided diagnosis [CAD]), reconstruction de volumes aux différents temps du cycle cardiaque, et calcul des volumes et fonctions ventriculaires, étude dynamique de la perfusion d’un organe avec établissement de courbes de rehaussement, permettant notamment la caractérisation tissulaire, cartographie de la répartition du produit de contraste iodé injecté, fusion avec d’autres modalités d’examens d’imagerie.
Principaux artefacts
Il existe de nombreux types d’artefacts en TDM : de mouvement, métalliques, de volume partiel, de durcissement, d’hélice, en cible. Les plus caractéristiques et les plus fréquents sont abordés ici.
Artefacts de mouvement
Même si l’acquisition est rapide, elle n’est pas instantanée, et donc il est nécessaire que le sujet demeure immobile de manière à ne pas produire de flou sur les images. En TDM, l’artefact de mouvement se manifeste sous la forme d’un dédoublement des contours en mouvement. La coopération du patient est donc nécessaire pour l’exploration TDM, afin d’obtenir de lui qu’il n’effectue aucun mouvement. Cela implique généralement une apnée d’une dizaine de secondes pour les explorations thoraciques ou abdominopelviennes. L’immobilité peut néanmoins être difficile à obtenir selon le terrain : patient confus ou agité, enfant non coopérant, dyspnée sévère, patient algique, etc. Une sédation ou une contention physique, voire une anesthésie générale peuvent se révéler nécessaires. La pulsatilité des artères, le péristaltisme digestif ou les battements cardiaques restent incontrôlables. Au niveau de la racine de l’aorte, cela peut entraîner de fausses images de dédoublement des contours de la racine aortique pouvant en imposer à tort pour une dissection aortique. On peut l’éviter en utilisant une synchronisation de l’acquisition TDM à l’électrocardiographie (ECG) et en utilisant un module de reconstruction des images dédié à l’exploration cardiaque et vasculaire, au prix d’une irradiation plus importante (figures 4.6 et 4.7).
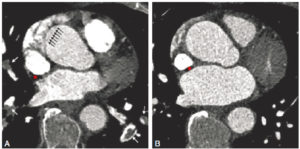
Angio-TDM thoracique réalisée dans le cadre d’une suspicion de dissection aortique (coupes axiales).
A. Les battements cardiaques se répercutent sur la racine aortique et sont responsables d’artefacts cinétiques se manifestant sous la forme d’un dédoublement des contours, mimant ainsi une dissection de l’aorte thoracique ascendante (flèches noires). Noter la présence d’une embolie pulmonaire (défaut de rehaussement endoluminal ; flèches blanches). B. Le recours à une synchronisation cardiaque (« gating » cardiaque) permet de s’affranchir des artefacts cinétiques et d’écarter ici le diagnostic de dissection aortique. La synchronisation cardiaque n’est pas toujours possible dans le cadre de l’urgence, ce qui n’empêche habituellement pas le diagnostic (en particulier lorsque la dissection atteint l’aorte descendante, fixe et donc moins sensible aux artefacts cinétiques). A, B. Le bolus de produit de contraste concentré au sein de la veine cave supérieure est responsable d’artefacts de durcissement du faisceau, se manifestant par des bandes hypodenses (astérisque).
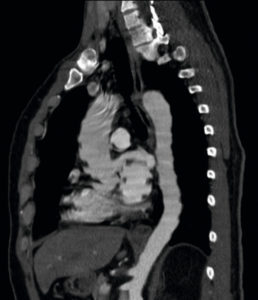
Angio-TDM thoracique réalisée dans le cadre d’une suspicion de dissection aortique (coupe sagittale oblique).
L’absence de synchronisation cardiaque et une résolution temporelle insuffisante (temps de rotation du rotor trop long) génèrent des artefacts de mouvement avec un aspect crénelé de l’aorte thoracique qui gêne son évaluation.
Artefacts métalliques
On parle d’artefact métallique lorsque le phénomène de durcissement du faisceau est provoqué par l’interaction du faisceau de rayons X avec un corps étranger métallique, produisant des artefacts en bandes caractéristiques, souvent plus marqués que lorsqu’ils sont produits par des structures osseuses denses. Ces corps étrangers sont le plus souvent des implants dentaires ou des prothèses orthopédiques (figures 4.8 et 4.9).
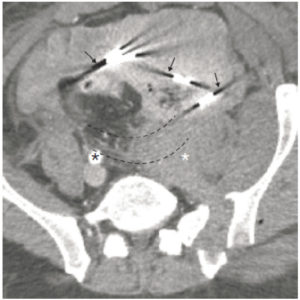
TDM abdominopelvienne en coupe axiale à l’étage pelvien.
L’examen est réalisé dans le cadre d’un traumatisme grave du bassin ayant nécessité le tamponnement d’un saignement par des compresses après laparotomie puis fermeture (cette technique d’hémostase chirurgicale en urgence est également appelée packing). Les compresses présentent des bandes métalliques permettant leur repérage radiographique ou comme ici en TDM. Ces bandes sont responsables d’artefacts métalliques (flèches noires). Par ailleurs, il existe probablement un problème de calibration sur le scanographe ayant réalisé l’examen, se manifestant sous la forme de bandes disposées en cible (lignes pointillées). Noter la thrombose de l’artère iliaque primitive gauche qui n’est pas opacifiée (astérisque blanc), contrairement à son homologue controlatérale (astérisque noir).
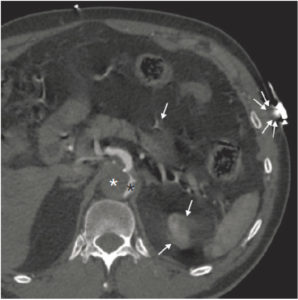
Dissection aortique sur TDM thoraco-abdomino-pelvienne (coupe axiale à l’étage abdominal).
La vitesse d’avancée de table élevée utilisée est responsable d’artefacts en hélice au pôle supérieur du rein gauche, ou en étoiles en regard des structures vasculaires, propres à la technique hélicoïdale (flèches). Les électrodes du scope ECG posées sur la peau sont responsables d’artefacts métalliques (doubles flèches). Noter l’opacification du vrai chenal (astérisque noir), tandis que le faux chenal, circulant plus lentement, n’est pas encore opacifié (astérisque blanc).
Effet de volume partiel
Il ne s’agit pas à proprement parler d’un artefact mais plutôt d’une limite de l’imagerie tomodensitométrique. Le principe est que plusieurs entités de densités différentes sont codées au sein d’un seul voxel. Le signal résultant est une moyenne du signal de l’ensemble des entités pondérées par leur volume relatif au sein du voxel. Alors, le signal obtenu ne correspond plus à une structure en particulier. Ce phénomène est d’autant plus fréquent que les coupes sont plus épaisses et l’objet plus petit. L’analyse multiplanaire permet souvent de confirmer l’effet de volume partiel suspecté.
Produits de contraste
Principes
Le contraste naturel entre les tissus de certaines régions anatomiques étant limité (abdomen par exemple), le recours à des produits de contraste est souvent nécessaire en TDM. L’augmentation du contraste est due à la présence d’atomes à numéro atomique élevé (Z = 53 pour l’iode, Z = 56 pour le baryum) qui augmentent l’absorption des photons X.
L’iode en lui-même est toxique du fait de son interaction avec la thyroïde et est donc intégré dans une enveloppe moléculaire cyclique (benzènes) rendue hydrophile afin d’empêcher sa métabolisation. Il existe plusieurs spécialités de produits de contraste iodés distribuées par différents laboratoires pharmaceutiques, chacune correspondant à une enveloppe benzénique différente. Ces différentes spécialités sont souvent disponibles en plusieurs concentrations différentes (jusqu’à 400 mg/L d’iodure). Les produits de contraste sont des médicaments sur liste I (uniquement délivrés sur prescription médicale).
Les modalités d’administration des produits de contraste iodés sont multiples. Bien que la voie intraveineuse soit largement la plus utilisée en TDM, il est également possible, entre autres, de faire ingérer le produit de contraste, de l’injecter en intrathécal (pour les recherches de fistule ostéodurale par cisternoscanner) ou de l’injecter directement au sein d’une cavité par ponction directe, ou par l’intermédiaire d’un drain ou d’une sonde.
Comme pour tout médicament, la prescription des produits de contraste impose la recherche préalable de contre-indications. En cas d’urgence, l’indication prime généralement sur la contre-indication, sous réserve de la mise en œuvre des moyens permettant la prise en charge des éventuelles complications (dialyse ou prise en charge d’une réaction allergique).
On notera, parmi les évolutions technologiques, l’utilisation actuellement du scanner spectral qui permet de décomposer le rayon X en différentes énergies. Ainsi, en fonction de l’énergie (keV), il est possible de distinguer les structures osseuses et calciques, les vaisseaux, les tissus mous en réduisant l’utilisation de produit de contraste iodé.
Effets indésirables, contre-indications et interactions
Des fiches pratiques de recommandation ont été rédigées par le Comité interdisciplinaire de recherche et de travail sur les agents de contraste en imagerie (CIRTACI), à destination des radiologues et des médecins prescripteurs. Ces fiches sont disponibles sur le site de la Société française de radiologie (SFR) [1]. Les effets négatifs liés à l’injection intravasculaire de produits de contraste iodés sont fréquents, certains d’entre eux étant parfaitement bénins.
Réactions non allergiques
Réaction physiologique à l’injection de produit de contraste
L’injection du produit de contraste augmente l’osmolalité plasmatique, ce qui provoque un appel d’eau depuis les cellules endothéliales et une vasodilatation diffuse. L’effet ressenti est celui d’une bouffée de chaleur diffuse, sans caractère pathologique, et dont on prévient systématiquement le patient afin qu’il ne s’inquiète pas inutilement au moment de l’injection. Les autres signes souvent ressentis au cours de l’injection sont un goût métallique et une fausse sensation de miction.
Réaction d’hypersensibilité immédiate non immunoglobulines E (IgE)-dépendante
L’injection peut par ailleurs provoquer une dégranulation des polynucléaires basophiles, la libération d’histamine provoquant alors des démangeaisons, voire une urticaire et, éventuellement, nausées et vomissements. Cette hypersensibilité immédiate non IgE dépendante (histaminolibération non spécifique) n’est pas de type allergique et est considérée comme mineure. Elle est plus fréquente à débit d’injection élevé et si le produit de contraste a une concentration élevée. Certains patients sont davantage sujets à ce type de réactions non allergiques, notamment les patients présentant un terrain atopique ou les patients asthmatiques (aggravation des symptômes respiratoires). Cette réaction ne contre-indique pas l’injection ultérieure de produit de contraste mais justifie une surveillance au décours de l’examen afin de ne pas méconnaître une réaction allergique vraie. Une préparation par antihistaminiques H1 est efficace dans ce cas.
Réactions allergiques : réactions d’hypersensibilité immédiate allergique
Il s’agit alors de réactions d’hypersensibilité immédiate IgE-dépendantes, impliquant une reconnaissance spécifique des molécules du produit de contraste par des IgE spécifiques produites lors d’une première phase de sensibilisation. Cette reconnaissance immunologique spécifique entraîne une activation des mastocytes et des polynucléaires basophiles provoquant une réaction allergique vraie de sévérité variable, habituellement dans les premières minutes suivant l’injection. Les réactions allergiques ont été décrites et classées en fonction de leur sévérité par Ring et Messmer et sont présentées dans le tableau 4.1 [2].
Tableau 4.1
Classification de Ring et Messmer des réactions allergiques [2]
|
Grade |
Symptômes |
|
Signes cutanéomuqueux Érythème, urticaire avec ou sans angio-œdème |
|
| II |
Atteinte multiviscérale modérée Cardiovasculaire : hypotension, tachycardie Respiratoire : toux, dyspnée Gastro-intestinal : nausées, vomissements Téguments : érythème, urticaire, angio-œdème |
|
III |
Choc anaphylactique, défaillance mono-/multiviscérale sévère Cardiovasculaire : état de choc, tachycardie, voire bradycardie, troubles du rythme Respiratoire : bronchospasme, détresse respiratoire Gastro-intestinal : douleurs abdominales Téguments : apparition parfois retardée, après restauration hémodynamique |
|
IV |
Arrêt cardiorespiratoire |
Il est donc recommandé d’adresser le patient à une consultation d’allergologie en cas de réaction consécutive à l’injection de produit de contraste iodé. Tout produit de contraste engendrant une réaction positive aux tests cutanés devra être contre-indiqué, mais pourra être substitué par une autre spécialité de produit de contraste (absence de réactions croisées).
Il est important de rappeler que les réactions allergiques vraies ne sont pas provoquées par l’atome d’iode (déjà présent dans la thyroïde) : l’allergie à l’iode n’existe pas ! Par conséquent, il ne faut pas contre-indiquer l’injection de produit de contraste chez un patient prétendument « allergique » aux produits de la mer ou à la polyvidone iodée (Bétadine®) qui n’ont aucune communauté antigénique avec les produits de contraste iodés. L’allergie est liée aux molécules associées à l’iode, qui varient d’un produit à l’autre.
D’ailleurs, il n’existe pas de réaction allergique croisée entre les différents produits de contraste iodés disponibles sur le marché. Lors des tests allergologiques suivant une réaction d’hypersensibilité aux produits de contraste, différentes spécialités sont testées, même si la probabilité d’être authentiquement allergique à deux spécialités différentes est très faible. Une fois la spécialité responsable identifiée, il n’existe pas de contre-indication fondée à utiliser une autre spécialité iodée (d’autant qu’elle aura en général également été évaluée lors des tests allergologiques).
Néphrotoxicité et insuffisance rénale
Les produits de contraste iodés sont éliminés par filtration rénale. Ils peuvent induire une néphropathie au produit de contraste définie par une élévation de plus de 30 % de la créatininémie de base ou par une oligurie survenant dans les 72 heures suivant l’injection. Le dosage de la créatininémie est donc indispensable avant toute injection intraveineuse de produit de contraste iodé.
Les patients présentant un débit de filtration glomérulaire (DFG) inférieur à 60 mL/min/1,73 m², une néphropathie diabétique, un myélome avec protéinurie, un traitement néphrotoxique (anti-inflammatoires non stéroïdiens [AINS], sels de platine, etc.) ou un âge supérieur à 65 ans sont davantage susceptibles de développer une néphropathie induite par les produits de contraste et représentent une population à risque.
En cas d’insuffisance rénale sévère (DFG < 30 mL/min/ 1,73 m²), l’injection de produit de contraste est en principe contre-indiquée. La prescription, en particulier dans la population à risque décrite plus haut, devra être réfléchie et une méthode d’exploration alternative (échographie, IRM) sera privilégiée lorsque cela sera possible. Si l’injection est malgré tout nécessaire, certaines précautions devront être mises en place : injection réalisée si possible à 7 jours d’intervalle de l’administration d’un autre médicament néphrotoxique (AINS, cure de chimiothérapie) et délai d’au moins 3 à 5 jours entre deux injections de produit de contraste iodé.
En cas d’insuffisance rénale modérée, des mesures de néphroprotection seront nécessaires : hydratation suffisante encadrant l’injection (2 litres per os entre les 24 heures précédant et les 24 heures suivant l’injection), de préférence par une eau riche en sodium et en bicarbonate.
Les antécédents de transplantation rénale doivent faire considérer le patient comme insuffisant rénal sévère (contre-indication) tandis que l’hémodialyse ne justifie pas de précaution particulière.
La metformine est une molécule à élimination rénale favorisant le métabolisme anaérobie et la production d’acide lactique. Les patients diabétiques de type II sous metformine devront interrompre leur traitement après l’injection de produit de contraste. Si une néphropathie induite par les produits de contraste survient (la néphropathie diabétique étant l’un des facteurs de risque), la metformine n’est plus éliminée et s’accumule dans l’organisme au fil des prises du traitement. Il en résulte une dangereuse acidose lactique, qui peut être prévenue par la suspension systématique du traitement après injection de produit de contraste. La réintroduction de la metformine est autorisée après contrôle de la créatininémie à 48 heures. Il n’est en revanche plus recommandé d’interrompre la metformine en amont de l’examen [1].
Perturbation du métabolisme thyroïdien
Malgré l’incorporation de l’iode à des molécules benzéniques, des iodures libres sont susceptibles d’être captés par la thyroïde et d’induire une hyper- ou une hypothyroïdie. Cela est plus fréquent chez le nouveau-né et chez les patients présentant une affection thyroïdienne (hyperthyroïdie non équilibrée).
Une hyperthyroïdie non contrôlée, d’autant que le patient est âgé ou souffre d’une maladie cardiaque, contre-indique l’injection de produit de contraste iodé du fait du risque de cardiothyréose induite. Les patients souffrant d’hyperthyroïdie mais suivant un traitement par antithyroïdiens ne relèvent en revanche d’aucune précaution spécifique.
L’administration de produits de contraste iodés peut enfin perturber le métabolisme d’autres agents pharmacologiques. L’iode libre dans le produit de contraste iodé est capté par la thyroïde qu’il sature, empêchant ainsi par compétition la fixation de l’iode 123 ou de l’iode 131. Ainsi, lorsqu’une scintigraphie thyroïdienne ou qu’un traitement par iode radioactif sont nécessaires, ils doivent être réalisés avant une TDM avec injection de produit de contraste iodé et non après.
Grossesse
Aucune étude animale ne met en évidence d’effet tératogène des produits de contraste iodés. Néanmoins, comme souvent lorsqu’il s’agit de ce terrain spécifique, le principe de précaution est de mise (et se surajoute aux problèmes liés à la radioprotection chez la femme enceinte exposés plus loin). Autant que possible, la réalisation des examens sera reportée après l’accouchement. Cependant, si l’examen est urgent et ne peut pas être reporté, la patiente, le demandeur et l’équipe d’obstétrique s’accordent sur la réalisation de l’examen et doivent être informés de l’injection nécessaire de produit de contraste iodé ainsi que du risque théorique d’hypothyroïdie néonatale.
Acquisition multiphase
L’injection de produit de contraste s’effectue habituellement sur une voie veineuse périphérique posée au membre supérieur. Le produit est administré le plus souvent à l’aide d’une seringue automatique permettant de délivrer un volume et un débit prédéfinis, sur une durée par conséquent aisée à calculer. Le bolus de contraste suit le sens physiologique de la circulation sanguine : le produit transite par les veines du membre supérieur pour rejoindre la veine cave supérieure se drainant dans l’atrium droit. Le contraste arrive ensuite dans le ventricule droit et opacifie les artères pulmonaires puis les veines pulmonaires avant de revenir à l’atrium gauche et au ventricule gauche. Le contraste est alors éjecté au sein de l’aorte, puis se distribue à tous les organes par le biais des branches artérielles partant de l’aorte. Après le rehaussement parenchymateux qui nécessite un délai variable d’un organe à l’autre, le retour veineux s’effectue par les veines systémiques et le réseau porto-mésentérique, et se collecte finalement dans les systèmes caves supérieur et inférieur. L’élimination est principalement rénale et a minima biliaire (part majorée en cas d’insuffisance rénale).
En fonction du délai fixé pour le déclenchement de l’acquisition, l’exploration pourra s’effectuer à différents moments de la chronologie (figure 4.10 et 4.11). Les différents temps sont détaillés dans le tableau 4.2. Les acquisitions peuvent être répétées à différents délais après le début d’une seule injection afin d’obtenir plusieurs « temps » ou phases sans recourir à des injections itératives. Le choix des phases et de leur nombre relève de la responsabilité et de la décision du radiologue, et est guidé par l’indication pour laquelle le patient a été adressé. Même s’il n’y a pas de nouvelle injection de produit de contraste, chaque phase supplémentaire s’accompagne d’une nouvelle acquisition et donc d’une augmentation de la dose délivrée au patient.
Tableau 4.2
Les différents temps de l’injection en TDM
|
Temps |
Délai* |
Opacification |
Exemples |
|
Phlébographique |
10 à 15 s |
Réseau veineux du membre injecté |
Perméabilité veineuse |
|
Artériel pulmonaire |
20 à 25 s |
Artères pulmonaires |
Embolie pulmonaire |
|
Artériel |
30 à 35 s |
Artères systémiques |
Dissection aortique Carcinome hépatocellulaire |
|
Cortical |
40 s |
Cortex rénal |
Carcinome rénal |
|
Portal |
80 à 90 s |
Organes pleins (parenchymographie) Réseau porto-mésentérique |
Lésions secondaires Étude de wash-out |
|
Tubulaire |
90 à 100 s |
Néphrographie |
Abcès rénal |
|
Tardif |
> 3 min |
Organes pleins Fibrose |
Etude de wash-out Infarctus du myocarde |
|
« Excréteur » |
7 min 30 s |
Voies urinaires excrétrices |
Lésion urothéliale |
* Les délais sont définis à partir du début de l’injection de produit de contraste. Les valeurs sont données à titre indicatif et peuvent varier, notamment en fonction de l’indication, des habitudes du radiologue, du débit et de la concentration de produit de contraste, de l’état hémodynamique du patient et de son âge, du site d’injection et du type de machine TDM utilisée.
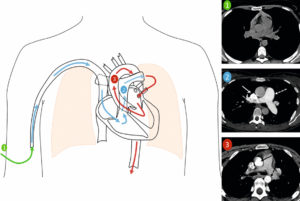
Progression du bolus de produit de contraste dans les vaisseaux thoraciques.
Le bolus de contraste suit le sens physiologique de la circulation sanguine. En 1, acquisition sans injection sur les gros vaisseaux thoraciques. Le produit est injecté par une veine du membre supérieur droit. En 2, le produit rejoint la veine cave supérieure (flèche blanche) et opacifie l’atrium droit puis le ventricule droit (non montrés) puis il opacifie l’artère pulmonaire et ses branches (flèche blanche en pointillés). Il passe ensuite dans la circulation pulmonaire puis les veines pulmonaires avant d’opacifier l’atrium et le ventricule gauches. En 3, le produit est éjecté dans l’aorte thoracique ascendante (flèche noire) et descendante (flèche noire en pointillés). Chaque étape correspond à une nouvelle acquisition qui suit la circulation du produit de contraste dans les structures vasculaires.
Dessin : Eléonore Blondiaux.
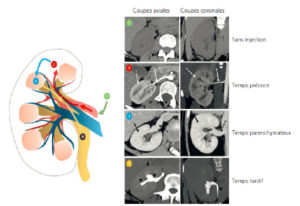
Rehaussement parenchymateux : exemple du rein.
En 1 : acquisition sans injection de produit de contraste. En 2 : à partir de l’aorte, le produit de contraste se distribue aux branches artérielles aortiques : l’artère rénale est opacifiée (flèche blanche) et dans le même temps le cortex rénal (flèche blanche en pointillés). En 3 : le rehaussement parenchymateux (cortex + médullaire) s’effectue selon un délai variable d’un organe à l’autre (flèche noire), le retour veineux s’effectue par la veine rénale (flèche noire en pointillés) et se collecte finalement dans le système cave inférieur. En 4 : l’élimination du produit de contraste est principalement rénale, ce qui permet d’obtenir une opacification des calices et de l’uretère (pointes de flèche).
Dessin : Eléonore Blondiaux.
Lorsque l’objectif est d’obtenir une opacification optimale du réseau artériel, il est courant d’utiliser une technique de suivi du bolus. Il s’agit de la répétition d’une coupe en mode séquentiel à un niveau anatomique donné, de manière à suivre en temps réel l’opacification progressive d’une artère. L’acquisition est déclenchée lorsque la densité au sein de l’artère sélectionnée franchit un seuil de densité Hounsfield prédéfini.
Radioprotection en TDM
Devant le nombre croissant d’examens TDM, le respect des principes de radioprotection détaillés dans le chapitre 6 est fondamental.
Le recours aux explorations utilisant des rayonnements ionisants doit répondre au principe as low as reasonably achievable (ALARA) que l’on peut traduire littéralement par « aussi faible que raisonnablement possible ». En d’autres termes, lorsque le recours à la TDM est nécessaire et justifié, l’examen doit délivrer la dose la plus faible possible permettant de répondre à la question posée. La limitation du nombre de zones anatomiques explorées, la réduction du nombre d’acquisitions à différents temps après une injection de produit de contraste et l’adaptation des paramètres d’acquisition permettent de limiter la dose délivrée. Ces principes s’appliquent avec d’autant plus d’attention chez la femme enceinte et chez l’enfant (voir chapitre 31). La mention de cette dose délivrée au patient sur le compte-rendu de scanner est une obligation médico-légale.
Indications cliniques
Les principales indications de la TDM sont détaillées dans les chapitres suivants, mais on notera en particulier :
- l’exploration du corps entier (crâne au pelvis en général) en urgence des patients polytraumatisés ;
- l’exploration cérébrale : même si l’IRM est à privilégier le plus souvent, sa disponibilité plus faible et la nécessité d’une parfaite immobilité en IRM laissent une place importante à la TDM ;
- l’étude du parenchyme pulmonaire et plus globalement du thorax ;
- l’exploration de l’abdomen, souvent couplée à celle du pelvis ;
- l’exploration du squelette (souvent localisée à une zone d’intérêt) ;
- l’exploration du réseau vasculaire ;
- la radiologie interventionnelle guidée par TDM : de multiples acquisitions centrées sur la zone d’intérêt sont alors réalisées au cours d’un geste diagnostique (biopsie, etc.) ou thérapeutique (infiltration, drainage, destruction de tumeur) par voie percutanée.
Conclusion
Les progrès technologiques de la TDM permettent de réaliser en routine des acquisitions de volumes importants en quelques secondes reconstruits en coupes inframillimétriques. La diffusion de cette technique la rend facilement disponible, en particulier dans le cadre de l’urgence.
Néanmoins, son accès aisé tend à accroître le nombre d’examens avec un impact non seulement économique participant à l’augmentation des dépenses de santé (voir chapitre 14), mais également en termes dosimétriques (environ trois quarts de la dose effective annuelle sont délivrés à la population par les 10 % des examens d’imagerie médicale que représente la TDM – voir chapitre 6). La demande d’examens complémentaires doit donc toujours être guidée par l’examen clinique, une exploration en imagerie ne devant en principe pas être effectuée avant une évaluation clinique.
L’examen TDM nécessitant fréquemment une injection de produit de contraste iodé, la recherche de contre-indications lors de la prescription et celle de complications après la réalisation de l’examen doivent être systématiques.
Essentiel à retenir
- Modalité d’imagerie en coupes : multiples projections angulaires autour du patient ; reconstructions informatiques (imagerie numérique) ; acquisitions volumiques : post-traitement de l’image (reconstruction MPR par exemple).
- Utilisation de rayons X : interaction avec le milieu traversé selon les densités rencontrées ; terrains particuliers : grossesse, pédiatrie.
- Examen accessible et rapide : apnée souvent nécessaire, coopération du patient nécessaire ; exploration multiphasique en quelques minutes (quelques secondes par acquisition) ; modalité d’imagerie de choix en situation urgente ;
- Prescription médicale par le radiologue indispensable : guidée par l’examen clinique (cibler la recherche, question précise) ; contre-indications : produits de contraste, grossesse ; complications liées à l’injection : allergie, dysthyroïdie, néphrotoxicité ; aide pour la demande des examens d’imagerie : Guide du bon usage (http://gbu.radiologie.fr/).
Références
- Comité interdisciplinaire de recherche et de travail sur les agents de contraste en imagerie (CIRTACI), pour la SFR. Fiches pratiques pour l’utilisation des produits de contraste [Internet], 2004. www.sfrnet.org http://www.sfrnet.org/sfr/societe/5-groupes-de-travail/qualite-securite-gestion-des-risques/agents-de-contraste-cirtaci/index.phtml.
- Ring J, Messmer K. Incidence and severity of anaphylactoid reactions to colloid volume substitutes. Lancet 1977 ;1:466–9.
 |
Chapitre suivant |
 |
Retour au sommaire |
