Les fondamentaux de l’imagerie médicale (accès public)
Les collèges des enseignants de Radiologie (CERF), de médecine nucléaire (CNEBMN) et d’anatomie (CMFPA) mettent à disposition des enseignants et des étudiants de DFGSM un référentiel des notions d’imagerie médicale fondamentales à connaître en fin de premier cycle.
Ce référentiel présente les bases techniques, la radio anatomie et la sémiologie élémentaire en imagerie.
Les fondamentaux de l’imagerie médicale – Radioanatomie, biophysique, techniques et séméiologie en radiologie et en médecine nucléaire (2e édition)
Sous l’égide du :
- Collège Médical Français des Professeurs d’Anatomie
- Collège des Enseignants de Radiologie de France
- Collège National des Enseignants de Biophysique et de Médecine Nucléaire
Coordonnée par :
- E. Blondiaux (CERF),
- E. Durand (CNEBMN)
- M. Montaudon (CMFPA)
Table des matières
Terminologie en imagerie. XVII
Partie I - Introduction
Chapitre 1 : Histoire de l'imagerie médicale (F. Brunotte, P. Devred).
Chapitre 2 : Caractéristiques d'une image médicale (E. Durand, E. Blondiaux).
- Numérisation, pixels, voxels.
- Résolution spatiale.
- Bruit.
- Contraste.
- Images en projection et images en coupes.
- Présentation et orientation des images.
- Archivage.
Partie II - Méthodes
Section A : Acquisition.
Chapitre 3 : Radiographie (P.A. Gondim Teixeira, G. Grimon).
- Introduction.
- Principes fondamentaux.
- Détection des rayons X transmis, fabrication de l'image radiographique.
- Représentation des images.
- Artefacts et distorsion de l'image.
- Indications et limites.
- Conclusion.
Chapitre 4 : Tomodensitométrie (TDM) (F. Pontana, B. Longère, A. Lalande).
- Introduction.
- Principes de base.
- Formation de l'image.
- Principaux artefacts.
- Produits de contraste.
- Radioprotection en TDM.
- Indications cliniques.
- Conclusion.
Chapitre 5 : Médecine nucléaire (V. Lebon).
- Introduction.
- Médicaments radiopharmaceutiques (MRP).
- Instrumentation.
Chapitre 6 : Notions de radioprotection (G. Bonardel, J.-F. Chateil).
- Fondements de la radioprotection.
- Mise en œuvre pratique de la radioprotection.
- Informations à délivrer aux patients.
- Conclusion.
Chapitre 7 : Échographie (F. Patat, M. Ronot).
- Notion d'onde mécanique.
- Principes de l'échographie.
- Bases sémiologiques du mode B.
- Modes Doppler.
- Agents de contraste échographiques.
- Bases technologiques.
- Conclusion.
Chapitre 8 : Imagerie par résonance magnétique (T. Tourdias, V. Lebon).
- Le phénomène de résonance magnétique nucléaire.
- Principes de localisation du signal en IRM.
- Les principales séquences d'IRM.
- Agents de contraste en IRM.
- Réalisation pratique d'un examen IRM.
Section B : Reconstruction de l'image.
Chapitre 9 : Reconstruction tomographique (F. Ben-Bouallègue, E. Durand, D. Mariano-Goulart).
- Introduction.
- Notion de projection.
- En tomoscintigraphie.
- En tomodensitométrie.
- Problème direct – problème inverse.
- Résolution du problème inverse en résolvant le système d'équations.
- Rétroprojection.
Chapitre 10 : Traitement de l'image reconstruite (A. Blum).
- Introduction.
- Reconstructions d'acquisitions volumiques.
- Recalage, soustraction, fusion.
- Réalité augmentée.
- Conclusion.
Section C : Analyse de l'image.
Chapitre 11 : Perception de l'image (J.-Y. Devaux, D. Galanaud, F. Brunotte).
- Étapes de la perception visuelle.
- Particularités normales de la vision susceptibles d'interférer avec la perception des images.
- Limitations de perception visuelle liées au vieillissement physiologique ou à des maladies de l'observateur.
- Conséquences pour l'analyse des images.
- Conclusion.
Chapitre 12 : Erreurs en imagerie médicale (L. Arrivé).
- Introduction.
- Erreurs procédurales.
- Erreurs de détection.
- Erreurs d'interprétation.
- Erreurs de communication.
- Solutions d'amélioration.
Section D : Considérations pratiques.
Chapitre 13 : Demande et compte-rendu des examens d'imagerie (J.-P. Beregi, F. Le Jeune).
Demande des examens d'imagerie.
- Introduction.
- Notion de pertinence.
- Résumé clinique.
Compte-rendu des examens d'imagerie.
- Introduction.
- Évolution des comptes-rendus de radiologie et de médecine nucléaire.
- Annonce du résultat.
- Conclusion.
Chapitre 14 : Coûts des examens de radiologie et de médecine nucléaire en France (V. Hazebroucq, J.-P. Beregi).
Section E : Thérapeutique.
Chapitre 15 : Radiologie interventionnelle (P. Chabrot).
- Introduction.
- Consultation pré-interventionnelle.
- Modalités de guidage.
- Techniques élémentaires.
- Conclusion.
Chapitre 16 : Radiothérapie interne vectorisée (C. Lussey-Lepoutre, E. Deshayes).
- Introduction et principes généraux.
- Particularités de radioprotection.
- Applications.
- Radiothérapie interne sélective (RIS).
Partie III - Séméiologie en imagerie des processus physiopathologiques
Chapitre 17 : Processus tumoraux (F. Cachin, L. Fournier).
- Définition et rôle de l'imagerie : détection et caractérisation.
- Imagerie du syndrome tumoral.
- Bilan d'extension.
- Suivi des traitements.
Chapitre 18 : Processus inflammatoires (G. Bierry, C. Blondet, F. Besson).
- Physiopathologie de l'inflammation.
- Phase initiale : oedème.
- Phase séquellaire : fibrose.
- Médecine nucléaire.
Chapitre 19 : Processus infectieux (C. Blondet, G. Bierry).
- Introduction.
- Phase initiale : oedème.
- Phase d'état : abcès.
- Phase séquellaire : modifications structurelles.
-
Médecine nucléaire.
Chapitre 20 : Processus ischémiques (P.M. Walker, A. Redheuil).
- Ischémie : définition et mécanismes.
- Imagerie des processus ischémiques.
Chapitre 21 : Processus hémorragiques (O. Chevallier, R. Loffroy).
- Introduction.
- Imagerie des processus hémorragiques.
- Conclusion.
Partie IV - Séméiologie par organes
Chapitre 22 : Imagerie ostéoarticulaire (G. Bierry, E. Rust).
- Connaître les principaux avantages, limites et indications des examens d'imagerie.
- Reconnaître les principales anomalies en imagerie.
Chapitre 23 : Imagerie du système nerveux central (A. Chammas, S. Kremer, F. Le Jeune).
- Radioanatomie.
- Techniques d'exploration neurologique en radiologie et en médecine nucléaire.
- Sémiologie normale et éléments de sémiologie pathologique.
- Séméiologie pathologique élémentaire en fonction des principaux syndromes.
Chapitre 24 : Imagerie oto-rhino-laryngologique (S. Molière, S. Cahen-Riehm, R. Abgral).
- Introduction.
- Imagerie de l'oreille et de l'os temporal.
- Imagerie cervicofaciale non oncologique.
- Imagerie morphologique des cancers des VADS.
- Imagerie moléculaire des cancers des VADS : TEP au 18F-FDG.
Chapitre 25 : Imagerie thoracique (M. Ohana, G. Ferretti, M. Montaudon, P.-Y. Le Roux).
- Radiographie du thorax.
- Tomodensitométrie thoracique.
- Scintigraphie pulmonaire de ventilation-perfusion.
- TEP-TDM au 18F-FDG.
Chapitre 26 : Imagerie cardiovasculaire (A. Cochet, D. Mandry).
- Introduction.
- Techniques d'imagerie.
- Grands syndromes et leurs moyens d'exploration.
Chapitre 27 : Imagerie de l'abdomen (O. Lucidarme, D. Kharroubi).
- Connaître les techniques d'imagerie de l'abdomen et pouvoir les expliquer au patient.
- Séméiologie de base en imagerie abdominale.
- Principales indications en imagerie abdominale.
- Description et indications des examens de médecine nucléaire.
Chapitre 28 : Imagerie de l'appareil urogénital (R. Renard-Penna, E. Durand).
- Technique et séméiologie en imagerie.
- Grands syndromes cliniques.
Chapitre 29 : Imagerie des seins et du pelvis féminin (I. Thomassin-Naggara, O. Humbert).
- Gynécologie.
- Sénologie.
Chapitre 30 : Imagerie des glandes endocrines (F.-Z. Mokrane, D. Taïeb).
- Thyroïde.
- Parathyroïdes.
- Surrénales.
- Pancréas.
Chapitre 31 : Imagerie pédiatrique (E. Blondiaux , C. de Labriolle-Vaylet et I. Keller-Petrot)
- Imagerie pédiatrique (E. Blondiaux, C. de Labriolle-Vaylet, I. Keller-Petrot).
- Radioprotection.
- Ostéoarticulaire.
- Système nerveux central.
- Abdomen.
- Appareil urinaire.
- Foetus.
- Thorax.
- Communication.
Les fondamentaux - Chapitre 31 - Imagerie pédiatrique
E. Blondiaux , C. de Labriolle-Vaylet et I. Keller-Petrot
Plan du chapitre
- Radioprotection
- Ostéoarticulaire
- Système nerveux central
- Abdomen
- Appareil urinaire
- Fœtus
- Thorax
- Communication
Objectifs
- Radioprotection :
- connaître la vulnérabilité des enfants aux radiations ionisantes ;
- connaître les indications des différentes modalités et leur pertinence en fonction de l'indication et de l'âge de l'enfant.
- Ostéoarticulaire :
- connaître les particularités anatomiques du squelette de l'enfant ;
- avoir des notions en radiologie conventionnelle de croissance et de maturation osseuse ;
- connaître les principales méthodes de détermination de la maturation osseuse ;
- reconnaître les signes en faveur d'une fracture chez un enfant.
- Neurologie :
- connaître les indications et les limites de l'échographie et de l'imagerie par résonance magnétique (IRM) dans l'exploration de l'encéphale et de la moelle chez le nourrisson.
- Digestif :
- connaître les indications et les limites de l'échographie, de la tomodensitométrie (TDM), de l'IRM et des opacifications digestives dans l'exploration de l'abdomen de l'enfant ;
- connaître l'intérêt de l'échographie dans l'exploration du tube digestif de l'enfant.
- Urinaire :
- connaître les particularités de l'échographie urinaire de l'enfant.
- Fœtus :
- connaître les différentes modalités d'imagerie pour l'exploration du fœtus.
- Thorax :
- reconnaître la présence du thymus sur une radiographie du thorax.
- Communication :
- expliquer à l'enfant ou l'adolescent et à ses parents les modalités de réalisation des examens, à partir de notion de durée, de contention, de sédation et d'analgésie, de risque lié à l'exposition aux rayonnements ionisants ;
- établir une relation de confiance avec l'enfant et ses parents en vue de la réalisation de l'examen.
L'imagerie chez l'enfant est différente de l'imagerie chez l'adulte car elle s'adresse à un organisme en développement et en transformation constante.
L'interprétation d'un examen est nuancée par l'âge et par le contexte clinique, dont l'intérêt est primordial en imagerie pédiatrique. De façon conventionnelle, les définitions utilisées en fonction de l'âge de l'enfant sont les suivantes :
- nouveau-né : des premières heures de vie au 28e jour de vie ;
- nourrisson : du 28e jour de vie à 2 ans ;
- enfant : de 2 ans à l'adolescence ;
- adolescent : entre 10–12 ans jusqu'à 18 ans.
Nous abordons dans ce chapitre les notions importantes de radioprotection, de réalisation des examens ainsi que certaines spécificités de l'imagerie pédiatrique en radiologie et en médecine nucléaire.
Radioprotection
Les principes de base de la radioprotection que sont la justification des examens et leur optimisation doivent être appliqués en pédiatrie avec beaucoup de rigueur, la radiosensibilité des enfants étant plus grande que celle des adultes. Les cellules en croissance rapide seraient en effet plus radiosensibles que les cellules quiescentes (voir chapitre 6). En médecine nucléaire, intervient aussi le rôle de la proximité des organes les uns par rapport aux autres ; une activité volumique vésicale identique entraîne une dose à la moelle plus élevée chez l'enfant que chez l'adulte, du fait d'une distance plus faible. Le risque aléatoire de cancer à long terme est lié aux effets stochastiques des examens exposants aux rayonnements ionisants (RI) (radiographie, TDM et médecine nucléaire). Ces effets sont extrêmement faibles en imagerie diagnostique, mais plus l'espérance de vie est longue, plus le risque qu'ils se manifestent augmente.
Quelle que soit leur spécialité, tous les médecins sont susceptibles, au cours de leur formation ou de leur pratique, d'être un jour demandeurs d'un examen d'imagerie pour un enfant. Le principe de justification les concerne donc tous. Un examen utilisant des RI ne doit être réalisé, notamment chez l'enfant, que s'il modifie la prise en charge et qu'il n'existe pas d'examen non irradiant susceptible de fournir la même information. Le choix de l'examen d'imagerie le plus approprié à la question posée et à l'état de l'enfant est sous la responsabilité légale du radiologue ou du médecin nucléaire (prescripteur de l'examen), sur la base des informations qui lui sont fournies, par écrit, par le clinicien demandeur qui a l'obligation de s'identifier lisiblement pour permettre d'éventuelles discussions. Le Guide d'aide à la demande d'examens de radiologie et d'imagerie médicale (ADERIM, aderim.radiologie.fr) a été établi pour guider les cliniciens dans le choix des examens d'imagerie adaptés à la situation clinique.
L'optimisation de l'examen relève du prescripteur, puisqu'il s'agit de réaliser un examen de la meilleure qualité possible, délivrant une dose aussi faible que possible. Le choix du spécialiste portera sur le matériel employé, sur le protocole de réalisation et le choix des paramètres d'acquisition des examens, en tenant compte des recommandations internationales quand elles existent. En pédiatrie, il faut tenir compte aussi de la capacité de participation de l'enfant. La sédation est parfois nécessaire en radiologie, adaptée à l'âge. Les méthodes suivantes peuvent être utilisées : biberon avant 6 mois, sédation consciente médicamenteuse gérée par les radiologues ou les anesthésistes entre 6 mois et 3 ans, puis distraction au-delà de 3 à 5 ans. La prise en compte de la douleur est un impératif facilitant l'obtention de l'immobilité. Celle-ci est importante pour obtenir des clichés de bonne qualité et respecter les règles en matière de radioprotection en évitant de répéter les clichés de qualité insuffisante parce que l'enfant a bougé. Son obtention est facilitée en pédiatrie par une contention douce mais ferme (figure 31.1).
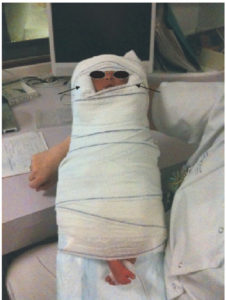
Emmaillotage par des bandes Velpeau® en IRM chez un nourrisson préalablement endormi avec un biberon.
Les coussins de part et d'autre des oreilles assurent la protection auditive (flèches noires).
Ostéoarticulaire
Un os en croissance
Le développement du squelette fait appel à deux mécanismes : la croissance et la maturation osseuses.
Croissance osseuse
La croissance osseuse se fait à la fois en longueur, à partir du cartilage de croissance, et en largeur, à partir du périoste (figure 31.2).
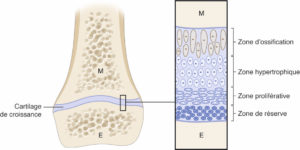
Représentation schématique de l'os en croissance.
E : épiphyse ; M : métaphyse.
Dessin : Cyrille Martinet.
Le cartilage de croissance (synonymes : physe, cartilage de conjugaison) est situé entre la métaphyse et l'épiphyse. Il est constitué de quatre couches, depuis l'épiphyse jusqu'à la métaphyse : les zones de réserve, proliférative, hypertrophique et d'ossification. La partie la plus fragile est celle située entre la zone d'ossification du cartilage de croissance et la métaphyse. Les fractures surviennent plus fréquemment à cet endroit. Les cartilages les plus actifs se situent près du genou et loin du coude. Comme la maquette cartilagineuse des épiphyses des os longs, le cartilage de croissance n'est pas radio-opaque. La fermeture du cartilage de croissance est une étape importante, car elle est le signe que la croissance est terminée.
Le périoste est très résistant. Il n'est pas visible en radiographie, sauf après son agression (traumatisme, infection, tumeur, etc.) lorsqu'une ossification du périoste ou apposition périostée apparaît (figure 31.3).
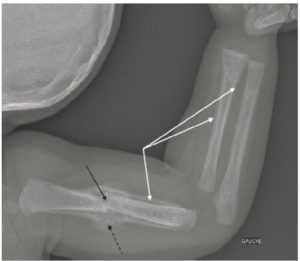
Radiographie de l'humérus et de l'avant-bras gauches de profil chez une enfant de 2 ans montrant des fractures multiples dans un contexte de traumatisme non accidentel.
Il existe une fracture du tiers moyen de la diaphyse humérale gauche (flèche noire) avec un cal osseux (flèche noire en pointillés) et des appositions périostées (flèches blanches) au niveau de l'humérus et du radius.
Maturation osseuse
La maturation osseuse se fait à partir de l'ossification de pièces cartilagineuses du squelette soit par ossification enchondrale pour les os longs, soit par ossification membraneuse pour les os plats. La maturation osseuse se déroule schématiquement en trois étapes :
- prénatale : ossification des maquettes cartilagineuses et diaphysaires ;
- enfance : tarse, carpe, épiphyses des os longs et voûte du crâne ;
- adolescence : fermeture physiologique des cartilages de croissance.
À la naissance, le carpe, le tarse et la plupart des épiphyses des os longs sont essentiellement constitués de cartilage, dont la tonalité est hydrique en radiographie. Cette maquette cartilagineuse, non visible sur une radiographie, s'ossifie progressivement, à partir de noyaux d'ossification. À la fin de la croissance, toute la maquette cartilagineuse a disparu ; elle est entièrement ossifiée (figure 31.4). Les os du crâne répondent à une double ossification, enchondrale au niveau de la base et de membrane (sutures) au niveau de la voûte.
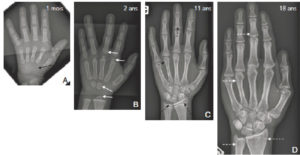
Ossification progressive du carpe et des épiphyses métacarpo-phalangiennes sur des radiographies de la main et du poignet gauches de face chez un nourrisson de 1 mois (A), un enfant de 2 ans (B), un adolescent de 11 ans (C) et un adulte de 18 ans (D).
À la naissance, le carpe n'est jamais ossifié : la maquette cartilagineuse est de tonalité hydrique et n'est donc pas visible directement sur une radiographie (flèche noire). Progressivement, le carpe et les épiphyses vont s'ossifier à partir des noyaux d'ossification (flèches blanches). Le cartilage de croissance reste radiotransparent tant que la croissance n'est pas terminée (flèches noires en pointillés). La fermeture du cartilage de croissance signe la fin de la croissance (flèches blanches en pointillés).
Les étapes relativement stéréotypées d'apparition progressive des noyaux d'ossification permettent d'estimer l'« âge du squelette » ou « âge osseux ». Ces étapes variant normalement peu d'un enfant à l'autre, il est possible de déterminer si un enfant présente une avance ou un retard de maturation osseuse. Les principales méthodes d'évaluation de la maturation osseuse sont les suivantes :
- avant 6 mois : comptage des points d'ossification sur des radiographies du membre supérieur et du membre inférieur ;
- à tout âge : évaluation de la présence et de la morphologie des épiphyses et des métaphyses sur une radiographie de la main et du poignet gauches ;
- adolescence : évaluation du noyau d'ossification secondaire des crêtes iliaques (figure 31.5). L'apparition du point d'ossification iliaque se fait vers 13–14 ans chez les filles et 15–16 ans chez les garçons. La fin de l'ossification de ce point complémentaire et la fusion complète avec l'aile iliaque se font en général en 3 ans. L'ossification et la fusion de la crête iliaque permettent un suivi de la maturation osseuse dans la surveillance de la scoliose (ce d'autant qu'il est visible sur les radiographies de rachis de surveillance de la courbure).
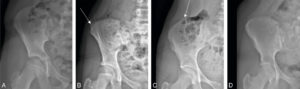
Méthode d'évaluation de l'âge osseux chez l'adolescent : radiographie de l'aile iliaque pour le test de Risser.
Le point iliaque n'est pas ossifié chez une fille de 10 ans : Risser 0 (A). Le point d'ossification est visible sur le versant latéral de l'aile iliaque chez une adolescente de 12 ans : Risser 1 (flèche) (B). Le point d'ossification se prolonge sur le versant médial de l'aile iliaque chez une adolescente de 13 ans : Risser 4 (C). Il est enfin complètement fusionné chez une adolescente de 16 ans : Risser 5 (D), signant la fin de la croissance.
Reconnaître une fracture chez un enfant
Quelles incidences faut-il réaliser ?
- La réalisation d'une radiographie dans deux plans orthogonaux est nécessaire pour mettre en évidence une fracture d'un os long (figure 31.6).
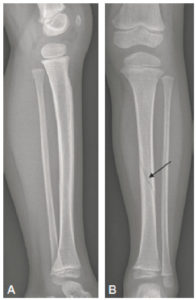
Radiographies de la jambe gauche chez une enfant de 3 ans montrant l'intérêt de réaliser deux incidences orthogonales.
La fracture spiroïde de la diaphyse tibiale est difficile à discerner sur le cliché de profil (A), alors qu'elle est parfaitement visible sur le cliché de face (B) (flèche).
- Les clichés de trois-quarts ne seront réalisés que si une fracture est fortement suspectée et non objectivée sur les radiographies de face et de profil.
- Les radiographies comparatives des membres sont le plus souvent inutiles dans le cadre d'une suspicion de fracture. Les ouvrages de référence sur la maturation du squelette de l'enfant et sur les variantes du normal permettent d'éviter une irradiation inutile sur des membres ou segments de membre a priori indemnes.
Particularités des fractures de l'enfant
Les traits de fracture transversaux, obliques, spiroïdes, comminutifs sont identiques à ceux de l'adulte. Certaines fractures sont propres à l'enfant, parmi lesquelles : la fracture en motte de beurre (plicature d'une corticale métaphysaire), en bois vert (fracture diaphysaire, une corticale étant rompue et l'autre continue), plastique (courbure de tout l'os, le plus souvent, la fibula ou l'ulna) (figure 31.7). La fracture sous-périostée ou en cheveu survient le plus souvent au niveau des membres inférieurs chez l'enfant autour de 2 ans et peut ne pas être visible sur la radiographie initiale.
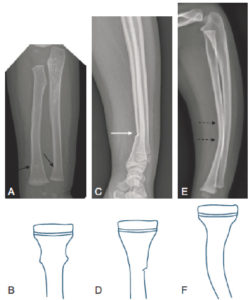
Radiographies et représentation schématique des fractures spécifiques de l'enfant.
A, B. Fracture en motte de beurre métaphysodiaphysaire distale du radius et de l'ulna droits chez un nourrisson de 18 mois (flèches noires). C, D. Fracture en bois vert diaphysaire distale du radius chez un enfant de 14 ans (flèche blanche). E, F. Fracture plastique du radius, sans luxation de la tête radiale, chez un enfant de 4 ans (flèches en pointillés).
Les fractures épiphyso-métaphysaires sont classées en fonction de la classification de Salter et Harris et du risque ultérieur de séquelles (figure 31.8). Leur point commun est qu'elles débutent toutes au sein du cartilage de croissance. Une complication rare mais grave de ces fractures propres à l'enfant est la survenue d'un arrêt de croissance anormal du fait de la création d'un pont osseux entre l'épiphyse et la métaphyse ou pont d'épiphysiodèse. Il peut en résulter une perte de longueur (figure 31.9) ou une désaxation en fonction du siège central ou latéral de ce pont.
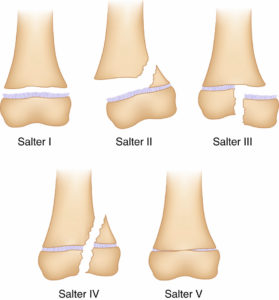
Classification de Salter et Harris des fractures épiphysométaphysaires.
Source : Skirven TM, Osterman AL, Fedorczyk J, et al. (Eds.). Rehabilitation of the Hand and Upper Extremity, 2-Volume Set, Seventh Edition. © Elsevier 2021.
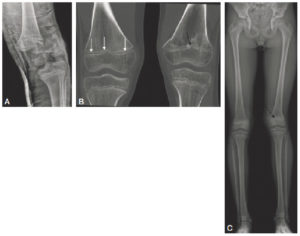
Fracture passant par le cartilage de croissance.
Sur la radiographie réalisée le jour du traumatisme chez un enfant de 11 ans (A), mise en évidence d'une fracture passant par le cartilage de croissance fémoral distal gauche avec déplacement important. Sur la TDM réalisée chez le même enfant un an après la fracture (B, reconstructions en coupe coronale des deux genoux) : à droite, le cartilage de croissance fémoral distal est normal (flèches blanches) ; à gauche : visibilité d'un pont d'épiphysiodèse (flèche noire). Sur la radiographie des deux membres inférieurs réalisée en position debout 2 ans après le traumatisme (C) : fermeture prématurée du cartilage de croissance fémoral distal gauche (flèche en pointillés) et inégalité de longueur des membres avec un raccourcissement du fémur gauche.
Fracture non visible sur la radiographie
Une fracture par torsion peut rompre les fibres osseuses sans qu'il y ait de séparation des fragments, qui sont plaqués les uns contre les autres par le périoste de l'enfant, particulièrement élastique et résistant. Une fracture sous-périostée ou en cheveu peut ne pas être visible sur la radiographie initiale. La répétition de clichés radiographiques 10 jours plus tard, quand les signes de réparation osseuse deviennent visibles, ou la réalisation d'une scintigraphie osseuse, qui visualise le renouvellement osseux en montrant une hyperfixation de la diaphyse, permettent d'établir le diagnostic (figure 31.10).
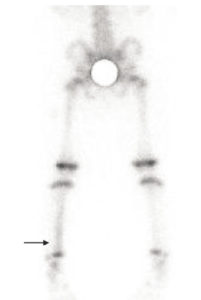
Chez un enfant de 18 mois boitant depuis une semaine, visibilité sur le cliché scintigraphique en incidence postérieure sur les membres inférieurs, 2 heures après l'injection d'un diphosphonate marqué au 99mTc, d'une hyperfixation des deux tiers inférieurs de la diaphyse tibiale gauche (flèche noire).
C'est l'aspect scintigraphique très évocateur de fracture en cheveu. Plus la fracture est récente, plus l'hyperfixation est intense.
Le recours à l'IRM est rarement nécessaire dans les situations orthopédiques courantes.
Dans le contexte d'une suspicion de maltraitance, scintigraphie et radiographie se complètent pour une évaluation de fractures multiples et d'âges différents.
Concernant les diagnostics différentiels, dont la suspicion d'infection ostéoarticulaire, nous vous invitons à vous référer aux chapitres 19 et 22.
Système nerveux central
Chez le nouveau-né, l'absence d'ossification des fontanelles et de la synchondrose entre les deux hémi-arcs postérieurs des vertèbres permet d'examiner en échographie le cerveau et la moelle avec une excellente résolution spatiale et sans sédation.
Échographie transfontanellaire (ETF)
L'ETF est réalisée en posant la sonde d'échographie sur la fontanelle antérieure. Elle permet de bien visualiser les ventricules latéraux, la substance blanche ainsi que la ligne médiane du prématuré et du nouveau-né à terme (figure 31.11). En revanche, l'exploration des zones latérales et de la fosse postérieure est limitée par la voûte du crâne. Cette échographie n'est pas réalisable au-delà du premier mois de vie car la fontanelle antérieure devient rapidement trop étroite pour laisser passer le faisceau ultrasonore. L'ETF est utile pour le dépistage des hémorragies péri- et intraventriculaires ainsi que des anomalies de la substance blanche comme la leucomalacie périventriculaire chez le nouveau-né prématuré. Une exploration plus précise des espaces péricérébraux, de la substance blanche ou de la substance grise, de la fosse postérieure est réalisée en IRM cérébrale, réalisable dès la période néonatale.
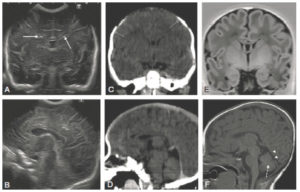
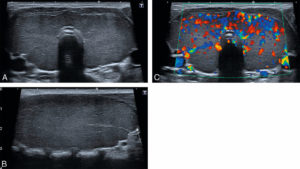
Comparaison des différentes techniques d'imagerie pour l'exploration du cerveau chez le nouveau-né.
L'échographie (A, B) permet de visualiser le parenchyme cérébral et les ventricules (flèches blanches), mais les régions pariétales et la fosse postérieure sont mal identifiées. En TDM (C, D), la voûte du crâne et les espaces péricérébraux sont bien explorés (flèches grises). En IRM, sur une séquence pondérée en T1 avec inversion récupération (E), la différenciation substance blanche-substance grise, et sur une séquence pondérée en T1 (F), la fosse postérieure avec le vermis (flèche blanche en pointillés), le tronc cérébral et la tente du cervelet (têtes de flèche) sont bien identifiés.
Échographie médullaire
Le nouveau-né est placé en décubitus ventral. Il est possible de réaliser des coupes sagittales et axiales du canal vertébral et de son contenu. La morphologie et la position du cône terminal, du filum terminal (la corde d'amarrage du cône terminal), des racines de la queue de cheval et des espaces périmédullaires (figure 31.12) sont identifiables échographiquement. Les principales indications de l'échographie médullaire sont les anomalies cutanées au niveau lombosacré (fossette sacrococcygienne, touffe de poils, angiome, pertuis cutané), qui représentent des signes évocateurs d'anomalie de fermeture du tube neural. Au-delà du premier mois de vie, les arcs postérieurs des vertèbres s'ossifient et l'échographie médullaire ne peut plus être réalisée. Une exploration complémentaire de la moelle, du cul-de-sac dural et des espaces périmédullaires peut être réalisée en IRM médullaire.
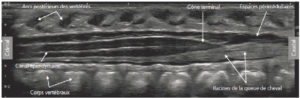
Échographie médullaire chez un nouveau-né de 15 jours dans le plan sagittal montrant le contenu du canal vertébral à l'étage dorsolombaire.
Abdomen
Échographie
Chez l'enfant, l'échographie est l'examen de première intention pour explorer l'abdomen, car la faible épaisseur du tissu graisseux et musculaire de la paroi abdominale de l'enfant permet d'explorer l'abdomen dans son ensemble avec une grande précision. De plus, l'échographie a l'avantage d'être non irradiante, non invasive et rapide à mettre en œuvre, ne nécessitant pas de préparation particulière. Le diagnostic étiologique des douleurs abdominales ou des occlusions comme la sténose hypertrophique du pylore, le volvulus du grêle (torsion de la masse des anses grêles libres sur son mésentère avec non seulement un arrêt du transit, mais également de la vascularisation et un risque majeur de nécrose de l'intestin grêle) ou l'invagination intestinale aiguë est le plus souvent réalisé en échographie. La paroi intestinale, avec ses différentes couches muqueuse, sous-muqueuse et séreuse, est identifiable en échographie avec des sondes de haute fréquence. Cela permet de diagnostiquer, entre autres, une appendicite aiguë (figure 31.13), les maladies inflammatoires ou infectieuses de la paroi intestinale (maladie de Crohn, etc.)
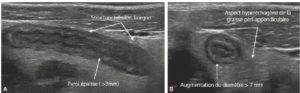
Échographie abdominale d'une appendicite aiguë non compliquée chez un enfant de 14 ans avec une coupe longitudinale (A) et axiale de l'appendice (B).
Radiographie d'abdomen sans préparation
La radiographie d'abdomen sans préparation (ASP) ne conserve que quelques indications chez l'enfant : recherche de signes en faveur d'une occlusion, recherche de perforation digestive (air libre dans le péritoine – pneumopéritoine) et recherche de corps étranger radio-opaque ou d'opacités calciques (calculs des voies urinaires). La séméiologie de l'ASP en position couchée doit être connue car la radiographie d'ASP est souvent réalisée en décubitus en pédiatrie, en particulier en période néonatale. Le pneumopéritoine n'apparaît pas sous la forme d'un croissant gazeux sous les coupoles diaphragmatiques sur un cliché en position couchée, mais sous la forme d'une clarté centrale péri-ombilicale, moulant les anses digestives et le ligament falciforme (figure 31.14). L'occlusion digestive d'origine mécanique sur le cliché en décubitus dorsal apparaît sous la forme d'une distension des anses digestives et d'une absence d'aération des anses en aval (au-delà des premières heures de vie).
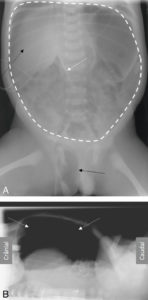
Pneumopéritoine chez un nouveau-né prématuré en position couchée sur une radiographie d'abdomen de face (A) et de profil avec rayon horizontal (B).
Pneumopéritoine visible en A sous la forme d'une hyperclarté pré-hépatique (flèche noire en pointillés), d'une clarté centrale (contourée par la ligne blanche en pointillés) moulant le ligament falciforme (flèche blanche) associée à la présence d'air dans le scrotum (flèche noire). Le pneumopéritoine est visible en B sous la forme d'un croissant gazeux sous la paroi abdominale (flèches blanches en pointillés).
Opacifications digestives
L'opacification digestive permet d'évaluer la topographie, la morphologie et la cinétique de progression du produit de contraste dans le tube digestif. Seul l'intérieur du tube digestif est visualisé. S'il existe un obstacle intrinsèque complet comme une atrésie, il se traduira par une interruption de la progression du produit de contraste. S'il existe une compression extrinsèque, elle se traduira par une déformation des bords du tube digestif. Ce type d'examen vient en complément des explorations radiographiques standard ou échographiques. En fonction de la partie du tube digestif que l'on veut explorer et du contexte clinique, le radiologue peut choisir entre deux types de produit de contraste : baryte, à base de sulfate de baryum, ou produit de contraste à base d'iode. Les opacifications digestives les plus couramment réalisées en pédiatrie sont :
- transit œso-gastro-duodénal (TOGD) et transit du grêle : on fait boire ou on administre par la sonde nasogastrique un produit de contraste qui permet d'opacifier ces différentes structures anatomiques afin de juger de leur morphologie et de la progression du produit de contraste ;
- lavement opaque : après mise en place d'une canule rectale, le rectum, puis l'ensemble du côlon jusqu'à la valvule iléocæcale et les dernières anses iléales sont opacifiés.
TDM abdominale
En raison de son caractère irradiant, mais également du fait d'interfaces graisseuses peu nombreuses chez l'enfant par rapport à l'adulte (le tube digestif n'est pas entouré de graisse chez l'enfant), la TDM abdominale a des indications limitées en pédiatrie. Elle est principalement indiquée dans le bilan des tumeurs abdominales de l'enfant et des appendicites aiguës compliquées avant un éventuel drainage percutané.
IRM abdominale
Les indications de l'IRM abdominale chez l'enfant sont en progression. Celle-ci est réalisée chez les enfants suivis pour une maladie inflammatoire du tube digestif, avec la réalisation d'une entéro-IRM pour laquelle un produit sans absorption digestive doit être bu avant l'examen pour distendre les anses digestives.
L'IRM permet de diagnostiquer et de surveiller les anomalies de la paroi intestinale et les fistules anopérinéales. C'est l'outil d'imagerie de référence dans le bilan des pathologies complexes des voies biliaires grâce à l'utilisation de séquences fortement pondérées en T2 qui permettent d'analyser les liquides stagnants. Enfin, pour les enfants suivis pour un cancer solide abdominal (comme un neuroblastome ou un néphroblastome), l'IRM permet le bilan de l'extension tumorale endocanalaire d'un neuroblastome et le suivi locorégional sans exposition aux RI.
Scintigraphie au pertechnétate
En cas de saignement digestif, il peut être indiqué de rechercher un diverticule de Meckel, résidu embryologique du canal omphalomésentérique, par méthode isotopique. Seuls les diverticules tapissés de muqueuse gastrique métaplasique (moins de 50 % des diverticules) sont détectables par cette méthode ; en principe, ce sont ceux qui sont susceptibles de saigner. Le médicament radiopharmaceutique (MRP) injecté (pertechnétate) se fixe sur la muqueuse gastrique qui tapisse le diverticule, et pas sur le reste de l'intestin (figure 31.15), l'intensité du foyer de fixation augmentant parallèlement à l'activité gastrique.
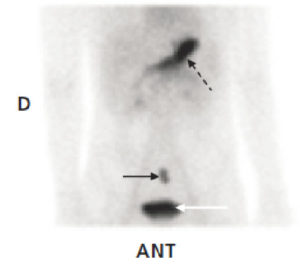
Recherche isotopique de diverticule de Meckel, vue antérieure de l'abdomen.
Le diverticule est le petit foyer indiqué par la flèche noire, qui a concentré le pertechnétate. L'estomac, dont la muqueuse fixe le pertechnétate, est visible (flèche noire en pointillés) comme le diverticule, et en dessous la vessie (flèche blanche), puisque le MRP s'élimine principalement par voie urinaire.
Scintigraphie à la méta-iodobenzylguanidine
Le neuroblastome est la tumeur extracrânienne la plus fréquente de l'enfant de moins 5 ans. La localisation initiale de la tumeur primitive est le plus souvent intra-abdominale. Dans 60 % des cas, la découverte se fait au stade métastatique. Le bilan préthérapeutique comporte une échographie abdominale et, le plus souvent, une TDM sans puis avec injection de produit de contraste. La scintigraphie à la 123I- méta-iodobenzylguanidine (MIBG) est actuellement l'examen de référence pour le bilan d'extension et l'évaluation thérapeutique. Plus de 90 % des neuroblastomes captent la MIBG marquée. Lorsque ce n'est pas le cas, une TEP au 18F-FDG est indiquée.
Appareil urinaire
L'échographie est l'examen de première intention pour l'exploration du rein et des voies urinaires en pédiatrie. Le rein a une forme de haricot. En comparaison de l'échographie rénale de l'adulte, la différenciation corticomédullaire est très bien visualisée chez l'enfant. Cette différenciation correspond à la différence d'échogénicité entre les pyramides rénales (triangulaires à sommet sinusal et hypoéchogènes) et le cortex rénal (plus échogène que les pyramides). Le sinus du rein de l'enfant ne contient pas de graisse, contrairement à l'adulte (figure 31.16). Les calices sont virtuels quand il n'y a pas de dilatation. Le pelvis rénal (pyélon ou bassinet) est visible sur une coupe transversale passant par le hile du rein, sous la forme d'une structure à bords parallèles dirigée en avant et en dedans. Il ne mesure pas plus de quelques millimètres de diamètre antéropostérieur lorsqu'il n'est pas dilaté. L'uretère n'est pas visible en arrière de la vessie ou au niveau lombaire quand il n'est pas dilaté.
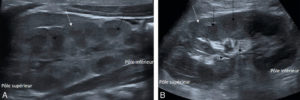
Échographie rénale montrant une coupe sagittale du rein droit en sonde de haute fréquence chez un nouveau-né de 20 jours (A) et de basse fréquence chez une adolescente de 13 ans (B).
La différenciation corticomédullaire est plus facilement identifiée chez le nouveau-né (A) chez lequel les pyramides rénales sont hypoéchogènes (flèches noires) et le cortex est plus hyperéchogène (flèches blanches) que chez l'enfant plus âgé (B). Les cavités intrarénales ne sont pas visibles en l'absence de dilatation. Le sinus du rein est hyperéchogène chez l'adolescente (B) (flèches en pointillés).
Les uropathies sont fréquemment découvertes lors des échographies anténatales. Une dilatation des voies urinaires peut disparaître, persister ou s'aggraver après la naissance. Quelle que soit sa cause (syndrome de jonction pyélo-urétérale, reflux vésico-urétéral, valves de l'urètre postérieur), une dilatation des voies urinaires doit être surveillée afin d'éviter une détérioration de la fonction rénale (figure 31.17). La surveillance est clinique, biologique et échographique en première intention. Lorsque la mesure des fonctions rénales relatives est indiquée, la scintigraphie rénale dynamique (MAG3®) est actuellement l'examen de référence. L'utilisation de l'IRM est en développement dans ce domaine. La recherche de cicatrices rénales se fait par échographie ou, mieux, par scintigraphie du cortex rénal (99mTc DMSA) (figure 31.18), en respectant un délai de 6 mois par rapport à l'épisode infectieux initial.
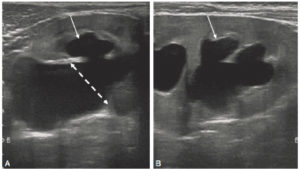
Échographie rénale en coupes axiale (A) et longitudinale (B) montrant une dilatation pyélocalicielle.
Le pyélon est dilaté (double flèche en pointillés) sur la coupe axiale centrée sur le hile du rein. Les calices sont également dilatés (flèches blanches).
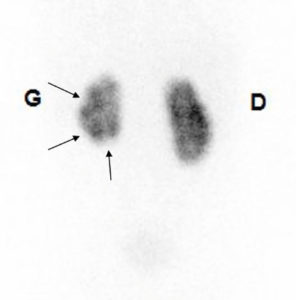
Scintigraphie rénale au 99mTc-DMSA.
Le rein gauche est de de plus petite taille que le rein droit ; il présente un aspect multicicatriciel avec plusieurs petites encoches corticales (flèches).
Fœtus
L'imagerie anténatale permet de surveiller la croissance et le bien-être fœtal ainsi que de dépister certaines malformations. Comme en postnatal, les techniques non irradiantes sont privilégiées.
L'échographie est utilisée en dépistage et pour le diagnostic des anomalies fœtales (figure 31.19). Certaines coupes sur le cerveau, le cœur, le rachis, les membres, l'abdomen et la face sont obligatoires en échographie de dépistage. À partir des mesures du périmètre crânien, du périmètre abdominal et de la longueur fémorale, une estimation du poids du fœtus peut être calculée. Les deux limites principales à l'échographie fœtale sont l'épaisseur de la paroi maternelle et la position du fœtus (par exemple, si le fœtus a le dos en avant, le cœur est plus difficile à examiner).
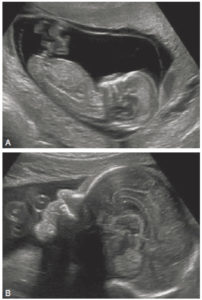
Échographie anténatale chez un fœtus à 12 SA (A) et 31 SA (B) montrant une coupe sagittale médiane de l'ensemble du fœtus à 12 SA et de la face fœtale à 31 SA.
On note qu'à 31 SA, les structures cérébrales sont bien visibles, comme en échographie transfontanellaire en postnatal (voir figure 31.11).
L'IRM est un examen de seconde intention, réalisé le plus souvent lorsqu'il existe une anomalie en échographie (figure 31.20).
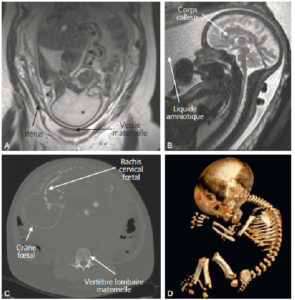
IRM (A, B) et TDM (C, D) fœtales.
Coupe de repérage en IRM montrant l'ensemble du fœtus tête (astérisque) en bas dans l'utérus (A) et coupe sagittale en pondération T2 centrée sur la ligne médiane cérébrale du fœtus (B) (on note un bras en coupe axiale devant les lèvres du fœtus). En TDM, sur les coupes en 2D (C), le squelette fœtal est visible, un peu moins dense que le squelette maternel (vertèbre lombaire) et il est possible de réaliser des reconstructions en 3D de l'ensemble du squelette fœtal, ici dans le cadre d'une suspicion d'achondroplasie (D).
La TDM est rarement utilisée. Elle sert au bilan étiologique et pronostique de maladies osseuses constitutionnelles ou d'anomalies de structures mal explorées en échographie et en IRM comme la voûte du crâne et le bassin. Par ailleurs, la TDM à très basses doses (qui ne permettent pas d'examiner le squelette fœtal) permet d'estimer les dimensions du bassin maternel lorsqu'il existe des facteurs de risque de dystocie ou de disproportion maternofœtale. En fonction des résultats de la pelvimétrie par TDM, l'accouchement est prévu par voie basse ou par césarienne.
La radiographie standard n'est plus utilisée pour l'exploration fœtale.
Thorax
Technique
Jusqu'à 7 ans environ, la radiographie de thorax est réalisée en incidence antéropostérieure (et non postéro-antérieure) pour plusieurs raisons : 1) surveiller chez le tout petit le moment de l'inspiration pour déclencher la prise du cliché ; 2) obtenir un cliché de face stricte (les enfants ont tendance à se retourner pour regarder ce qui se passe derrière eux). Chez l'enfant plus grand, la radiographie est effectuée en incidence postéro-antérieure pour protéger la glande mammaire et la thyroïde du rayon primaire et limiter l'agrandissement photographique.
Chez le nouveau-né, le cliché est réalisé en position allongée. L'incidence de face est le plus souvent suffisante. Le cliché de profil n'est utile que dans trois circonstances : recherche d'adénopathie, de métastase pulmonaire ou de masse thoracique.
Critères de qualité
Les critères de qualité d'une radiographie de thorax chez l'enfant sont les mêmes que chez l'adulte (voir chapitre 25), avec néanmoins quelques différences (figure 31.21). On considère que la radiographie est en bonne inspiration si l'on compte plus de 5 arcs antérieurs au-dessus de la coupole diaphragmatique droite (au lieu de 6 arcs antérieurs et 10 arcs postérieurs chez l'adulte). La silhouette cardiaque semble proportionnellement plus large chez l'enfant que chez l'adulte. Cela est lié à l'incidence antéropostérieure, qui entraîne un facteur d'agrandissement chez l'enfant, et à la présence du thymus visible sur une radiographie jusqu'à l'âge de 6 ans qui élargit le médiastin.
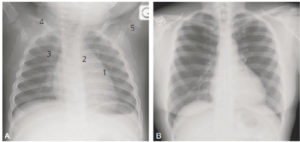
Cinq différences entre la radiographie thoracique d'un nourrisson (A) et celle d'un adulte (B).
Outre l'incidence antéropostérieure responsable d'un certain agrandissement, les différences sont : 1. présence du thymus ; 2. non-visibilité de la crosse aortique ; 3. portion antérieure du gril costal entièrement cartilagineuse, donc non visible sur la radiographie ; 4. courbure claviculaire accentuée du fait de la position des bras au-dessus de la tête ; 5. présence du point d'ossification huméral supérieur.
Il existe quelques particularités de l'image thoracique en pédiatrie à connaître :
- la portion antérieure du gril costal est entièrement cartilagineuse chez l'enfant ; elle n'est donc pas visible sur la radiographie de thorax ;
- trachée : chez le nourrisson, la trachée peut être coudée vers la droite sur un cliché en expiration. À cet âge, la trachée est encore souple et peut être refoulée par la crosse aortique et l'aorte descendante vers la droite. Sur le cliché en inspiration, la trachée redevient normalement rectiligne, discrètement latéromédiane droite. Avec l'âge, la trachée devient plus rigide. Elle doit être rectiligne, y compris sur un cliché en expiration chez l'enfant au-delà de 2–3 ans (figure 31.22) ;
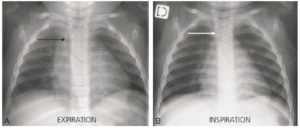
Déviation trachéale physiologique vers la droite chez un nourrisson de 20 mois sur une radiographie de thorax réalisée en expiration (flèche noire) (A).
Sur le cliché en inspiration, la trachée redevient rectiligne (flèche blanche) (B).
- thymus : le thymus est visible sur la radiographie de thorax de l'enfant jusqu'à 6 ans environ. Il se situe dans le médiastin antérieur et supérieur, et se traduit sur la radiographie par une masse de tonalité hydrique, homogène et non compressive effaçant les arcs du médiastin (signe de la silhouette). Les signes suivants sont relatifs à la présence du thymus sur une radiographie thoracique de face (figure 31.23) :
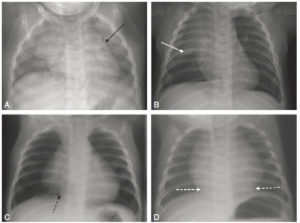
Aspects radiographiques normaux du thymus.
Aspect ondulé des bords du thymus sur un cliché réalisé en expiration (flèche noire) (A) ; aspect en voile latine (flèche blanche) (B) ; extension du thymus jusqu'à la coupole diaphragmatique (flèche noire en pointillés) (C) ; fausse impression de cardiomégalie du fait de l'extension inférieure du thymus (flèches blanches en pointillés) (D).
- signe de la vague : aspect ondulé des bords du thymus du fait de l'impression des arcs costaux antérieurs sur son bord antérieur ;
- incisure cardiothymique : zone de raccordement entre le bord latéral du thymus et le cœur ;
- voile latine : en rapport avec une hypertrophie du lobe droit. Les vaisseaux sont visibles au travers du thymus, ce qui permet de ne pas le confondre avec un foyer de pneumopathie du lobe supérieur droit ;
- extension du thymus jusqu'à la coupole diaphragmatique : elle peut créer une fausse impression de cardiomégalie. La visibilité de la vascularisation normale et la position normale des hiles pulmonaires permettent d'écarter le diagnostic de cardiomégalie.
Communication
En pédiatrie, jusqu'à 12 ans environ, l'interlocuteur principal est le (ou les) parent(s), ce qui n'empêche pas de s'adresser aussi directement à l'enfant. Lorsqu'un enfant est malade, l'inquiétude parentale est généralement vive, souvent sans proportion avec la gravité réelle de la maladie. Pour sécuriser l'enfant, il faut donc bien s'occuper des parents. Il est essentiel de tenir des propos clairs, honnêtes et adaptés à la compréhension des interlocuteurs. Les parents sont rassurés de savoir qu'ils peuvent accompagner leurs enfants, quand c'est possible, lors de la réalisation d'examens d'imagerie. Ils ont besoin d'être sûrs qu'il y a eu une réflexion préalable collégiale sur le rapport bénéfice/risque de l'examen, et qu'il y aura une prévention active de la douleur. Des documents écrits et des affiches dans le service permettent de compléter l'information, mais ils ne remplacent jamais des explications orales directes, qui doivent être cohérentes au sein du service.
À l'adolescence, l'interlocuteur principal devient le plus souvent le jeune concerné, en présence des parents. Il existe cependant des différences culturelles. Le discours du médecin reste bienveillant, clair, et ouvert sur des questions éventuelles.
La transmission des résultats diffère selon les services et la gravité de la maladie. Dans tous les cas, les examens d'imagerie doivent être envoyés au médecin demandeur, avec un compte-rendu complet et clair, dans des délais aussi brefs que possible. La communication (bilatérale) avec l'équipe clinique qui suit l'enfant est fondamentale et permet que les parents soient assurés de la prise en charge globale de leur enfant. Après l'examen, en cas de résultats montrant la persistance ou la récidive d'une maladie grave, un appel téléphonique au médecin référent, avant de parler à la famille, permet de préciser les modalités de prise en charge à court terme, ce qui est essentiel pour limiter le temps d'incertitude, souvent très difficile à vivre.
Essentiel à retenir
- La réalisation des examens d'imagerie chez l'enfant requiert une attention et un soin particuliers pour le choix de la technique (la moins irradiante possible en fonction de la question posée), l'optimisation des paramètres d'acquisition et la prise en charge de la douleur.
- Certains traits de fracture passant par le cartilage de croissance peuvent avoir une incidence sur la croissance d'un os long et entraîner une inégalité de longueur des membres ou une désaxation.
- L'échographie transfontanellaire et l'échographie médullaire sont des techniques spécifiques d'exploration du système nerveux central utilisées chez le nouveau-né.
- Le thymus peut être physiologiquement visible sur une radiographie thoracique jusqu'à 6 ans et ses différentes formes doivent être connues.
 |
Retour au sommaire |
Les fondamentaux - Chapitre 30 - Imagerie des glandes endocrines
F.-Z. Mokrane et D. Taïeb
Plan du chapitre
- Thyroïde
- Parathyroïdes
- Surrénales
- Pancréas
Objectifs
- Connaître les principales techniques d'exploration et la radio-anatomie de la thyroïde, des parathyroïdes, des surrénales et du pancréas.
- Connaître la place relative des techniques d'imagerie fonctionnelle et morphologique dans les principales pathologies endocrines.
- Connaître en TDM et en IRM les signes élémentaires des pathologies tumorales endocrines (nodule thyroïdien, adénome surrénalien, insulinome).
Thyroïde
Généralités
Les examens d'imagerie sont demandés lors du diagnostic clinique ou biologique d'une affection thyroïdienne. Il peut s'agir soit d'un trouble fonctionnel (hyperthyroïdie ou hypothyroïdie), soit d'une anomalie morphologique (palpation d'une masse ou d'un goitre, recherche d'un cancer primitif thyroïdien).
L'imagerie de la thyroïde repose sur deux techniques principales : l'échographie et la scintigraphie thyroïdienne.
Techniques et séméiologie normale
Échographies
La thyroïde est un organe superficiel, dont l'exploration est essentiellement réalisée en échographie, souvent à l'aide de sondes de haute fréquence, qui offrent une excellente résolution spatiale. À l'état normal, la thyroïde est homogène et hyperéchogène par rapport aux muscles adjacents. Les dimensions et la morphologie des deux lobes et de l'isthme thyroïdiens sont explorées dans le plan axial et dans le plan longitudinal (figure 30.1). Lorsqu'il existe un goitre plongeant en intrathoracique, l'échographie peut être insuffisante et il faut avoir recours à l'IRM ou à la TDM.
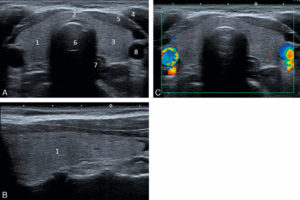
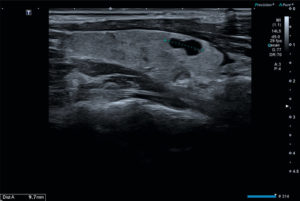
Échographie d'une thyroïde normale en coupes transversale (A) et longitudinale (B), et en coupe transversale en mode Doppler couleur (C).
Le parenchyme thyroïdien est homogène, hyperéchogène par rapport aux muscles adjacents et les contours de la glande sont réguliers. Absence d'hypervascularisation en Doppler couleur. 1. lobe droit ; 2. isthme ; 3. lobe gauche ; 4. muscle sternocléidomastoïdien gauche ; 5. muscles sternothyroïdien et sternohyoïdien gauches ; 6. trachée ; 7. œsophage ; 8. artère carotide commune gauche.
Scintigraphie
Les traceurs utilisés sont l'iode-123 (123I) et le pertechnétate-Tc-99m. L'123I a l'avantage de permettre une quantification plus fiable de la fixation, ce qui est précieux lorsque la concentration de TSH (thyroid-stimulating hormone ou thyréostimuline) n'est pas effondrée. Le pertechnétate est souvent plus largement utilisé du fait de sa disponibilité (produit à partir de générateurs présents dans les services de médecine nucléaire). La scintigraphie est classiquement indiquée en cas de TSH abaissée (< 0,50 mU/L) et a fortiori en présence d'une hyperthyroïdie d'origine périphérique avec une TSH inférieure à 0,1 mU/L. La fixation physiologique d'123I est inférieure à 2 % en présence d'une TSH effondrée. La scintigraphie permet de distinguer les hyperthyroïdies vraies (fixation de l'123I préservée), des hyperthyroïdies par relargage des stocks hormonaux préformés (thyroïdites) ou factices (fixation basse d'123I), et participe au bilan étiologique des hyperthyroïdies.
Séméiologie pathologique élémentaire
Nodule
Échographie
Le but de l'échographie thyroïdienne est de mesurer la taille de la glande, d'évaluer son échogénicité et de rechercher des nodules/masses. Le nodule thyroïdien correspond à une masse localisée dans la glande thyroïde. Il existe plusieurs types de nodules thyroïdiens classés en fonction de leurs aspects échographiques.
L'échographie ne permet pas de faire un diagnostic anatomopathologique, mais les critères échographiques péjoratifs sont pris en compte dans la classification Thyroid Imaging-Reporting and Database System (TI-RADS®), analogue pour la pathologie thyroïdienne de la classification Breast Imaging-Reporting And Data System (BI-RADS®) des lésions mammaires.
En France, la classification EU-TIRADS® (classification européenne TI-RADS®) est celle communément utilisée. Elle va d'un grade 1 (absence de nodule) à un grade 5 (risque élevé de malignité). La classification TI-RADS® permet donc de mieux appréhender le risque cancéreux et de guider la prise en charge.
Les lésions kystiques pures thyroïdiennes sont fréquentes et facilement diagnostiquées à l'échographie, apparaissant sous la forme d'un nodule anéchogène bien limité avec renforcement postérieur, en faveur d'un contenu liquidien (figure 30.2). Un kyste simple est classé EU-TIRADS® 2. Un nodule ovalaire iso- ou hyperéchogène par rapport au reste de la glande et de contours réguliers est classé EU-TIRADS® 3 (figure 30.3).
Coupe longitudinale du lobe droit thyroïdien.
Visualisation d'une formation kystique liquidienne anéchogène pure de 9 mm de grand axe. Il s'agit d'un kyste thyroïdien, classé EU-TIRADS® 2.
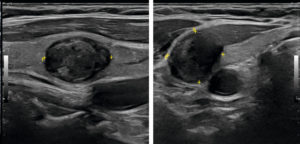
Nodules thyroïdiens solides présentant différents risques de malignité.
Coupe transversale du lobe thyroïdien gauche montrant un nodule de 40 mm hyperéchogène homogène, classé EU-TIRAD® 3, à faible risque de malignité.
Les nodules tissulaires peuvent être malins s'ils comportent certains critères échographiques : nodule hypoéchogène, présence de microcalcifications, contours irréguliers (figure 30.4).
Coupes longitudinale (A) et transversale (B) du lobe thyroïdien droit montrant un nodule de 14 mm de grand axe fortement hypoéchogène.
Ce nodule est classé EU-TIRAD® 5, à risque élevé de malignité.
L'échographie est également utile pour détecter d'éventuelles adénomégalies cervicales et pour guider la cytoponction d'un nodule échographiquement suspect.
Scintigraphie
La scintigraphie n'est pas indiquée en cas de TSH normale. Quand elle est réalisée, les nodules hypofixants ou isofixants (dits « froids ») doivent être considérés comme suspects. En revanche, les nodules hyperfixants sont presque toujours bénins. Il n'existe pas de traceur de référence pour le diagnostic de cancer. On utilise parfois le méthoxy-isobutyl-isonitrile (MIBI)-99mTc qui a une forte valeur prédictive négative de cancer, en cas d'absence de fixation.
Dysthyroïdies
Maladie de Basedow
Échographie
La glande est généralement de volume augmenté, parfois normal. L'échostructure glandulaire devient hétérogène de façon diffuse, avec des plages hypoéchogènes mal systématisées au sein de lobes globuleux (figure 30.5). Le mode Doppler met en évidence une riche vascularisation parenchymateuse.
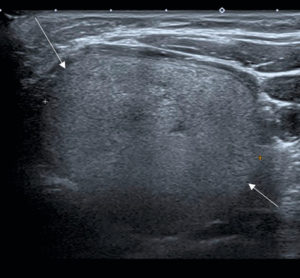
Goitre chez une enfant de 14 ans, suivie pour une maladie de Basedow.
Coupe transversale (A) sur la thyroïde montrant les deux lobes et l'isthme, augmentés de taille et de parenchyme discrètement hétérogène. Sur la coupe longitudinale du lobe thyroïdien droit (B), les bords de la thyroïde sont globuleux (flèche). En doppler couleur (C), la glande est globalement hypervascularisée.
Scintigraphie
La scintigraphie montre, selon le cas, un goitre ou une thyroïde de volume normal. Le captage de l'123I est classiquement diffus et intense (figure 30.6A). La valeur de fixation est souvent supérieure à 20 % à 2 heures et peut dépasser 80 %.
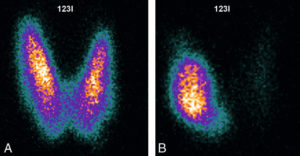
Hyperthyroïdie, scintigraphie à l'123I.
A. Hyperfixation diffuse en rapport avec une maladie de Basedow. B. Hyperfixation focale en rapport avec un adénome toxique.
Thyroïdite auto-immune de Hashimoto
Échographie
La thyroïde apparaît d'abord globuleuse, de contours lobulés, d'échostructure hypoéchogène, avec des travées hyperéchogènes en rapport avec l'infiltration lymphocytaire. Dans un deuxième temps, la glande se fibrose, s'atrophie et conserve une échostructure hétérogène à prédominance hypoéchogène.
Scintigraphie
La scintigraphie n'est classiquement pas indiquée dans ce contexte. Elle montrerait une fixation hétérogène (en damier).
Adénome et goitre multinodulaire toxique
Échographie
L'imagerie du goitre relève en première intention d'une échographie qui confirmera l'impression clinique d'augmentation du volume thyroïdien. Les nodules toxiques sont généralement tissulaires, hypoéchogènes et richement vascularisés.
En cas de retentissement œsophagien ou trachéal, une IRM analyse les rapports anatomiques ; elle est préférée à la TDM car l'injection de produit de contraste iodé est susceptible d'aggraver une hyperthyroïdie.
Scintigraphie
La scintigraphie met en évidence un ou plusieurs nodules hyperfixants (dits autonomes) malgré la présence d'une TSH abaissée (figure 30.6B) ; on parle alors d'adénome toxique ou de goitre multinodulaire toxique. Parfois, la forme multinodulaire peut coexister avec une hyperfixation thyroïdienne diffuse (variété dite « mixte »).
Thyroïdite de De Quervain
Échographie
L'échographie peut mettre en évidence des micronodules hypoéchogènes diffus ou une hypoéchogénicité bilatérale. La glande est globalement atrophiée.
Scintigraphie
La scintigraphie montre une fixation diminuée, en rapport avec la baisse de la TSH et l'atteinte tissulaire. Les thyroïdites de De Quervain ont souvent une évolution triphasique, bien visible en scintigraphie. La phase débutante montre l'atteinte d'un lobe, la phase d'état un effondrement du contraste global et de la fixation (« scintigraphie blanche ») et la phase de récupération une image bien fixante. Les thyroïdites factices ont également une fixation effondrée (« scintigraphie blanche »).
Parathyroïdes
Généralités
Le diagnostic d'hyperparathyroïdie est un diagnostic clinique et biologique. Comme souvent en pathologie endocrinienne, le rôle de l'imagerie est essentiellement topographique, permettant d'identifier la ou les glandes pathologiques en position eutopique ou ectopique. L'imagerie va donc influencer la tactique opératoire (abord mini-invasif versus cervicotomie exploratrice). L'atteinte est uni- ou bilatérale. Elle peut concerner une seule (adénome) ou plusieurs glandes (adénomes multiples ou hyperplasie). L'échographie et la scintigraphie sont souvent réalisées en première intention.
Séméiologie pathologique
Échographie, IRM, TDM
Les glandes parathyroïdes sont difficilement visibles en échographie lorsqu'elles sont normales. Elles apparaissent comme des nodules rétrothyroïdiens lorsqu'elles sont pathologiques. L'exploration doit concerner toute l'aire cervicale à la recherche d'une parathyroïde en position atypique et être complétée, en cas de négativité, par une TDM ou une IRM thoracique car certaines parathyroïdes de topographie atypique siègent dans le médiastin (figure 30.7).
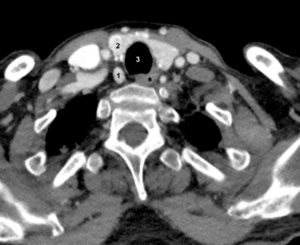
Coupe TDM axiale après injection d'un adénome parathyroïdien inférieur droit (1) ; thyroïde (2), trachée (3).
Scintigraphie
Le MIBI-99mTc (sestamibi technétié) est le traceur utilisé pour visualiser les glandes parathyroïdes hyperfonctionnelles. Toutefois, ce n'est pas un traceur spécifique et il existe aussi une fixation thyroïdienne. Deux méthodes ont été développées pour éliminer l'image thyroïdienne « parasite ». La première méthode (soustraction) consiste à soustraire l'image thyroïdienne grâce à la réalisation conjointe d'une image avec un traceur thyroïdien (123I) (figure 30.8). L'utilisation de 99mTc comme traceur thyroïdien imposerait une acquisition asynchrone (car même isotope que le sestamibi). La deuxième méthode (double phase) nécessite des acquisitions tardives car il existe une rétention prolongée du MIBI-99mTc dans la parathyroïde comparativement à la thyroïde. Les adénomes ont une fixation intense et précoce du MIBI-99mTc. Les acquisitions tomoscintigraphiques cervico-médiastinales couplées à une TDM permettent de dépister les adénomes en position ectopique, parfois développés aux dépens de glandes surnuméraires (notamment dans les hyperparathyroïdies secondaires). Une TEP à fluorocholine peut être réalisée en seconde intention. Elle permet un gain en sensibilité, mais son interprétation peut être délicate (ganglions cervico-médiastinaux ou nodules thyroïdiens hyperfixants).
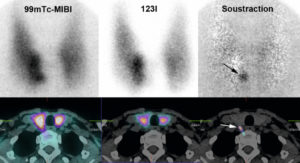
Hyperparathyroïdie primaire, scintigraphie par méthode de soustraction.
Après soustraction sur les images planaires et tomoscintigraphiques, il existe un foyer parathyroïdien unique en position eutopique.
Surrénales
Généralités
L'exploration morphologique des glandes surrénales est indiquée lorsqu'il existe des anomalies biologiques ou une lésion découverte de façon fortuite (incidentalome). Alors que l'imagerie nucléaire explore séparément les anomalies des sécrétions glucocorticoïde et minéralocorticoïde, l'imagerie morphologique décrit les anomalies de taille (tumeur, hyperplasie, atrophie) et aide à la caractérisation d'une éventuelle tumeur. La TDM est prescrite en première intention, parfois complétée par une IRM. L'échographie est d'un intérêt limité car les surrénales sont profondes et difficilement accessibles chez l'adulte.
Séméiologie normale
TDM, IRM
Les surrénales normales sont situées au-dessus, en avant et en dedans du pôle supérieur des reins. Elles sont constituées d'un corps et de deux jambes, et peuvent présenter plusieurs formes : V inversé, Y inversé, linéaire (figure 30.9A, B). L'aspect varie selon le plan de coupe. Le meilleur critère de normalité morphologique d'une surrénale est le caractère rectiligne ou concave de ses bords, qui deviennent convexes lorsque la glande est déformée par un processus pathologique tumoral, infectieux ou inflammatoire (figure 30.9C).
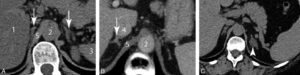
Coupes TDM dans le plan axial des glandes surrénales normales (A, B) et d'une masse surrénalienne gauche (C).
1. Foie ; 2. aorte ; 3. rate ; 4. veine cave inférieure ; 5. diaphragme. Les flèches montrent des glandes normales de morphologies différentes ; la tête de flèche en C désigne une masse surrénalienne.
Scintigraphie
Le choix du traceur dépend de la pathologie surrénalienne. On distingue classiquement les traceurs de la corticosurrénale et de la médullosurrénale, 131I-6-iodométhyl-19-norcholestérol (131I-iodocholestérol) dans le premier cas et 123I-MIBG ou 18F-DOPA dans le second cas. Les masses surrénaliennes non sécrétantes et non typiques d'adénome en imagerie conventionnelle peuvent être explorées par TEP au 18F-FDG.
Séméiologie pathologique
Hypercortisolisme
TDM, IRM
La première étape du diagnostic étiologique d'un hypercortisolisme doit déterminer si la sécrétion est adrenocorticotropic hormone (ACTH)-dépendante ou ACTH-indépendante.
Les hypersécrétions ACTH-dépendantes sont pour la plupart dues à un adénome hypophysaire, à explorer par IRM (voir chapitre 23). Il s'agit plus rarement, dans le cadre d'un syndrome paranéoplasique, d'une sécrétion ectopique par une tumeur carcinoïde (généralement bronchique), à rechercher par une TDM thoraco- abdomino-pelvienne.
Les hypersécrétions ACTH-indépendantes ont pour origine un adénome surrénalien (dit « adénome de Cushing »), un corticosurrénalome malin ou, plus rarement, une hyperplasie bilatérale des surrénales (micro- ou macronodulaire). L'adénome de la surrénale est un nodule bénin, homogène, arrondi et bien limité. Sur la TDM sans injection de produit de contraste, sa densité est pseudo-liquidienne, proche de 0 UH, traduisant son riche contenu en graisse. La traduction IRM de ce contenu graisseux est la chute du signal du nodule sur la séquence en opposition de phase en comparaison avec la séquence en phase (imagerie par déplacement chimique).
Scintigraphie
En cas d'adénome cortisolique, la fixation de 123I-iodocholestérol est intense avec extinction de la fixation surrénalienne controlatérale (du fait de la baisse de l'ACTH). En cas d'hyperplasie, la fixation est bilatérale et équilibrée. La scintigraphie a un intérêt limité dans les corticosurrénalomes malins, où la fixation tumorale est préservée dans la moitié des cas.
Hyperaldostéronisme primaire
TDM, IRM
La TDM est réalisée dans cette indication pour rechercher un adénome de Conn, qui est souvent de petite taille et qui présente les mêmes caractéristiques densitométriques et de signal que l'adénome de Cushing. En l'absence d'une image typique d'adénome unilatéral, le diagnostic s'oriente vers une hyperplasie bilatérale de la zone glomérulée. Toutefois, afin de s'assurer de l'absence de latéralisation de la sécrétion d'aldostérone, qui justifierait une intervention, un cathétérisme sélectif des veines surrénaliennes peut être réalisé recherchant une différence de sécrétion entre les deux glandes surrénales.
Scintigraphie
La scintigraphie au 131I-iodocholestérol peut participer au diagnostic étiologique des hyperaldostéronismes primaires, notamment en cas d'échec du cathétérisme veineux. L'examen doit être réalisé sous freination corticotrope puissante (Dectancyl® 2 mg/j, débuté 48 heures avant l'injection) et après saturation iodée de la thyroïde (pour protéger la glande thyroïde de l'effet potentiellement délétère de l'131I libre). Une fixation surrénalienne unilatérale est en faveur d'un adénome de Conn. Une fixation bilatérale oriente vers une hyperplasie bilatérale.
Tumeurs de la médullosurrénale
TDM, IRM
L'imagerie a un rôle topographique, après diagnostic clinique et biologique d'une hypersécrétion de catécholamines. Il s'agit dans 80 % des cas d'une tumeur de la surrénale (phéochromocytome) et plus rarement d'une tumeur extrasurrénalienne (paragangliome), qu'il faut rechercher « du clivus à l'anus », notamment à l'étage cervical, à proximité du cœur, de la vessie et dans le rétropéritoine médian.
Dans la mesure où le rôle de l'imagerie est topographique, les caractéristiques morphologiques de la tumeur ne sont pas déterminantes. Il s'agit habituellement de tumeurs hypervasculaires présentant parfois une composante kystique (figure 30.10).
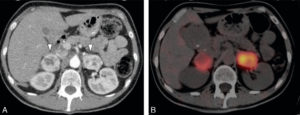
Imagerie du phéochromocytome.
A. TDM abdominale au temps artériel montrant deux masses surrénaliennes hypervasculaires avec une composante kystique. B. Image scintigraphique à la MIBG fusionnée à la TDM montrant une hyperfixation intense des syndromes de masses surrénaliens, compatibles avec un phéochromocytome bilatéral.
Scintigraphie
La scintigraphie à la 123I-MIBG ou la TEP à la 18F-DOPA constituent les imageries isotopiques de référence dans l'exploration des phéochromocytomes et paragangliomes (PPGL) (figure 30.11). La fixation est en règle générale intense pour les deux traceurs. L'imagerie isotopique permet de rechercher des atteintes multifocales (notamment dans les formes héréditaires) ou des métastases (notamment en cas de volumineuses tumeurs). La TEP aux analogues de la somatostatine ciblant les récepteurs de la somatostatine peut être indiquée en cas de PPGL, notamment dans les formes héréditaires liées à une mutation germinale d'un des gènes de la succinate déshydrogénase (SDHA-D).
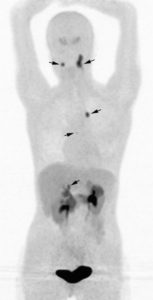
TEP à la 18F-DOPA dans un phéochromocytome/paragangliome héréditaire.
Multiples lésions tumorales développées aux dépens des paraganglions vagaux cervico-médiastinaux (paragangliomes) et de la médullosurrénale droite (phéochromocytome).
Insuffisance surrénale primaire
L'imagerie est réalisée à la recherche de métastases bilatérales ou d'un processus infectieux ou infiltratif.
La scintigraphie n'a pas d'indication. Une TEP au 18F-FDG peut être indiquée dans certains cas à la recherche d'une affection infectieuse, inflammatoire ou néoplasique.
Pancréas
Généralités
L'exploration d'un diabète de type 1 ou de type 2 ne nécessite aucune imagerie. En revanche, lorsqu'une maladie endocrine du pancréas est suspectée sur des arguments cliniques et biologiques, une TDM est réalisée en première intention.
Séméiologie normale
En échographie, le pancréas a une échostructure homogène et hypoéchogène par rapport à la graisse péritonéale. Cependant, compte tenu de sa localisation profonde, rétropéritonéale, il est difficilement exploré en totalité chez l'adulte du fait de l'interposition des gaz digestifs et du fait parfois de l'obésité du patient. En TDM, le pancréas normal est homogène et se rehausse de façon homogène (figure 30.12A, B). En IRM, le pancréas est de signal intermédiaire en T1 et en T2 ; il se rehausse également de façon homogène après injection de produit de contraste (figure 30.13). Les contours du pancréas sont bosselés. Cette lobulation est plus marquée avec l'âge en raison de l'infiltration graisseuse de la glande (figure 30.12C).
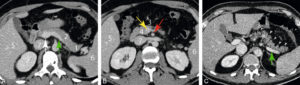
Aspect normal du pancréas en TDM : coupes TDM injectées axiales chez un patient de 25 ans (A, B) et chez un autre patient de 57 ans (C).
1. Queue du pancréas ; 2. corps du pancréas, séparé de la queue par le croisement de l'artère splénique ; 3. isthme du pancréas (en avant des vaisseaux mésentériques supérieurs) ; 4. tête du pancréas ; 5. foie ; 6. rate ; 7. veine cave inférieure. Flèche blanche : veine porte ; flèche jaune : veine mésentérique supérieure ; flèche rouge : artère mésentérique supérieure ; flèche verte : veine splénique. C. Aspect d'atrophie physiologique avec l'âge : les contours du pancréas deviennent plus irréguliers (têtes de flèche).
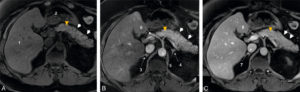
Aspect normal du pancréas en IRM : coupes IRM axiales en séquence T1 avec saturation de la graisse (Fat Sat), sans injection de produit de contraste (A) et après injection de produit de contraste au temps artériel (B) et au temps portal (C) chez un patient de 50 ans.
Le corps et la queue du pancréas sont bien visible sur ces coupes (têtes de flèche blanches). Le pancréas est en signal intermédiaire spontané sur la séquence T1 sans injection de produit de contraste (A), de rehaussement homogène, sans lésion focale sur les séquences réalisées aux temps artériel et portal (B, C). Le conduit pancréatique (de Wirsung) est très fin, à peine visible (tête de flèche orange). 1. Foie ; 2. estomac ; 3. surrénale droite ; 4. surrénale gauche ; 5. aorte abdominale ; 6. artère hépatique ; 7. veine cave inférieure ; 8. veine porte.
Séméiologie pathologique : exploration d'une tumeur endocrine du pancréas
TDM, IRM
Les tumeurs neuroendocrines pancréatiques sont des tumeurs relativement peu fréquentes, souvent de découverte fortuite, dont l'incidence augmente en raison de l'utilisation généralisée de l'imagerie en coupe. Elles représentent une entité hétérogène, caractérisée par une grande variation dans la présentation clinique, le caractère fonctionnel ou non, un éventuel contexte génétique et une agressivité variable. La localisation préopératoire d'une tumeur endocrine du pancréas diagnostiquée sur des arguments cliniques et biologiques n'est pas toujours aisée, notamment lorsque la lésion est de petite taille, ce qui est fréquemment le cas avec les insulinomes.
La TDM avec injection de produit de contraste iodé, au temps artériel, est l'examen à réaliser en première intention, à la recherche d'un nodule classiquement hypervasculaire et sans retentissement canalaire, à la différence de l'adénocarcinome pancréatique, plutôt hypovasculaire et rapidement responsable d'une sténose du canal pancréatique et/ou de la voie biliaire (figure 30.14).
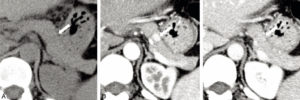
Tumeur neuro-endocrine du pancréas (insulinome) chez une patiente de 35 ans.
TDM abdominale en coupe axiale sans injection de produit de contraste (A), puis au temps artériel (B) et au temps portal (C) après injection. Visualisation d'un nodule pancréatique situé sur le corps, mesuré à 1 cm, visible uniquement au temps artériel. Cette image est très évocatrice de tumeur neuroendocrine pancréatique, ce d'autant qu'il n'existe pas de retentissement canalaire, c'est-à-dire que le conduit pancréatique n'est pas dilaté par la présence de la tumeur et reste très fin, non visible comme habituellement en TDM.
L'IRM est indiquée en deuxième intention, en cas de négativité de la TDM. Si elle-même est en échec, l'écho-endoscopie peut être proposée. L'écho-endoscopie n'est pas indiquée en première intention car elle nécessite une anesthésie générale et ne permet pas de réaliser le bilan d'extension, notamment hépatique.
Médecine nucléaire
Un large éventail de techniques d'imagerie moléculaire est également utilisé chez les patients atteints de tumeurs neuro-endocrines pancréatiques, comme l'imagerie des récepteurs de la somatostatine par tomographie à émission monophotonique (TEMP-TDM) et TEP, le 18F-DOPA et le 18F-FDG par TEP.
L'examen moléculaire de choix est la TEP aux analogues de la somatostatine (68Ga-DOTATATE en France). Il permet localiser la tumeur primitive devant un syndrome endocrinien (hypoglycémie hyperinsulinique, syndrome de Cushing ectopique et syndrome carcinoïde) ou des métastases prévalentes (hépatiques notamment), de déterminer des critères pour affirmer la nature neuroendocrine d'une lésion évocatrice sur l'imagerie conventionnelle, d'évaluer l'extension locorégionale et à distance, de déterminer la nature agressive ou non des lésions identifiées (biomarqueur pronostique), d'assurer le suivi évolutif des patients et, enfin, de sélectionner les patients pour un éventuel traitement par radiothérapie interne vectorisée. Pour les insulinomes, la sensibilité de la TEP est plus faible (60–70 %). La TEP aux analogues du GLP-1 (glucagon-like peptide 1) est très sensible (approchant 100 %), mais elle n'est pas disponible en routine en France.
Essentiel à retenir
- Le rôle de l'imagerie radiologique en pathologie endocrine est de localiser le site d'une sécrétion hormonale anormale, diagnostiquée sur des arguments cliniques et biologiques.
- L'échographie et la scintigraphie sont essentielles au diagnostic des affections thyroïdiennes et parathyroïdiennes.
- L'exploration morphologique des lésions surrénaliennes et pancréatiques s'effectue essentiellement en TDM et en IRM.
- L'imagerie métabolique (TEP ou scintigraphie) peut être spécifique d'une tumeur endocrine.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 29 - Imagerie des seins et du pelvis féminin
I. Thomassin-Naggara et O. Humbert
Plan du chapitre
- Gynécologie
- Sénologie
Objectifs
Gynécologie
- Connaître les différentes techniques d'exploration pour la pathologie gynécologique.
- Connaître quelques éléments d'anatomie et de séméiologie normales en imagerie gynécologique.
- Connaître les différents éléments sémiologiques échographiques et tomodensitométriques (TDM) des principales urgences gynécologiques.
- Connaître le signal des principaux liquides et solides rencontrés dans les tumeurs ovariennes en imagerie par résonance magnétique (IRM).
Sénologie
- Connaître les techniques d'exploration de la pathologie mammaire. Savoir expliquer à la patiente la technique de la mammographie.
- Connaître l'existence du dépistage de masse organisé et sa cible.
- Connaître les principales indications des examens sénologiques diagnostiques.
- Connaître les principaux éléments sémiologiques en imagerie mammaire.
- Connaître les principaux examens sénologiques interventionnels.
- Connaître le principe et les principales modalités du bilan d'extension du cancer du sein.
- Comprendre l'intérêt et les perspectives de l'imagerie TEP dans le cancer du sein.
- Connaître la technique du nœud lymphatique sentinelle.
La place de l'imagerie dans l'exploration en pathologie gynécologique et mammaire est centrale, permettant de diagnostiquer, de surveiller la patiente sous traitement et de dépister des patientes asymptomatiques. Nous avons à notre disposition une large gamme de techniques d'imagerie utilisant les rayons X, les ultrasons, l'IRM ou les isotopes.
Gynécologie
Techniques d'exploration pour la pathologie gynécologique
L'examen de première intention, quel que soit le symptôme présenté par la patiente en gynécologie, est l'échographie pelvienne par voie sus-pubienne et par voie endovaginale avec Doppler. Cet examen se fait dans la continuité de l'examen clinique et permet parfois à lui seul de diagnostiquer une maladie ou d'orienter la patiente vers d'autres techniques d'imagerie. L'échographie par voie endovaginale présente une excellente résolution spatiale en raison de l'utilisation d'une sonde à haute fréquence placée au contact des structures utéro-ovariennes, sans l'interposition des muscles et de la graisse de la paroi abdominale. De plus, il s'agit d'un examen dynamique permettant de réaliser une palpation abdominale en même temps que l'examen échographique. Cet examen est réalisé avec l'accord de la patiente après l'avoir interrogée sur une virginité éventuelle, sur ses traitements en cours et sur ses antécédents médicaux, notamment allergiques (latex, antibiotiques, etc.).
Les examens pouvant compléter l'échographie endovaginale et sus-pubienne sont tout d'abord l'IRM pelvienne avec ou sans injection de produit de contraste à base de gadolinium. Elle permet d'explorer l'anatomie du pelvis féminin et est très utile pour la caractérisation des structures liquidiennes et solides situées dans le pelvis féminin. Cette technique permet de combiner des séquences morphologiques pondérées en T2, T1, T1 avec suppression de graisse, T1 après injection de gadolinium, ainsi que l'utilisation de séquences fonctionnelles permettant de différencier une tumeur bénigne d'une tumeur maligne (IRM avec injection dynamique de gadolinium, étude de la perfusion, imagerie de diffusion).
La TDM abdominopelvienne est parfois utile dans un contexte d'urgence, car une douleur pelvienne n'est pas toujours d'origine gynécologique, mais peut aussi être d'origine digestive ou urinaire. Elle présente un moins bon contraste tissulaire que l'IRM pelvienne mais une meilleure résolution spatiale. La TDM abdominopelvienne se fait le plus souvent sans et après injection de produit de contraste à base d'iode. La TDM est l'examen de référence du bilan d'extension des cancers ovariens car il permet la visualisation des métastases péritonéales sous la forme de petits implants péritonéaux.
En imagerie gynécologique, deux examens permettent d'analyser la morphologie des trompes ainsi que leur perméabilité : l'hystéro-salpingographie et l'HyFoSy ou hysterosalpingo-foam-sonography. Le premier examen se fait à l'aide de rayons X après opacification rétrograde des trompes par l'injection d'un produit de contraste radio-opaque à travers le col utérin. Le second se fait par injection d'un mélange d'air et d'eau sous échographie dans la cavité utérine pour évaluation tubaire. Leurs principales indications sont le bilan d'infertilité et le bilan de méno-métrorragies.
La TEP-TDM au 18F-FDG peut être indiquée pour réaliser le bilan d'extension initial de certaines tumeurs pelviennes (col utérin, endomètre, ovaires), lorsqu'elles sont localement avancées. La TEP au 18F-FDG est surtout utile pour réaliser le bilan d'extension régional et à distance, c'est-à-dire détecter un éventuel envahissement des nœuds lymphatiques régionaux (diffusion lymphogène) ou la présence de localisations secondaires (métastases) plus à distance (diffusion hématogène).
Éléments d'anatomie et de séméiologie normales en imagerie gynécologique
L'utérus est situé au-dessus et en arrière de la vessie et en avant du rectum. Chez la femme en âge de procréer, il a une forme de poire inversée, il est médian, plus ou moins dévié latéralement et anté- ou rétroversé. Ses quatre segments (col, isthme, corps et fond utérin) sont identifiables en échographie et en IRM (figure 29.1). L'utérus est composé de trois structures : la cavité utérine, l'endomètre, qui correspond à la muqueuse recouvrant la cavité utérine et le myomètre, qui est la portion la plus épaisse de l'utérus, correspondant à du muscle lisse. Au cours du cycle menstruel, l'échostructure et l'épaisseur de l'endomètre se modifient de façon physiologique : il est fin et plutôt hypoéchogène en première partie de cycle, et s'épaissit et devient progressivement plus hyperéchogène en seconde partie de cycle. Les trompes ne sont pas visibles à l'état normal en raison de leur finesse.
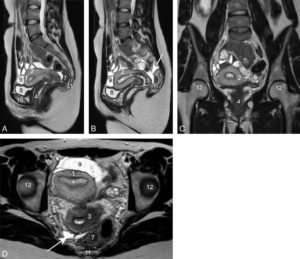
Coupes IRM en pondération T2 du pelvis d'une femme de 30 ans.
1. Fond de l'utérus ; 2. corps de l'utérus ; 3. col de l'utérus ; 4. vagin ; 5, 6. ovaires droit et gauche (plusieurs follicules sont visibles sous la forme de structures arrondies et hyperintenses) ; 7. rectum ; 8. vessie ; 9. anse grêle ; 10. corps du pubis ; 11. coccyx ; 12. têtes fémorales. Les étoiles sont dans la lumière utérine bordée par l'endomètre ; les flèches blanches montrent un seul récessus recto-utérin (cul-de-sac de Douglas), point déclive de la cavité péritonéale où s'accumulent les petits épanchements liquidiens. A. Coupe sagittale. B. Coupe parasagittale droite. C. Coupe frontale. D. Coupe horizontale. L'utérus est antéversé, un peu dévié à droite.
Les ovaires sont le plus souvent situés de part et d'autre de l'utérus, en dedans des vaisseaux iliaques externes. Ils sont de forme ovalaire et contiennent plusieurs follicules (figure 29.2). En échographie, les follicules apparaissent ronds et anéchogènes, mesurant entre 2 et 10 mm environ, harmonieusement répartis au sein du parenchyme ovarien. Le volume de l'ovaire varie en fonction de l'âge et du cycle.
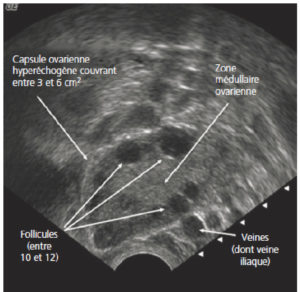
Ovaire normal d'une patiente en période d'activité génitale en échographie par voie endovaginale.
Éléments sémiologiques échographiques et tomodensitométriques des principales urgences gynécologiques
Les deux principaux symptômes motivant une consultation en urgence en gynécologie sont la douleur pelvienne aiguë et le saignement d'origine gynécologique.
Douleurs pelviennes
Grossesse extra-utérine
Chez la femme en période d'activité génitale, la survenue d'une douleur pelvienne aiguë nécessite de rechercher avant tout une grossesse extra-utérine. Si le dosage de l'hormone chorionique gonadotrope humaine (hCG) est positif, l'examen à pratiquer en première intention et en urgence est une échographie endovaginale à la recherche d'une grossesse évolutive. Les signes échographiques en faveur d'une grossesse extra-utérine sont la présence d'un utérus vide, d'un pseudo-sac ou de kystes dans l'endomètre associés à des signes annexiels que sont un embryon extra-utérin, un sac gestationnel ou plus fréquemment une masse tubaire (figure 29.3). On peut retrouver un épanchement pelvien non spécifique qui est non prédictif de rupture et dont l'échogénicité est variable. Une grossesse extra-utérine est habituellement très vascularisée en mode Doppler couleur.
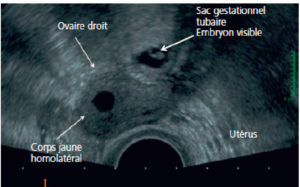
Grossesse extra-utérine en échographie par voie endovaginale.
En cas de doute diagnostique, un contrôle échographique toutes les 24 à 48 heures et une surveillance du taux de bêta-hCG sont proposés.
L'un des principaux diagnostics différentiels est la rupture de kyste lutéal hémorragique qui se traduit par la présence également d'un hémopéritoine, mais avec un rehaussement annulaire aplati caractéristique du kyste ovarien.
Torsion d'annexe
Devant des douleurs pelviennes aiguës, le second diagnostic à évoquer est celui de torsion d'annexe. Celle-ci est plus fréquente chez la femme enceinte, mais peut également survenir en l'absence de grossesse, parfois parce qu'une tumeur de l'ovaire (tumeur organique bénigne, kyste fonctionnel) a entraîné la torsion.
Les signes à rechercher sont, en échographie, une masse annexielle, un déplacement de l'annexe du côté controlatéral ou en position médiane, un épaississement de la trompe et la présence d'un tour de spire de la trompe tordue. Il existe des torsions d'annexe sur ovaire sain chez la patiente jeune (en raison d'un défaut de fixation de la gonade ou d'une augmentation de son volume) ; dans ce cas, le diagnostic est suspecté devant un œdème ovarien important avec déviation périphérique des follicules. En cas de doute diagnostique en échographie endovaginale, on peut proposer de réaliser une IRM pelvienne (figure 29.4) ou une TDM abdominopelvienne.
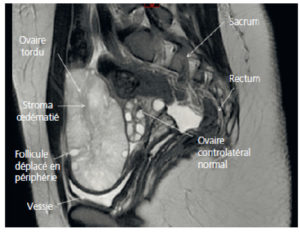
Torsion d'annexe (coupe sagittale en IRM en pondération T2).
Infection génitale haute (salpingite aiguë)
Le troisième diagnostic par ordre de gravité à évoquer devant des douleurs pelviennes aiguës est celui d'infection génitale haute. L'infection est d'origine endométriale et s'étend à la trompe et éventuellement à l'ovaire. En imagerie, les signes sont le plus souvent bilatéraux, asymétriques et centrés sur la trompe.
Il existe des images tubulées bilatérales dont la paroi est épaissie, correspondant aux trompes infectées. Elles sont très vascularisées en Doppler en échographie et se rehaussent de façon importante en IRM ou en TDM. Il s'y associe une infiltration de la graisse sous-péritonéale se traduisant par des plages de contours flous et de densité plus élevée de la graisse en TDM.
Endométriose
L'endométriose pelvienne est habituellement responsable de douleurs pelviennes chroniques souvent rythmées par les menstruations (dysménorrhées), de douleurs pelviennes lors des rapports sexuels (dyspareunie) et d'infertilité. Elle est explorée en échographie (idéalement par voie endovaginale, après information de la patiente) et en IRM.
Saignement d'origine gynécologique
Dans le cadre de l'urgence et devant des saignements abondants d'origine gynécologique, l'échographie par voie endovaginale recherche une anomalie endométriale ou myométriale. L'utilisation du Doppler est fondamentale dans cette indication à la recherche d'une malformation artérioveineuse, qui correspond à une image intramyométriale très vascularisée avec présence de foyers à haute vitesse (> 1 m/s). Une embolisation des artères utérines est réalisée sous guidage par rayons X (voir chapitre 21).
Éléments sémiologiques IRM des tumeurs annexielles (signal des principaux liquides et solides)
Une masse ovarienne peut être uni- ou pluritissulaire, être purement liquidienne, purement solide ou mixte. L'IRM est l'examen de choix car la combinaison des différentes séquences permet d'approcher une caractérisation de la masse.
Ainsi, les masses liquidiennes pures sont homogènes, en hypersignal en T2, en hyposignal en T1 et en hyposignal en diffusion. La graisse est en hypersignal T1, disparaissant après saturation du signal de la graisse ; cet aspect est retrouvé dans le kyste dermoïde ou le tératome ovarien. Le sang est également en hypersignal T1, mais ne disparaît pas après saturation du signal de la graisse ; cet aspect est retrouvé dans l'endométriome ovarien ou dans le kyste lutéal hémorragique.
Une tumeur ovarienne maligne présente une composante tissulaire qui est en hypersignal en diffusion et qui se rehausse de façon intense et précoce après injection de gadolinium.
Le risque de malignité de toute masse annexielle (ovarienne ou tubaire) s'évalue selon la classification O-RADS™ de l'American College of Radiology (ACR).
Toute masse annexielle considérée comme complexe ou indéterminée en échographie doit bénéficier d'une IRM. En IRM, les masses annexielles bénignes sont le plus souvent classées O-RADS™ IRM 2 (< 2 % de malignité) ou O-RADS™ IRM 3 (< 5 % de malignité) alors que les masses annexielles malignes (borderline ou invasive) sont classées O-RADS™ IRM 4 ou O-RADS™ IRM 5 (> 90 % de malignité) (figure 29.5).
![Figure 29.5 Masse ovarienne (coupes axiales en IRM en pondération T2/T1/T1 avec injection dynamique de gadolinium/courbe de perfusion IRM). Masse ovarienne uniloculaire avec végétations en signal T2 intermédiaire (flèche), se rehaussant après injection de gadolinium selon une courbe de type 2 (rehaussement modéré avec un plateau courbe rouge comparativement au myomètre [courbe verte]). Il s'agissait d'une tumeur borderline séreuse de l'ovaire.](https://www.cnp-mn.fr/wp-content/uploads/2023/01/Les-fondamentaux-29.5-300x223.jpg)
Masse ovarienne (coupes axiales en IRM en pondération T2/T1/T1 avec injection dynamique de gadolinium/courbe de perfusion IRM).
Masse ovarienne uniloculaire avec végétations en signal T2 intermédiaire (flèche), se rehaussant après injection de gadolinium selon une courbe de type 2 (rehaussement modéré avec un plateau courbe rouge comparativement au myomètre [courbe verte]). Il s'agissait d'une tumeur borderline séreuse de l'ovaire.
En cas de masse annexielle classée O-RADS™ IRM 5 ou de carcinose péritonéale, il est nécessaire de pratiquer un bilan d'extension par une TDM thoraco-abdomino-pelvienne avec injection pour évaluer la résécabilité de la maladie.
Sénologie
Techniques d'exploration en pathologie mammaire
En imagerie mammaire, nous disposons de trois types d'examen d'imagerie diagnostique : la mammographie fondée sur les rayons X, l'échographie fondée sur les ultrasons et l'IRM. Nous abordons essentiellement les deux premières techniques dans cette section.
La mammographie est une technique d'imagerie par rayons X qui permet de détecter les principales anomalies évocatrices d'un cancer du sein qui sont, par ordre de fréquence, des masses, des microcalcifications, des distorsions architecturales ou des asymétries de densité, soit des masses, soit des non-masses (asymétrie de densité, distorsion architecturale ou foyer de microcalcifications).
La nécessité de détecter des anomalies de très petite taille et la mobilité normale du sein rendent nécessaire l'utilisation d'un système de compression permettant de bloquer le sein contre un détecteur dont la résolution spatiale est excellente (< 100 μm). Deux incidences sont réalisées, l'une de face et l'autre oblique (à 45°) pour couvrir l'ensemble de la glande mammaire et repérer les anomalies dans l'espace.
L'aspect d'un sein en mammographie est très variable en fonction des patientes et de leur statut hormonal. Dans un sein normal, on décrit quatre composantes anatomiques principales qui expliquent le signal radiologique : l'unité ductulolobulaire terminale et les canaux lactifères qui constituent le tissu glandulaire, le tissu fibreux et le tissu adipeux. En fonction de la proportion de tissu fibroglandulaire et de tissu adipeux de chacun de ces éléments, le sein est dense (tissu majoritairement fibreux et/ou glandulaire) ou radiotransparent (tissu majoritairement graisseux). La majorité des femmes présentent des seins de densité intermédiaire (densité types B et C selon le lexique Breast Imaging-Reporting And Data System® [BI-RADS®] de l'ACR). Les seins graisseux (densité type A) représentent 20 % de la population et les seins très denses (densité type D) représentent 10 % de la population. Avec l'âge, il existe une disparition progressive du tissu fibroglandulaire et donc une diminution progressive de la densité mammaire (figure 29.6). C'est la raison pour laquelle les seins des femmes jeunes, classiquement plus denses, sont plus facilement explorés en échographie, tandis que les seins des femmes plus âgées, classiquement moins denses, s'explorent plus aisément en mammographie.
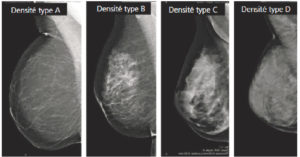
Densité mammaire.
Clichés mammographiques obliques montrant les différents types de densité mammaire.
Le cancer du sein naît dans l'unité ductulolobulaire terminale et se traduit le plus souvent par une masse dense. Il est donc facile à détecter dans un sein graisseux, mais plus difficile à détecter dans un sein dense ou très dense (densité types C et D) (figure 29.7).
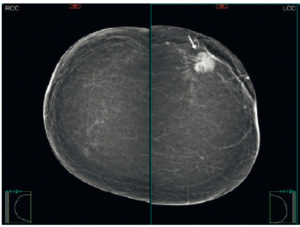
Mammographie bilatérale montrant une masse dense de forme ronde de contours spiculés correspondant à un carcinome canalaire invasif (flèche).
Dans ce cas, il est nécessaire de compléter la mammographie par une échographie mammaire.
En échographie mammaire, un cancer du sein se traduit par un nodule hypoéchogène qui se voit mieux dans le tissu fibroglandulaire (hyperéchogène) que dans la graisse qui est hypoéchogène (figure 29.8). L'échographie mammaire est donc un examen complémentaire de la mammographie. Elle permet de plus d'analyser la dureté des tissus, ce qui aide à reconnaître les cancers qui sont classiquement durs à la palpation, caractéristique retrouvée en mode élastographique échographique.
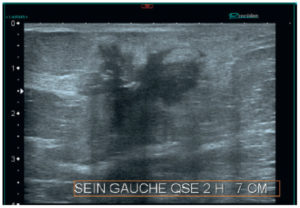
Échographie mammaire montrant une masse irrégulière de contours spiculés avec un halo hyperéchogène.
Cette masse est classée ACR5.
Dépistage de masse organisé et sa cible
Le dépistage organisé du cancer du sein repose en France sur la réalisation d'une mammographie bilatérale pour les femmes âgées entre 50 et 74 ans, une fois tous les 2 ans. Ce dépistage a montré sa capacité de détecter précocement le cancer du sein et d'améliorer la survie des patientes. La mammographie bilatérale doit être accompagnée d'un examen clinique. Cet examen fait l'objet de règles strictes d'acquisition (contrôle qualité des mammographes) et d'interprétation (lexique BI-RADS®). Afin de limiter les erreurs diagnostiques, une double lecture est organisée à l'échelon régional.
Principales indications des examens sénologiques diagnostiques
Outre le dépistage systématique chez des patientes indemnes qui se fait par mammographie bilatérale éventuellement associée à une échographie si la patiente a des seins denses ou très denses, ou si une anomalie est détectée sur la mammographie, la patiente peut se présenter d'emblée avec un symptôme mammaire nécessitant une exploration.
- En cas de masse palpable chez une patiente de moins de 35 ans, une échographie mammaire est réalisée en première intention. Chez les patientes de plus de 35 ans, une mammographie avec une échographie mammaire est recommandée.
- En cas d'écoulement mamelonnaire, une mammographie et une échographie sont réalisées, éventuellement complétées par une galactographie (opacification d'un canal lactifère par produit de contraste) en cas d'écoulement unipore. Si la réalisation de la galactographie est impossible, une IRM mammaire est une bonne alternative pour faire le diagnostic de toute atteinte intragalactophorique.
- En cas d'adénopathie axillaire suspecte, une exploration de la glande mammaire est réalisée par mammographie et échographie. Si ces examens sont normaux, une IRM mammaire est pratiquée.
- En cas de rétraction cutanée ou d'anomalie de la plaque aréolo-mamelonnaire, le bilan commence par une mammographie suivie d'une échographie. Si ces examens sont normaux, une IRM mammaire est pratiquée.
Éléments sémiologiques en imagerie mammaire
En imagerie mammaire, il existe deux types d'anomalies :
- les masses correspondent à un volume tissulaire envahissant l'espace. Une masse est décrite en fonction de ses contours (critère ayant la plus grande valeur diagnostique), sa forme et ses caractéristiques internes. En échographie, on ajoute des critères de déformabilité (élastographie, technique d'imagerie permettant d'analyser la déformabilité des tissus sous l'impulsion d'une onde ultrasonore). En IRM, on ajoute des critères de néovascularisation (courbe de rehaussement après injection de gadolinium) ;
- les anomalies sans masse correspondent à différentes entités en fonction de la modalité d'imagerie considérée. En mammographie, les non-masses sont les foyers de microcalcifications, les asymétries de densité et les distorsions architecturales. En échographie, il s'agit de zones hypoéchogènes mal limitées. En IRM, il s'agit de rehaussement sans masse dont on décrit la distribution et les caractéristiques internes de rehaussement après injection de gadolinium.
En fonction de ces différents critères descriptifs, les anomalies sont classées selon la classification BI-RADS® de l'ACR en cinq catégories. Ces catégories sont directement en lien avec la valeur prédictive positive de malignité (le risque que la lésion soit un cancer).
Un cancer du sein invasif se présente typiquement en mammographie sous la forme d'une masse hyperdense irrégulière de contours spiculés. En IRM, elle se rehausse précocement et intensément avec lavage secondaire (chute du signal après un pic de plus de 15 %). Les deux principaux diagnostics différentiels sont :
- l'adénofibrome qui est une tumeur bénigne solide intramammaire de contours lisses de forme ovale en mammographie et en échographie se rehaussant en IRM de façon peu intense et progressive (figure 29.9) ;
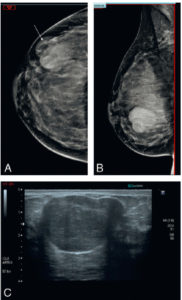
Diagnostic différentiel du cancer du sein : adénofibrome.
En mammographie (A, B), il existe une masse peu dense de contours lisses de forme ovale (flèche) correspondant en échographie (C) à la présence d'un nodule hypoéchogène homogène de contours macrolobulés typique.
- le kyste intramammaire qui peut être simple et se présenter sous la forme d'une structure liquidienne anéchogène ou complexe échogène.
Un cancer du sein in situ (strictement intracanalaire) se présente typiquement sous la forme d'anomalies sans masse, sous forme le plus souvent d'un foyer de calcifications (figure 29.10) dont la topographie suit les canaux lactifères (donc segmentaire orienté vers le mamelon). Certaines formes de cancers in situ de haut grade se traduisent en IRM sous la forme d'anomalies sans masse de trajet des canaux lactifères (figure 29.11).
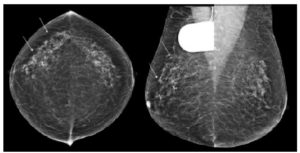
Foyer de microcalcifications (flèches) en mammographie correspondant à un carcinome canalaire in situ du sein droit.
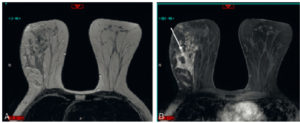
Carcinome canalaire in situ en IRM mammaire.
Non-masse de distribution triangulaire orientée vers le mamelon (segmentaire) (flèche).
En cas de cancer du sein, il est important de faire le bilan d'extension locorégional du cancer en appréciant la taille tumorale, la présence d'une extension à la peau, à la plaque aréolo-mamelonnaire ou au muscle grand pectoral. De plus, l'imagerie permet d'apprécier l'envahissement lymphatique axillaire et de guider d'éventuels prélèvements percutanés. Le meilleur examen d'imagerie pour ce bilan est l'IRM mammaire.
En cas de tumeur localement avancée (stade > IIB), le bilan associera également une TEP-TDM (voir paragraphe ci-dessous).
Examens sénologiques interventionnels
En sénologie, les biopsies percutanées des lésions mammaires sont relativement aisées. Plusieurs imageries sont possibles pour guider ce geste : guidage mammographique, échographique, IRM, voire TDM. On privilégiera toujours une biopsie sous guidage échographique, car elle est précise et permet de suivre en temps réel la procédure. Lorsque l'anomalie n'est pas visible en échographie mais en mammographie, elle peut être biopsiée sous guidage stéréotaxique.
Lorsqu'une anomalie est visible avec plusieurs modalités d'imagerie et que l'on veut s'assurer qu'il s'agit bien de la même lésion, on peut disposer des marqueurs métalliques en fin de procédure, de façon à pouvoir les visualiser à la fois en mammographie, en échographie et en IRM.
Enfin, lorsqu'une chirurgie conservatrice est envisagée (tumorectomie), le radiologue réalise un repérage préalable dans la glande mammaire par un fil ou un clip métallique pour aider le chirurgien à faire l'exérèse d'une zone tumorale visible sur l'imagerie, mais parfois difficilement repérable à l'examen clinique et en peropératoire (figure 29.12).
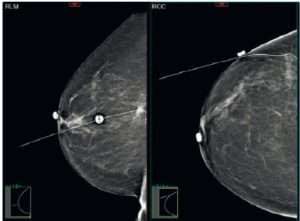
Repérage préopératoire d'un cancer du sein en mammographie.
Grâce à un fil métallique, positionné par voie percutanée, le chirurgien peut retrouver l'anomalie à opérer.
Modalités du bilan métastatique d'extension du cancer du sein
Le bilan d'extension vise à rechercher les localisations métastatiques d'un cancer du sein évolué. Il convient de rechercher en premier les métastases osseuses, pulmonaires et hépatiques, les autres sites de métastases étant des diagnostics cliniques (nœuds lymphatiques, peau, etc.) ou n'ayant qu'une incidence faible.
Cette recherche s'effectue en combinant différentes modalités d'imagerie qui explorent un ou plusieurs de ces organes à risque : radiographie de thorax, échographie abdominale, scintigraphie osseuse, TDM thoraco-abdominale, TEP au 18F-FDG, etc.
Un bilan d'extension par imagerie n'est pas systématique lors de la découverte d'un cancer du sein. En effet, pour les petites tumeurs asymptomatiques, la prévalence des métastases est faible et les examens d'imagerie exposent surtout au risque de résultats « faux positifs ». Citons l'exemple de la découverte fortuite d'un nodule pulmonaire bénin faisant suspecter à tort une métastase pulmonaire. Ce résultat faux positif risque d'inquiéter inutilement la patiente, d'aboutir à des gestes invasifs supplémentaires (biopsie du nodule pulmonaire) et de retarder la mise en route de son traitement.
Intérêt et perspectives de l'imagerie TEP dans le bilan des cancers pelviens et des cancers du sein
La TEP au 18F-FDG peut être utilisée pour le bilan d'extension des cancers du col utérin de stade avancé, de l'endomètre en cas de risque élevé de métastases (figure 29.13), de l'ovaire et du sein. Elle est utile au suivi de la réponse à la chimiothérapie et à la recherche de récidive.
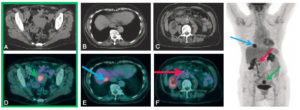
Examen TEP au 18F-FDG dans le bilan d'extension d'une tumeur du corps utérin grade 2, avec infiltration inférieure à 50 % du myomètre à l'IRM.
L'examen montre la lésion du corps utérin (flèches vertes) (A, D) associée à une lésion du segment VIII du foie (flèches bleues) (B, E) et à une atteinte lymphatique précave (flèches roses) (C, F).
Par ailleurs, dans les perspectives pour la prise en charge initiale du cancer du sein, de nouveaux médicaments radiopharmaceutiques (MRP) émergent. Leur objectif est d'identifier l'expression par les cellules tumorales de la cible moléculaire d'un agent thérapeutique, afin de mieux prédire son efficacité et d'adapter de façon individuelle le traitement. Parmi ces nouveaux MRP, citons l'exemple de l'imagerie de l'expression cellulaire des récepteurs aux œstrogènes. Le 16α-18F-fluoro-17β-œstradiol (18F-FES) est un analogue de l'œstradiol marqué au 18F ; il se fixe aux récepteurs des œstrogènes s'ils sont exprimés in vivo par les cellules tumorales. La TEP au 18F-FES permet alors de visualiser l'expression globale des récepteurs des œstrogènes par la maladie métastatique (figure 29.14). Elle est indiquée chez les patientes ayant un cancer du sein exprimant initialement les récepteurs des œstrogènes, métastatique, en rechute précoce après un traitement par hormonothérapie et lorsque la biopsie est jugée impossible. L'hormonothérapie est un traitement par anti-hormone permettant de stopper la croissance des cellules tumorales en s'opposant aux effets stimulants des estrogènes.
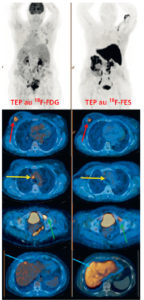
Examens TEP au 18F-FDG et au 18F-FES pour une même patiente présentant un cancer du sein métastatique.
Les lésions cancéreuses, visibles sur la TEP au 18F-FDG (images de gauche), ont une expression hétérogène des récepteurs aux œstrogènes sur la TEP au 18F-FES (images de droite) : la lésion mammaire droite fixe intensément le 18F-FES (flèches rouges), les adénopathies médiastinales ne le fixent pas (flèches jaunes), la métastase osseuse de la branche ischiopubienne gauche le fixe faiblement (flèches vertes). Enfin, la métastase hépatique n'est pas évaluable du fait du métabolisme hépatique physiologique du 18F-FES (flèches bleues).
Technique du « ganglion sentinelle » (ou du nœud lymphatique sentinelle)
Principe
La recherche du nœud lymphatique sentinelle est une technique qui vise à identifier le nœud lymphatique le plus à risque d'envahissement par les cellules malignes d'une tumeur (voir chapitre 17).
Au cours de leur évolution, certaines cellules tumorales se « détachent » de la tumeur primitive et se propagent dans l'organisme par la circulation lymphatique.
Elles vont alors être arrêtées par les nœuds lymphatiques qui se trouvent sur ce réseau lymphatique et qui fonctionnent comme des filtres. Les cellules tumorales s'y multiplient et infiltrent le tissu lymphatique. La connaissance de cet envahissement lymphatique est indispensable pour guider le choix du traitement optimal. Cette information peut être obtenue grâce à la technique du nœud lymphatique sentinelle.
Le principe du nœud lymphatique sentinelle repose sur la progression ordonnée des cellules tumorales au sein des nœuds du système lymphatique, de proche en proche, sans saut de relais lymphatique. Le premier nœud lymphatique sur cette chaîne lymphatique est appelé nœud lymphatique sentinelle. Si ce premier relais n'est pas envahi, alors les nœuds lymphatiques suivants seront également indemnes. S'il est envahi, alors les cellules tumorales ont pu diffuser dans les autres nœuds lymphatiques.
La technique du nœud lymphatique sentinelle vise à identifier le nœud lymphatique sentinelle parmi tous les autres nœuds lymphatiques locorégionaux et à permettre une exérèse/analyse sélective de ce seul nœud lymphatique. Si son analyse histologique ne montre pas d'infiltration tumorale, alors le curage lymphatique extensif (exérèse de tous les nœuds lymphatiques de cette même région) n'est pas nécessaire. L'intérêt pour la patiente est d'éviter la morbidité postopératoire d'un curage lymphatique étendu (risque de lymphœdème). Si l'analyse histologique du nœud lymphatique sentinelle révèle la présence de cellules tumorales, un curage lymphatique complet doit généralement compléter l'exérèse du nœud lymphatique sentinelle.
Indications
Son indication la plus fréquente est le cancer du sein de moins de 3 cm. Cette technique peut également être appliquée au mélanome ou, plus occasionnellement, à d'autres localisations telles que les cancers de la vulve, du col utérin, de la prostate, certains cancers ORL. Aucun envahissement lymphatique ne doit être suspecté à l'examen clinique ou à l'échographie (sinon, un curage lymphatique complet est plutôt réalisé directement).
Réalisation
La recherche du nœud lymphatique sentinelle du cancer mammaire peut se faire selon différentes méthodes.
Repérage visuel colorimétrique
Pendant l'intervention chirurgicale, le chirurgien injecte un traceur lymphotrope coloré (du bleu patenté) au sein de la tumeur ou au niveau du mamelon. Après quelques minutes, le colorant est drainé par le système lymphatique jusqu'au nœud lymphatique sentinelle, qui le « bloque » et se colore. Le nœud lymphatique sentinelle peut être repéré visuellement par le chirurgien qui fait son exérèse et l'adresse pour un examen anatomopathologique extemporané (c'est-à-dire au cours de l'acte chirurgical).
Repérage par la méthode isotopique
Quelques heures avant l'intervention, le MRP est injecté à proximité de la tumeur du sein (le plus souvent quatre injections sous-cutanées péri-aréolaires). Il s'agit de petites particules dont le diamètre va de 50 à 100 nm (sulfure de rhénium colloïdal ou nanocolloïdes d'albumine humaine), marquées au 99mTc. La taille de ces particules leur permet de circuler dans le système lymphatique, sans passer dans le système sanguin. Le transport vers les nœuds lymphatiques est rapide (quelques minutes à quelques heures).
Une lymphoscintigraphie (visualisation du drainage lymphatique du radiotraceur grâce à une gamma-caméra) est ensuite réalisée. Les images statiques sont centrées sur les régions mammaire et axillaire homolatérales afin de visualiser la ou parfois les voie(s) de drainage lymphatique amenant vers le nœud lymphatique. Le ganglion sentinelle va apparaître comme un foyer hyperfixant intense au sein de la région lymphatique axillaire, du fait de la concentration du traceur (figure 29.15). Une sonde de détection de la radioactivité permettra au chirurgien de repérer le nœud lymphatique sentinelle pendant l'intervention chirurgicale. Le nœud lymphatique sentinelle est souvent unique, mais peut parfois être multiple du fait de plusieurs conduits lymphatiques émanant de la région mammaire. Il est observé dans la région axillaire, parfois également dans la région thoracique interne.
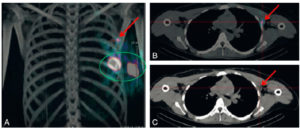
Lymphoscintigraphie aux nanocolloïdes d'albumine marquée au 99mTc d'un cancer du sein gauche.
Repérage par tomoscintigraphique couplée à une TDM : visualisation des deux points d'injection (cercle vert) et d'un nœud lymphatique sentinelle axillaire (flèches).
Essentiel à retenir
- L'exploration des affections gynécologiques se fait en première intention par une échographie pelvienne par voie sus-pubienne et endovaginale avec Doppler.
- L'exploration en pathologie mammaire se fait par mammographie et échographie. Dans certains cas, on complète le bilan par une IRM.
- L'anatomie du sein permet un accès simple aux techniques de biopsies percutanées qui peuvent se faire sous guidage mammographique, échographique ou IRM.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 28 - Imagerie de l'appareil urogénital
R. Renard-Penna et E. Durand
Plan du chapitre
- Technique et séméiologie en imagerie
- Grands syndromes cliniques
Objectifs
- Connaître les techniques d'imagerie morphologique et fonctionnelle permettant l'exploration de l'appareil urogénital.
- Connaître les principes de la scintigraphie dynamique, et son intérêt en pathologie rénale et urinaire.
- Connaître la séméiologie normale des reins, de la voie excrétrice, de l'espace rétropéritonéal, de la prostate en imagerie morphologique et fonctionnelle.
- Connaître les principaux agents diagnostiques utilisés, et les temps d'exploration nécessaires à l'étude des reins et des voies urinaires.
- Connaître les contre-indications à l'utilisation de ces produits, et la stratégie à adopter en cas d'insuffisance rénale.
- Connaître la séméiologie des grands syndromes cliniques (syndrome obstructif, lithiase urinaire, masses rénales).
Technique et séméiologie en imagerie
L'exploration des reins peut se faire par imagerie morphologique (échographie, ASP, urétro-cystographie, angiographie), fonctionnelle (scintigraphie statique ou dynamique) ou mixte, à la fois morphologique et fonctionnelle (IRM, uro-TDM, cystographie). En imagerie fonctionnelle, nombre d'agents diagnostiques utilisés sont des agents à diffusion interstitielle qui sont librement filtrés par le glomérule (cas de tous les produits de contraste en radiologie et en IRM ainsi que du 99mTc-DTPA en scintigraphie).
Échographie
L'exploration de l'appareil urinaire par les ultrasons est une méthode fiable et non agressive pouvant ainsi être facilement répétée ; elle peut également guider certains gestes invasifs (ponctions, biopsies). Elle peut être faite avec trois types de sondes (abdominale, superficielle ou endorectale). L'échographie est chez l'adulte un examen de « débrouillage » de toute affection urinaire (c'est en fonction de ses résultats que s'oriente ensuite la stratégie diagnostique), mais elle peut également être utilisée en complément de la TDM ou de l'IRM pour la caractérisation de lésions indéterminées grâce à l'échographie de contraste et à l'élastographie.
Reins : aspect normal
Les reins sont explorés en procubitus par voie latérale, le faisceau ultrasonore étant transmis à travers les fosses lombaires (figure 28.1). Le rein droit peut également être examiné par voie antérieure à travers la fenêtre acoustique constituée par le foie droit ; le rein gauche par cette voie est habituellement masqué par les gaz contenus dans le tube digestif. L'utilisation du Doppler couleur et pulsé permet l'étude de la vascularisation du rein (artères et veines). L'utilisation de produit de contraste ultrasonore (microbulles) permet l'étude de la vascularisation du rein et la caractérisation des lésions tissulaires du rein.
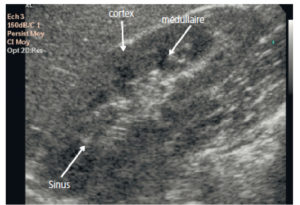
Échographie rénale : coupe longitudinale.
Le cortex apparaît discrètement hypoéchogène (comparativement au parenchyme hépatique) homogène. La médullaire est plus hypoéchogène que le cortex. Il existe donc à l'état normal une différenciation corticomédullaire.
Le cortex apparaît discrètement hypoéchogène (comparativement au parenchyme hépatique), homogène. La médullaire est plus hypoéchogène que le cortex. Il existe donc, à l'état normal, une différenciation corticomédullaire. La médullaire est constituée de structures coniques, les pyramides rénales de Malpighi, qui se présentent comme des triangles hypoéchogènes à base externe et à sommet interne. Entre ces pyramides s'insinuent les colonnes rénales de Bertin, qui sont les prolongements du cortex contenant des vaisseaux venant du sinus du rein. Les contours du rein sont nets, marqués par un liseré hyperéchogène régulier qui correspond à l'interface entre la capsule du rein et la graisse rétropéritonéale. La capsule du rein n'est pas visible de façon distincte. Le sinus du rein (formé par les éléments vasculaires, la voie excrétrice, les lymphatiques et du tissu cellulograisseux) est hyperéchogène. À l'état normal, les cavités pyélocalicielles intrarénales ne sont pas visibles.
L'échographie permet :
- l'évaluation de la hauteur du rein, de l'épaisseur du cortex et de la localisation des reins ;
- l'étude de la vascularisation rénale ;
- la détection et la caractérisation des kystes rénaux simples ;
- la découverte d'une masse solide ou kystique atypique : indication d'une échographie avec injection de produit de contraste ultrasonore ou, secondairement, d'une TDM ou d'une IRM ;
- la détection des calculs, et l'évaluation du retentissement sur les voies excrétrices (à réaliser conjointement à une radiographie de l'abdomen) ;
- la surveillance à distance postopératoire, en particulier dans la chirurgie des uropathies obstructives.
L'étude des artères rénales est facilitée par le Doppler couleur.
L'enregistrement spectral obtenu en Doppler pulsé après repérage de l'artère est composé d'un pic systolique à pente raide et d'une composante diastolique antérograde.
L'indice de résistance (IR) ou indice de Pourcelot :
IR = (Vs,max - VTD,min) / Vs,max
est calculé à partir des vitesses systolique maximale et télédiastolique minimale. C'est actuellement le plus utilisé pour évaluer les résistances artérielles périphériques du rein (normale : < 0,7).
Uretères : imagerie anatomique normale
L'uretère à l'état normal n'est pas visible. Seule sa partie terminale, dans son trajet intramural vésical, est visible sous forme d'une image hypoéchogène canalaire centrée par une petite surélévation de la muqueuse vésicale, au-dessus du trigone. On peut observer les jets urétéraux sous forme de petits échos mobiles, tourbillonnants, correspondant à l'arrivée de l'urine dans la vessie. Les ostiums urétéraux sont, quant à eux, constamment visibles, réalisant deux petites surélévations de la face luminale de la paroi vésicale (bilatérales et symétriques dans le plan axial), en continuité avec l'image intramurale des uretères.
Le repérage des ostiums urétéraux peut être facilité par l'utilisation du Doppler couleur.
Vessie : imagerie anatomique normale
L'abord sus-pubien permet l'exploration de la paroi vésicale, et évalue la contenance de la vessie et le résidu post-mictionnel. La vessie apparaît de forme variable, en fonction de son état de réplétion. Pleine ou en semi-réplétion, elle a un contenu totalement liquide, anéchogène. En réplétion, la vessie a une paroi fine et régulière, échogène et homogène. Lorsqu'elle est peu remplie, sa paroi apparaît plus épaisse. Après miction, il n'y a pas de résidu : totalement vide, la paroi et le contenu ne sont pas analysables.
L'utilisation d'une sonde endorectale permet une excellente étude endoluminale et pariétale, en particulier de la face postérieure de la vessie (siège le plus fréquent des tumeurs vésicales). Elle montre aussi la portion distale des uretères.
Prostate
L'exploration par sonde endorectale permet d'obtenir :
- une estimation plus précise du volume et de l'anatomie prostatiques ;
- une excellente étude endoluminale et pariétale de la vessie, en particulier de la face postérieure de cette dernière (siège le plus fréquent des tumeurs vésicales) ;
- une étude de la portion distale des uretères.
La prostate apparaît sous forme grossièrement triangulaire avec un sommet situé vers le bas correspondant à l'apex et une base vers le haut au contact du trigone vésical, se prolongeant par les vésicules séminales. Elle est modérément hypoéchogène. L'anatomie zonale est bien appréciée par la voie endorectale.
Testicules
Une sonde haute fréquence est utilisée en pathologies scrotale, testiculaire et épididymaire. L'échographie est l'examen de référence pour l'exploration de la pathologie testiculaire (pathologie infectieuse, tumorale, bilan d'infertilité)
Abdomen sans préparation (ASP)
L'ASP est réalisé en décubitus dorsal. Il s'agit d'une radiographie couvrant la totalité de l'arbre urinaire depuis le pôle supérieur du rein le plus haut jusqu'à la symphyse pubienne en bas. Les reins, de tonalité hydrique, ne sont visibles sur l'ASP que si la graisse rétropéritonéale est en quantité suffisante. La ligne des psoas se détache de T12 et descend obliquement en bas et en dehors vers la crête iliaque. Elle est rectiligne ou très légèrement convexe chez les sujets athlétiques. Le principal intérêt actuel de l'ASP est la recherche d'un calcul radio-opaque en projection de l'arbre urinaire. Il est de moins en moins souvent pratiqué.
Urographie intraveineuse (UIV)
L'UIV consiste à acquérir une série de clichés radiologiques après une injection intraveineuse de 60 à 100 ml d'un produit de contraste iodé hydrosoluble à élimination urinaire, permettant l'opacification de l'urine ainsi que la visualisation du parenchyme rénal et des cavités excrétrices. Le produit atteint l'artère rénale en une quinzaine de secondes ; il est éliminé par filtration glomérulaire puis collecté dans les cavités excrétrices ; ainsi, progressivement, l'urine opaque vient remplacer l'urine non opaque préexistante dans les cavités excrétrices.
Le déroulement habituel de l'examen comprend :
- cliché 0 : ASP après miction ;
- cliché à 3 minutes après injection de produit de contraste : opacification du parenchyme rénal (néphrographie) ;
- de 5 à 10 minutes : visibilité des cavités pyélocalicielles ;
- cliché toutes les 10 minutes : étude des cavités pyélocalicielles, des uretères et du remplissage initial de la vessie.
À la fin de l'étude, on prend un cliché prémictionnel centré sur la vessie, puis per- et post-mictionnel. Cet examen a presque disparu, supplanté par l'uro-TDM, mais garde quelques rares indications spécialisées dans les contrôles postopératoires.
Tomodensitométrie (TDM)
L'examen TDM est l'examen de référence pour l'exploration des reins (pathologies tumorale, lithiasique, infectieuse), de l'arbre urinaire, pour les bilans d'extension des tumeurs vésicales.
Technique
L'examen est principalement fondé sur l'étude des différentes phases de diffusion du produit de contraste iodé injecté par voie intraveineuse. Il permet ainsi d'analyser le parenchyme rénal aux différentes phases de son rehaussement ainsi que la sécrétion de produit de contraste au niveau des cavités urinaires.
On distingue quatre phases d'étude pour les reins et l'arbre urinaire (voir figure 28.2) :
- la phase sans injection de produit de contraste ;
- la phase artérielle ou corticale isolée (phase corticomédullaire, 30 à 45 secondes après l'injection intraveineuse) ;
- la phase parenchymateuse ou tubulovasculaire (néphrographique 90 à 120 secondes après l'injection intraveineuse) ;
- la phase dite « excrétoire » ou pyélocalicielle (> 180 secondes après l'injection intraveineuse).
On parle d'uro-TDM lorsqu'une acquisition est réalisée au temps « excrétoire » pour l'étude de la voie excrétrice.
On parle de TDM rénale lorsqu'il s'agit d'une TDM abdominopelvienne sans injection (bilan de colique néphrétique) ou pour les TDM injectées limitées à un temps cortical et médullaire (étude des infections, des tumeurs rénales, etc.).
L'inconvénient majeur de la TDM est l'exposition aux rayonnements ionisants. Les indications doivent donc être bien posées, les acquisitions, ainsi que la répétition des examens, limitées. Après chaque examen TDM, la dose d'irradiation délivrée au patient doit être précisée sur le compte-rendu. Cet examen est contre-indiqué pendant la grossesse, et les précautions à prendre avant l'injection de produit de contraste iodé doivent être respectées (insuffisance rénale, intolérance aux produits de contraste (voir chapitre 4).
Séméiologie
Reins
Les reins sont situés dans la fosse lombaire (figure 28.2). Sur les coupes axiales, ils apparaissent grossièrement ovales. Dans la région du hile, ils prennent un aspect en U ouvert en dedans et en avant. Les vaisseaux du pédicule sont également visibles sous forme de structures tubulaires avec un plan veineux situé en avant du plan artériel. L'épaisseur du parenchyme rénal décroît normalement avec l'âge. La longueur normale du rein est égale à la distance séparant le bord supérieur de L1 à la partie moyenne de L4 (soit trois vertèbres et demie).
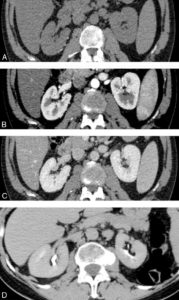
Examen tomodensitométrique des reins. Quatre phases d'étude des reins et de l'arbre urinaire.
A. Sans injection. B, C. Néphrogramme corticomédullaire : 30–45 secondes, « tubulocapillaire » (B) et supérieur à 90 secondes, « néphronique » (C). D. Dite « excrétoire « ou » pyélocalicielle » (300–480 secondes).
Phase sans injection de produit de contraste
Lors de cette phase, le parenchyme rénal est homogène, avec une densité comprise entre 35 et 55 UH. C'est la phase la plus sensible pour la détection des calculs. Elle permet l'évaluation des densités spontanées des masses (calcification, hémorragie, graisse, évaluation de la densité en UH).
Phase corticale
Cette phase débute 30 à 45 secondes après le début de l'injection de produit de contraste en bolus. La prise de contraste débute par le rehaussement intense du cortex rénal isolé (120 UH et plus), alors que la médullaire est hypodense (différenciation corticomédullaire).
Cette phase est essentielle pour la détection des anomalies du cortex, les déficits de perfusion, l'analyse des syndromes tumoraux (rénaux et urothéliaux) et pseudo-tumoraux (hypertrophie d'une colonne de Bertin). Elle permet également d'apprécier le nombre et la disposition des artères rénales et des veines rénales qui sont rehaussées de façon extrêmement précoce, ainsi que la recherche de localisation à distance pour le bilan d'extension.
Phase parenchymateuse ou néphrographique
La phase parenchymateuse ou tubulovasculaire débute environ 60 secondes après le début de l'injection et dure environ 60 secondes. Elle est caractérisée par l'opacification de la médullaire rénale lors de l'arrivée du produit de contraste dans les tubes collecteurs, alors que la densité du cortex diminue. Le parenchyme rénal s'est homogénéisé et les deux compartiments, cortex et médullaire, ne sont plus distinguables l'un de l'autre. Les vaisseaux rénaux sont encore opacifiés, d'où le nom de phase tubulovasculaire.
Cette phase est plus adaptée pour la détection et la caractérisation de masses rénales, pour la détection des lésions infectieuses (foyer de pyélonéphrite).
Phase pyélocalicielle dite « excrétoire »
L'apparition du produit de contraste dans les cavités pyélocalicielles (souvent appelée « sécrétion » en séméiologie radiologique) se fait normalement avant la 3e minute et est maximale à un temps tardif réalisé à environ 7 à 8 minutes (éventuellement potentialisée par l'injection d'un diurétique créant une hyperdiurèse, ou par une hyperhydratation).
C'est l'obtention de cette phase au temps excrétoire qui définit l'uro-TDM.
C'est sur cette phase que l'arbre urinaire est étudié. Les reconstructions dans un plan coronal et dans les trois dimensions de l'espace (volume rendering, maximum intensity projection [MIP]) permettent l'obtention d'une urographie reconstruite.
Cavités pyélocalicielles (figure 28.3)
Les calices mineurs (petits calices) sont au nombre d'une douzaine en moyenne. Ils répondent au sommet de chaque papille. Chaque calice mineur est composé :
- d'une cupule concave en dehors ;
- d'une tige calicielle courte qui réunit la cupule au calice majeur.
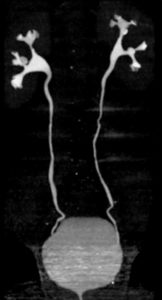
Uro-TDM : phase excrétoire, reconstruction dans le plan coronal pour obtenir un équivalent urographique.
Les calices majeurs (groupes caliciels), typiquement au nombre de trois, sont formés par la réunion de trois ou quatre calices mineurs. Le calice majeur supérieur est typiquement vertical, le calice majeur moyen horizontal, le calice majeur inférieur oblique en bas et en dehors.
Le pelvis rénal (bassinet ou pyélon) est formé par la convergence des trois calices majeurs. Il a une forme triangulaire. Son bord supérieur est convexe et son bord inférieur, concave en bas, dessine avec le calice majeur inférieur et l'uretère une arche qui épouse la forme de la lèvre inférieure du sinus. Le sommet du triangle correspond à la jonction pyélo-urétérale.
La morphologie du pelvis rénal est très variable : parfois absent (les calices majeurs confluent pour former directement l'uretère), parfois volumineux à développement extrasinusal.
Uretères
Les uretères font suite au pelvis rénal à hauteur de L2 et cheminent en avant des grands psoas en se dirigeant vers le bas, accompagnés des vaisseaux gonadiques.
Chez l'adulte, les uretères ont une longueur de 25 à 30 cm. On leur distingue trois segments : lombaire, iliaque et pelvien.
- L'uretère lombaire descend en avant du grand psoas, croisant de dehors en dedans les processus costiformes transverses des trois dernières vertèbres lombaires.
- L'uretère iliaque se projette sur l'aileron sacré, en dedans de l'articulation sacro-iliaque.
- L'uretère pelvien décrit une courbe convexe en dehors, parallèle au bord interne de l'os coxal. Les derniers centimètres de l'uretère, horizontaux, correspondent en partie au segment intravésical ou intramural.
Le calibre moyen de l'uretère est de 5 mm. Les uretères présentent ainsi deux portions plus larges (appelées cystoïdes) situées entre trois rétrécissements physiologiques :
- la jonction pyélo-urétérale ;
- le croisement avec les vaisseaux iliaques communs ;
- l'uretère intramural.
L'hyperdiurèse (obtenue avec l'injection d'un diurétique de l'anse) permet d'obtenir une bonne visibilité des uretères sur toute la hauteur. La reconstruction en deux et trois dimensions permet d'obtenir au temps excrétoire un équivalent d'UIV reconstruite.
Vessie
La vessie est de forme ovale, à grand axe transversal ou antéropostérieur. Lorsque la réplétion vésicale est satisfaisante, la paroi est fine et régulière, de densité tissulaire homogène, de contours nets (excellent contraste avec la graisse périvésicale). Le contenu vésical est totalement liquide, hypodense.
Si la vessie est vide, la paroi apparaît très épaisse et le contenu peut ne pas être visualisé. Après injection intraveineuse de produit de contraste, la paroi vésicale se rehausse modérément, de façon homogène. Sur les coupes tardives réalisées au temps excrétoire (au minimum 3 minutes après injection), le produit de contraste arrive par les uretères dans la lumière vésicale. Comme il est plus dense que l'urine, il est déclive, réalisant au début un niveau horizontal entre l'urine non opacifiée et opacifiée. En quelques minutes, l'urine opacifiée remplit entièrement la vessie.
Prostate
La prostate présente un aspect circulaire ou ovalaire et est parfaitement limitée. Elle est homogène, de densité tissulaire (parfois, quelques calcifications banales sont visibles au sein du tissu prostatique). Elle est entièrement entourée de graisse. La TDM n'est pas adaptée à l'étude de la prostate, car elle ne parvient pas à préciser l'anatomie zonale de la prostate et ne permet pas l'analyse du parenchyme prostatique.
Vésicules séminales
Les vésicules séminales sont grossièrement ovales à grand axe transversal, de densité intermédiaire entre la densité tissulaire et la densité liquidienne.
Vaisseaux rénaux
Les vaisseaux rénaux sont maintenant très bien analysés en TDM, grâce à l'acquisition millimétrique qui permet d'obtenir l'équivalent d'une angiographie avec les reconstructions multiplanaires et curvilignes. Les variantes anatomiques artérielles et veineuses sont nombreuses ; les vaisseaux surnuméraires ou polaires sont fréquents.
Espaces et fascias rétropéritonéaux
Les reins, les surrénales et la graisse périrénale sont entourés par le fascia rénal (de Gerota). Celui-ci comporte deux feuillets : l'un antérieur, l'autre postérieur. Latéralement, ces deux feuillets fusionnent pour former le fascia latéroconal. La capsule rénale, qui est en contact étroit avec le parenchyme, n'est pas individualisable à l'état normal en TDM.
Surrénales
La surrénale droite est située immédiatement en arrière de la veine cave inférieure et s'étend postéro-latéralement, parallèlement au pilier droit du diaphragme. La surrénale gauche est située en dehors de l'aorte et du pilier gauche du diaphragme, derrière la queue du pancréas et les vaisseaux spléniques, en avant et en dedans du pôle supérieur du rein gauche.
Normalement, l'épaisseur d'un bras est d'environ 5 à 8 mm. Une épaisseur de 10 mm et plus doit être considérée comme pathologique. La densité spontanée des surrénales est entre 25 et 40 UH.
Imagerie par résonance magnétique (IRM)
Technique
L'examen comprend des séquences anatomiques et fonctionnelles. Les séquences en pondération T2, en pondération T1 avant et après injection de gadolinium sans et avec saturation de la graisse et les séquences de diffusion. Les séquences sont obtenues dans les trois plans de l'espace.
Les contre-indications sont les contre-indications générales de l'IRM (voir chapitre 8). Les limites de l'IRM sont essentiellement dues à la résolution spatiale moins bonne que celle de la TDM, en particulier pour l'analyse de l'arbre urinaire ; cependant, l'évolution technique des dernières IRM permet d'obtenir une résolution spatiale quasi identique à celle d'une TDM.
L'IRM est une technique d'imagerie peu invasive, très performante pour l'analyse des reins et fournit des informations d'ordre morphologique sur l'ensemble de l'appareil urinaire (vaisseaux du rein, parenchyme rénal, voie excrétrice supérieure et vessie, bas appareil urinaire) et fonctionnel (sur la fonction rénale et le drainage du produit de contraste).
Elle est particulièrement utile chez les patients pour lesquels un examen TDM ne peut pas être réalisé. Elle peut également être prescrite en complément d'une TDM ; elle s'intègre alors dans quatre indications principales :
- caractérisation d'une tumeur tissulaire ou kystique (mise en évidence d'un rehaussement lésionnel, détection de cloisons et de végétations, analyse de la paroi) ;
- surveillance d'une tumeur rénale opérée (si la fonction rénale est altérée) ;
- bilan d'extension veineuse d'une tumeur rénale déjà étudiée en TDM ;
- bilan de maladie vasculaire artérielle.
Séméiologie
IRM rénale
Sur les séquences en pondération T1, le signal du cortex est plus important que celui de la médullaire, celle-ci prenant un aspect de zones triangulaires, à base externe, en hyposignal (figure 28.4). Le sinus du rein est le siège d'un hypersignal T1 proche de celui du rétropéritoine, lié à son contenu essentiellement graisseux.
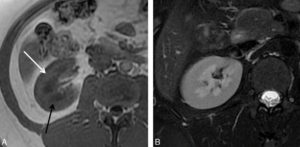
IRM rénale.
Sur les séquences en pondération T1 (A), le signal du cortex (flèche blanche) est plus important que celui de la médullaire (flèche noire), celle-ci prenant un aspect de zones triangulaires, à base externe, en hyposignal. Le sinus du rein est le siège d'un hypersignal T1 proche de celui du rétropéritoine, lié à son contenu essentiellement graisseux. Sur les séquences en pondération T2 (B), hypersignal homogène du parenchyme sur les séquences pondérées T2.
Sur les séquences en pondération T2, la deuxième particularité de signal du parenchyme rénal est liée à son temps de relaxation T2 assez long qui est à l'origine d'un hypersignal homogène du parenchyme sur les séquences pondérées T2.
L'injection d'un produit de contraste paramagnétique (complexes de gadolinium) est responsable d'un rehaussement homogène de l'ensemble du parenchyme rénal sur les séquences pondérées T1. Les séquences dynamiques réalisées précocement après injection du gadolinium montrent un rehaussement précoce du cortex, suivi d'une homogénéisation rapide du signal (temps tubulaire). Elles permettent d'estimer la fonction rénale relative (pourcentage de fonction assuré par chacun des deux reins).
Actuellement, l'uro-TDM est l'examen de référence pour l'exploration des tumeurs urothéliales car il offre une meilleure résolution spatiale. L'uro-IRM est réservée aux patients présentant une contre-indication à la TDM (intolérance aux produits de contraste iodés, radiosensibilité anormale d'origine génétique) ou à la fonction rénale altérée, à condition d'utiliser des chélates de gadolinium macrocycliques stables. Une uro-IRM est obtenue après opacification de l'arbre urinaire sur les temps tardifs après l'injection de gadolinium en pondération T1 et d'un diurétique de l'anse. Le type et la dose de produit de contraste injecté sont adaptés pour éviter le risque de fibrose néphrogénique systémique.
IRM pelvienne
L'IRM pelvienne est particulièrement intéressante en pathologie tumorale vésicale et prostatique. Sa résolution est supérieure à celle de la TDM dans l'estimation de l'extension tumorale locale.
IRM vésicale
L'IRM vésicale peut être indiquée pour le bilan d'extension locale d'une tumeur de la vessie en complément d'une uro-TDM.
IRM prostatique
L'IRM prostatique est l'examen de référence pour :
- la détection et le diagnostic du cancer de la prostate ;
- le bilan d'extension locorégional du cancer de la prostate (extension à l'espace périprostatique, aux vésicules séminales et aux chaînes lymphatiques).
Elle est également utile en cas de suspicion de récidive de cancer de la prostate.
Scintigraphie dynamique
La scintigraphie dynamique consiste à suivre la distribution d'un médicament radiopharmaceutique (MRP) injecté en intraveineux excrété par le rein, avec une acquisition en mode cinéma. Cet examen revient à réaliser l'équivalent d'une UIV à faible résolution spatiale mais permettant une quantification. Contrairement à l'UIV ou à l'uro-TDM, l'irradiation est faible (de l'ordre de 1 mSv). Le MRP injecté peut être : un traceur glomérulaire (principalement le 99mTc-DTPA), qui trace donc la filtration glomérulaire ; un traceur tubulaire (principalement le mertiatide, 99mTc-MAG3) (figure 28.5).
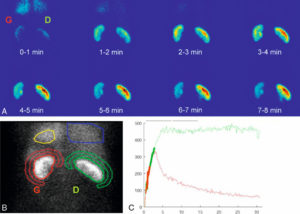
Images de scintigraphie dynamique au 99mTc-MAG3.
A. Série de huit images d'une minute montrant l'évolution de la captation du traceur : vasculaire, puis parenchymateuse, puis urinaire. B. Dessin des régions d'intérêt autour des reins, du VG et d'un poumon, permettant la quantification. C. Courbes d'évolution de la quantité de traceur dans les reins : les deux reins ont la même fonction (50 %/50 %) ; le rein gauche a un drainage rapide, mais le rein droit a un drainage nettement ralenti en raison d'un syndrome de la jonction pyélo-urétérale.
Cet examen permet d'apprécier :
- la perfusion rénale de manière semi-quantitative ;
- la répartition fonctionnelle relative (pourcentage du rein gauche par rapport au rein droit) ;
- le drainage des urines vers les voies urinaires ; pour ce dernier, la scintigraphie se fait sous test d'hyperdiurèse (hydratation et diurétique de l'anse).
La mesure des fonctions relatives permet d'apprécier le retentissement d'une affection touchant un seul rein (en pathologie obstructive ou infectieuse).
Elle permet aussi de prédire la fonction résiduelle après néphrectomie. L'acquisition se fait en projection postérieure. Le rein droit apparaît donc à droite de l'image.
Angiographie
L'échodoppler, la TDM et l'IRM ont considérablement réduit les indications des explorations vasculaires. L'artériographie par voie percutanée ne garde à ce jour que des indications essentiellement à visée thérapeutique.
Scintigraphie corticale
La scintigraphie corticale consiste à injecter un traceur, en pratique le 99mTc-DMSA (figure 28.6), qui s'accumule lentement dans le parenchyme rénal fonctionnel. Les images sont acquises tardivement (au moins 2 heures après injection). Elles montrent :
- la répartition fonctionnelle relative (pourcentage du rein gauche par rapport au rein droit) ;
- l'état du parenchyme fonctionnel : on peut notamment visualiser des encoches hypofonctionnelles en cas de pyélonéphrite aiguë ou de cicatrice de pyélonéphrite ou de lésion de reflux.
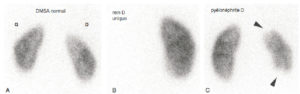
Images de scintigraphie statique au 99mTc-DMSA.
A. Examen normal. B. Rein droit fonctionnellement unique. C. Rein droit montrant des séquelles de pyélonéphrite aiguë infectieuse (têtes de flèche) avec une fonction relative à 36 %. Les images sont toujours montrées en vue postérieure.
Mesures de clairance
La fonction rénale absolue (débit de filtration glomérulaire [DFG]) ne peut pas être obtenue par imagerie. Elle peut soit être estimée de manière grossière par une formule (Cockcroft et Gault ou modification of the diet in renal disease [MDRD] ou chronic kidney disease epidemiology collaboration [CKD-EPI]) à partir d'un dosage de créatininémie, soit être mesurée de manière précise par une mesure de clairance isotopique.
Bien qu'elles ne soient pas à proprement parler des techniques d'imagerie, les mesures de clairance isotopiques sont des techniques diagnostiques de médecine nucléaire. Le principe est simple : injecter un traceur en intraveineux, puis mesurer son élimination rénale pour déterminer la fonction groupée des deux reins.
Le médicament injecté est un traceur glomérulaire, désormais le 99mTc-DTPA, le 51mCr-EDTA étant indisponible. On peut :
- soit suivre la décroissance de sa concentration plasmatique au moyen de quelques prélèvements sanguins (clairance plasmatique) ;
- soit observer son élimination dans les urines en faisant à la fois des prélèvements sanguins et des recueils urinaires (clairance urinaire).
Si l'on veut connaître la fonction d'un rein, il faut donc à la fois mesurer une clairance globale (par exemple 120 mL/min/1,73 m2) et réaliser une scintigraphie rénale pour obtenir la fonction rénale relative (par exemple rein droit : 30 % ; rein gauche : 70 %). Dans l'exemple fourni, la fonction du rein droit est de 36 mL/min/1,73 m2.
Cystographie rétrograde (ascendante) ou sus-pubienne
La cystographie est un examen qui consiste à remplir la vessie de produit de contraste dilué après sondage. Elle peut être réalisée en radiographie avec des produits de contraste iodé ou en échographie avec des microbulles.
Elle peut être soit rétrograde par mise en place d'une sonde vésicale à travers l'urètre, soit sus-pubienne par ponction directe de la vessie à travers la paroi abdominale dans la région sus-pubienne (en cas d'impossibilité de sondage).
L'étude pré-, per- et post-mictionnelle comporte un ou plusieurs clichés en cours de miction et un cliché après miction. Cet examen est utilisé pour rechercher un reflux vésico-urétéral et n'a pas d'équivalent en imagerie en coupes. Dans les cas les plus difficiles, il est aussi possible de réaliser une cystoscintigraphie selon le même principe qu'en médecine nucléaire, ce qui peut mettre en évidence des reflux discrets, peu visibles en cystographie conventionnelle.
Urétrographie rétrograde (ascendante)
L'urétrographie rétrograde (ascendante) consiste en l'injection à contre-courant d'un produit de contraste dans l'urètre et comporte donc :
- une phase rétrograde donnant des informations sur la morphologie de l'urètre antérieur ;
- une phase d'analyse du remplissage vésical (avec des clichés de face et obliques) ;
- une phase permictionnelle descendante, succédant au remplissage complet de la vessie.
L'urétrographie rétrograde est toujours utilisée car elle seule permet une étude morphologique plus fine de l'urètre dans ses différents segments et est intéressante dans le cadre de l'exploration d'une pathologie urétrale, notamment d'origine prostatique chez l'homme.
Grands syndromes cliniques
Syndrome obstructif
L'obstruction est définie comme une gêne à l'écoulement de l'urine vers les voies urinaires qui, en l'absence de traitement, entraîne une diminution de la fonction rénale ou, chez l'enfant, compromet le développement de la fonction. Le mécanisme classiquement invoqué pour cette atteinte rénale est une élévation de pression dans les voies urinaires en amont de l'obstacle entraînant une souffrance rénale.
Le syndrome obstructif se traduit par des anomalies fonctionnelles :
- retard d'apparition de la néphrographie, néphrographie prolongée, retard d'opacification des cavités excrétrices en uro-TDM ou uro-IRM ; ralentissement du drainage en scintigraphie dynamique ;
- morphologiquement : une dilatation de la voie excrétrice en amont de l'obstacle visible en échographie, TDM, IRM et scintigraphie ;
- baisse de fonction rénale du ou des reins concernés, visible en scintigraphie.
On distingue deux types d'obstruction : le syndrome obstructif aigu et le syndrome obstructif chronique.
Obstruction aiguë
L'obstruction aiguë est douloureuse. La dilatation des cavités est modérée, voire absente. L'absence de dilatation des cavités pyélocalicielles peut être une source de faux négatif. Lorsqu'elle est présente, la dilatation des cavités peut être importante, mais il n'y a pas de modification du parenchyme, en particulier pas d'amincissement qui serait alors en faveur d'une obstruction chronique. Il peut exister une néphromégalie, une infiltration de la graisse périrénale, voire un épanchement autour du rein. Elle se manifeste par une dilatation des cavités pyélocalicielles, sans amincissement du parenchyme rénal.
En scintigraphie dynamique, les traceurs tubulaires sont initialement sécrétés mais mal drainés, donnant une image de fixation très intense du rein atteint. En revanche, les traceurs glomérulaires sont généralement peu filtrés s'il y a un retentissement sur la fonction, donnant au contraire une image de rein hypofixant.
Cas particulier de la colique néphrétique
L'objectif de l'imagerie dans ce contexte est d'identifier le calcul et d'évaluer le retentissement sur les voies urinaires. Deux stratégies sont disponibles.
Couple ASP-échographie
L'ASP permet de mettre en évidence un calcul radio-opaque en projection des voies urinaires, d'estimer sa taille, sa localisation. Il permettra de faire la différence entre un calcul urinaire et un calcul biliaire, des calcifications pancréatiques, aortiques, des phlébolites pelviens.
Un calcul est radio-opaque s'il est visible sur l'ASP. Un calcul est radiotransparent s'il est visible en échographie mais pas sur l'ASP.
L'échographie permet de confirmer le diagnostic clinique de colique néphrétique aiguë en identifiant le calcul et la dilatation urétérale. Elle permet également d'identifier les calculs radiotransparents (figure 28.7).
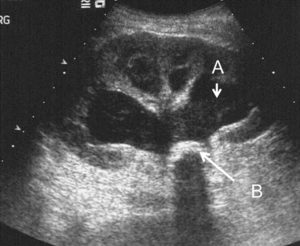
Échographie rénale dans le cadre d'une colique néphrétique.
A. Dilatation des cavités rénales correspondant à une zone hypo- ou anéchogène centro-sinusienne. B. En amont d'un obstacle lithiasique : calcul correspondant à un arc échogène suivi d'un cône d'ombre postérieur.
En échographie, le calcul montre un arc échogène suivi d'un cône d'ombre postérieur. Le calcul est particulièrement bien visible lorsqu'il est situé au niveau de l'uretère pelvien rétrovésical, ou au niveau de l'uretère lombaire sous-jonctionnel. En revanche, l'analyse de la portion iliaque de l'uretère est difficile ; les calculs enclavés au niveau du promontoire sont le plus souvent non détectés en échographie.
Dilatation des cavités pyélocalicielles
On retrouve :
- une dilatation pyélique (ou du pelvis) : zone hypo- ou anéchogène centrosinusienne, dont la topographie est reconnue sur deux incidences ;
- des dilatations calicielles : poches liquidiennes périphériques.
On recherchera des complications comme la rupture de fornix qui correspond à un épanchement périrénal sous la forme d'une lame hypoéchogène périrénale.
Examen tomodensitométrique (TDM)
Dans cette indication, la TDM doit être réalisée sans injection de produit de contraste et avec une dose très basse d'irradiation. C'est l'examen le plus performant pour le diagnostic de colique néphrétique (figure 28.8).
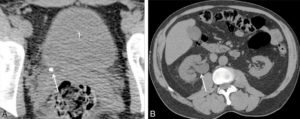
TDM abdominopelvienne sans injection de produit de contraste dans le cadre d'une colique néphrétique droite.
Calcul du méat urétéral droit (A) (flèche) – 1 : vessie –, responsable d'une dilatation urétérale et pyélocalicielle droite (B) (flèche).
Cet examen permettra de faire :
- le bilan complet du calcul (localisation, taille, densité, évaluation de la composition chimique). Tous les types de calculs sont visibles en TDM, sauf d'exceptionnels calculs médicamenteux ;
- l'évaluation de la dilatation des cavités : même sans injection de produit de contraste, la TDM permettra d'identifier une dilatation asymétrique de l'uretère et des cavités pyélocalicielles en amont de l'obstacle. En cas de doute diagnostique, elle permet la recherche d'éventuels diagnostics différentiels. La rentabilité de l'examen tomodensitométrique est nettement supérieure à celle du couple ASP-échographie. Cependant, pour limiter l'irradiation, il doit être effectué en adaptant les paramètres (acquisition à basse dose d'irradiation), et pas de façon répétitive.
Syndrome obstructif chronique
Le cas d'une dilatation chronique des cavités pyélocalicielles, souvent indolore, est plus difficile à évaluer. S'il s'agit bien d'une obstruction, par définition, elle finit par entraîner un retentissement sur le parenchyme rénal.
L'obstruction chronique se fait en plusieurs étapes :
- réplétion des cavités sans distension, avec conservation de l'épaisseur du parenchyme rénal ;
- distension modérée des cavités avec réduction de l'épaisseur du parenchyme rénal ;
- distension majeure des cavités (calices en boule, perte de la concavité du bord inférieur du pelvis) avec réduction de l'épaisseur du parenchyme rénal.
Les anomalies fonctionnelles caractéristiques du syndrome obstructif sont également présentes : retard d'apparition de la néphrographie, néphrographie prolongée, retard d'opacification de la voie excrétrice, drainage ralenti, diminution de la fonction relative du côté atteint en cas d'atteinte unilatérale.
Conduite à tenir devant un syndrome obstructif
Le diagnostic est évoqué :
- parfois devant des douleurs lombaires ;
- parfois de manière fortuite, un examen d'imagerie (TDM ou échographie) révélant une dilatation des cavités ;
- assez fréquemment lors d'une échographie anténatale.
Il faut alors :
- apprécier le retentissement sur le parenchyme rénal (état morphologique du parenchyme par échographie ou TDM ; fonction relative par scintigraphie ou IRM) ;
- localiser le siège et la nature de l'obstacle (la TDM est l'examen de référence chez l'adulte) ;
- dans les cas des atteintes congénitales, évaluer le ralentissement du drainage par scintigraphie dynamique sous hyperdiurèse ou en IRM ; les hydronéphroses congénitales sont en effet assez souvent bien tolérées et n'imposent pas toujours d'intervention.
Les causes du syndrome obstructif du haut appareil urinaire sont multiples :
- corps étranger endoluminal : calcul le plus fréquemment, mais aussi caillots ;
- origine pariétale :
- tumeur bénigne ou maligne végétante ou sténosante ;
- sténose post-infectieuse (tuberculose) ou parasitaire (bilharziose), post-radique, post-chirurgicale ou post-traumatique ;
- congénitale : syndrome de la jonction pyélo-urétérale, méga-uretère.
- origine extrinsèque :
- tumeur rénale ou extrarénale, notamment gynécologique ;
- fibrose rétropéritonéale.
Exploration des masses et tumeurs
Exploration d'une masse rénale
Échographie
L'échographie permet de différencier :
- une formation purement liquidienne ou kyste (totalement anéchogène avec renforcement postérieur du faisceau ultrasonore), de contours nets, sans paroi nettement individualisable : il s'agit d'un kyste simple parenchymateux (kyste cortical banal) ou parapyélique (développé dans le sinus du rein) (figure 28.9). Le kyste banal typique est de découverte fortuite et n'oblige pas à des explorations complémentaires. Quelques formes doivent attirer l'attention : les kystes bénins multiples, la dysplasie multikystique unilatérale, la maladie polykystique qui est généralisée ;
![Figure 28.9 Échographie rénale. Kyste simple du rein, formation purement liquidienne (totalement anéchogène avec renforcement postérieur du faisceau ultrasonore [flèches]), de contours nets, sans paroi nettement individualisable. Il s'agit d'un kyste simple parenchymateux (kyste cortical banal).](https://www.cnp-mn.fr/wp-content/uploads/2023/01/Les-fondamentaux-28.9-300x241.jpg)
Échographie rénale.
Kyste simple du rein, formation purement liquidienne (totalement anéchogène avec renforcement postérieur du faisceau ultrasonore [flèches]), de contours nets, sans paroi nettement individualisable. Il s'agit d'un kyste simple parenchymateux (kyste cortical banal).
- une formation solide, d'échostructure iso-, hypo- ou hyperéchogène par rapport au cortex rénal adjacent, homogène ou hétérogène, hypervascularisée en Doppler couleur, de contours plus ou moins réguliers ; toute tumeur solide doit être considérée comme maligne jusqu'à preuve du contraire ;
- une formation mixte, à composante liquidienne et solide : il peut s'agir notamment d'un kyste atypique bénin, d'une tumeur maligne nécrosée ou d'un processus infectieux (abcès).
L'analyse en Doppler permet de rechercher une vascularisation intratumorale et de compléter le bilan d'extension en recherchant une thrombose veineuse au niveau de la veine rénale et son éventuelle extension à la veine cave inférieure (VCI).
TDM
La TDM, examen de référence, permet de différencier une masse de type solide ou mixte, dont la prise en charge est chirurgicale, d'une formation strictement liquidienne, toujours bénigne (et ne nécessitant donc aucun traitement) (figure 28.10). La TDM est donc indispensable dès que le syndrome de masse tumorale visualisé en échographie ne correspond pas à une formation liquidienne présentant tous les caractères ultrasonores habituels d'un kyste simple parenchymateux ou parapyélique. Elle doit être effectuée sans, puis avec injection de produit de contraste aux temps cortical, néphrographique et excrétoire.
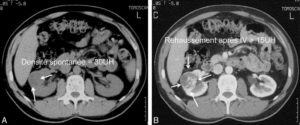
TDM rénale, sans injection (A), et après injection à la phase corticale (B).
Masse solide du rein droit : lésion encapsulée, hétérogène, avec une double composante solide, tissulaire hypervascularisée, et nécrotique ou nécrotico-hémorragique (flèches). L'injection de produit de contraste montre un rehaussement de densité précoce et intense des zones charnues, alors que les plages de nécrose sont avasculaires.
Si la masse est solide, on recherchera, avant injection :
- un syndrome de masse de densité spontanée tissulaire (> 20 UH) déformant les contours du rein ou comblant le sinus rénal ;
- des hyperdensités spontanées (calcifications, hémorragie) ;
- des hypodensités graisseuses (< 0 UH) ;
- des hypodensités liquidiennes (< 20 UH).
Après injection de produit de contraste (temps cortical et néphrographique), on recherchera une prise de contraste supérieure à 15 UH entre la phase non injectée et la phase néphrographique qui signe une lésion solide.
Le cancer du rein typique se présente sous forme d'une lésion encapsulée, hétérogène, avec une double composante solide, tissulaire hypervascularisée, et nécrotique ou nécrotico-hémorragique. L'injection de produit de contraste montre un rehaussement de densité précoce et intense des zones charnues, alors que les plages de nécrose sont avasculaires. Des éléments caractéristiques mais inconstants sont des calcifications intratumorales, l'envahissement de la veine rénale et de la VCI.
Les critères tomodensitométriques (TDM) de bénignité d'une masse rénale kystique sont :
- densité homogène, voisine de celle de l'eau (de − 15 à 20 UH) ;
- absence de rehaussement (< 15 UH) de la densité de la masse après injection de produit de contraste ;
- contours nets ;
- paroi externe très fine et régulière.
IRM
L'IRM peut aider à la caractérisation (caractère tissulaire ou non) d'une masse atypique pour laquelle un diagnostic de certitude n'a pas pu être posé par l'échographie et la TDM (masse kystique atypique le plus souvent) (figure 28.11). En effet, l'IRM est très sensible à la présence du produit de contraste et permet donc d'identifier plus facilement le caractère solide des lésions. La séquence de diffusion permet également de préciser la caractérisation tissulaire. Les critères morphologiques sont les mêmes qu'en TDM.
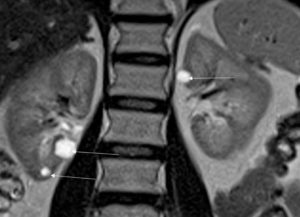
IRM rénale : séquence coronale T2 centrée sur les reins.
Présence de trois formations arrondies (flèches) bien limitées à contours nets, sans paroi, sans cloison, en hypersignal T2 évoquant des kystes simples du rein (deux au niveau du pôle inférieur du rein droit et un au niveau du pôle supérieur du rein gauche).
Vessie
L'échographie peut montrer une lésion tissulaire végétante : il y a alors indication d'une cystoscopie et d'une uro-TDM pour le bilan d'extension.
Prostate
L'échographie ne permet pas de détecter des tumeurs prostatiques, mais l'échographie endorectale permet de guider les biopsies.
Pathologie infectieuse
Les cystites simples ne nécessitent pas d'examen d'imagerie. En revanche, les infections urinaires fébriles (pyélonéphrites) nécessitent au moins une échographie pour vérifier l'absence d'obstacle. Dans les cas difficiles, une scintigraphie corticale peut aider à porter le diagnostic puis à apprécier d'éventuelles séquelles parenchymateuses.
Une pyélonéphrite chez l'homme et une pyélonéphrite récidivante chez la femme doivent faire rechercher un reflux vésicorénal par une cystographie.
Imagerie uronéphrologique en cas d'insuffisance rénale non dialysée : que faire ?
D'une manière générale, il faut privilégier l'échographie et, lorsqu'une injection de produit de contraste est nécessaire, il est parfois suffisant de faire une injection intraveineuse de produit de contraste ultrasonore (les microbulles ne sont pas néphrotoxiques).
S'il est néanmoins nécessaire de faire une TDM ou une IRM, il faut privilégier l'IRM. En effet, parfois l'IRM résout les problèmes sans injection de produit de contraste grâce à sa grande richesse en contraste T1 et T2.
Si l'injection est finalement nécessaire, les chélates de gadolinium ne sont pas néphrotoxiques alors que les produits de contraste iodés le sont. Il est donc préférable d'utiliser l'IRM et les chélates de gadolinium plutôt que la TDM et les produits de contraste iodés.
Toutefois, en cas d'insuffisance rénale sévère (DFG < 30 mL/min), les chélates de gadolinium circulent dans le sang pendant des heures avant d'être lentement éliminés. Cette longue circulation peut entraîner une dissociation de l'ion gadolinium de son chélateur. Or, le gadolinium libre est très toxique et provoque une complication retardée grave : la fibrose néphrogénique systémique. En cas d'insuffisance rénale, il faut donc utiliser les chélates de gadolinium les plus stables (macrocycliques).
En résumé, en cas d'insuffisance rénale sévère non dialysée, on utilise de préférence dans l'ordre et en fonction des indications :
- l'échographie et l'échographie de contraste ;
- l'IRM sans injection ;
- l'IRM avec injection de chélates de gadolinium macrocycliques ;
- la TDM sans injection.
Essentiel à retenir
- Les principales techniques d'imagerie morphologique utilisées pour l'étude des reins et des voies urinaires sont l'échographie, la TDM (TDM rénale et uro-TDM) et l'IRM (IRM rénale et uro-IRM).
- Les techniques d'imagerie en coupes (TDM et IRM) nécessitent l'utilisation d'agent de contraste et des temps d'acquisition précis après l'injection pour étudier le cortex rénal, la médullaire et des voies urinaires (paroi et contenu).
- L'échographie est un examen non invasif, le plus souvent réalisé en première intention en cas d'affection urinaire.
- La TDM est l'examen de référence en pathologie des voies urinaires (uro-TDM), la détection et la caractérisation des syndromes de masse rénaux (TDM rénale). Ses limites sont l'irradiation et l'utilisation d'un produit de contraste iodé.
- L'IRM peu invasive est très performante. Elle peut être utilisée en cas de contre-indication à la TDM, ou en complément de celle-ci en cas de doute diagnostique (par exemple caractérisation d'une masse rénale). Elle permet également l'exploration rénale (IRM rénale) des voies urinaires excrétrices (uro-IRM), des testicules et de la prostate.
- La scintigraphie rénale donne des informations sur la fonction rénale et l'état du parenchyme rénal. La mesure des fonctions relatives permet d'apprécier le retentissement d'une affection touchant un seul rein.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 27 - Imagerie de l'abdomen
O. Lucidarme et D. Kharroubi
Plan du chapitre
- Connaître les techniques d'imagerie de l'abdomen et pouvoir les expliquer au patient
- Séméiologie de base en imagerie abdominale
- Principales indications en imagerie abdominale
- Description et indications des examens de médecine nucléaire
Objectifs
- Connaître les techniques d'imagerie de l'abdomen et pouvoir les expliquer au patient.
- Connaître la séméiologie de base de l'imagerie de l'abdomen utilisant les rayons X.
- Connaître l'intérêt et les principales indications des produits de contraste en TDM.
- Connaître la séméiologie de base en imagerie abdominale échographique.
- Connaître la séméiologie de base en IRM abdominale.
- Connaître l'intérêt et l'indication des produits de contraste en IRM.
- Connaître l'intérêt et l'indication des MRP en médecine nucléaire.
- Comprendre la place des différentes techniques d'imagerie de l'abdomen dans les principaux syndromes.
- Connaître les techniques d'imagerie de l'abdomen et pouvoir les expliquer au patient
Techniques radiologiques anciennes
Schématiquement, les techniques historiques d'exploration de l'abdomen étaient fondées sur l'imagerie en projection (radiographies) jusqu'à l'avènement des techniques d'imagerie en coupes.
Ainsi, l'abdomen sans préparation (ASP), qui correspond à une radiographie simple de l'abdomen (figure 27.1) était très largement employé et parfois associé aux opacifications digestives. L'opacification améliore l'analyse du contenu des organes creux en étudiant le liseré muqueux (bords du produit de contraste limités par la muqueuse), le volume et la forme des organes, la régularité de leurs parois. Le produit de contraste utilisé est radio-opaque (sulfate de baryum, iode), parfois mélangé à de l'air (« double contraste » pour le côlon) :
- le transit œso-gastro-duodénal (TOGD) par l'ingestion du produit de contraste (figure 27.2) ;
- le transit du grêle qui consiste à faire absorber des quantités plus grandes de produit de contraste et à observer sa progression dans l'ensemble de l'intestin grêle par des radiographies régulières. Cet examen pouvait durer jusqu'à 2 heures/2 heures 30 avant que le produit ingéré n'atteigne la dernière anse iléale (figure 27.3) ;
- le lavement réalisé par l'introduction d'une canule dans le rectum et le remplissage par cette canule de la totalité du cadre colique par un produit de contraste radio-opaque liquide (figure 27.4).
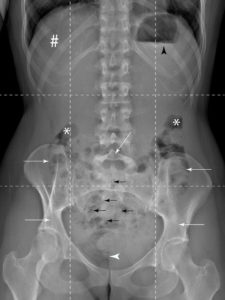
Exemple de radiographie d'abdomen sans préparation.
La région abdominale est divisée en neuf quadrants limités par deux lignes verticales médioclaviculaires et deux lignes horizontales passant par le bord inférieur des cartilages costaux et par les épines iliaques antérosupérieures. Les quadrants supérieurs sont les hypochondres droit et gauche, séparés par l'épigastre. L'hypochondre droit et l'épigastre sont occupés par le foie (#), de densité homogène. L'hypochondre gauche est occupé par l'estomac et par la rate. Le niveau hydroaérique (tête de flèche noire) est lié au remplissage gastrique avec de l'air qui s'accumule dans le fundus. Sa présence témoigne d'un cliché réalisé en position debout. Les quadrants moyens sont les flancs droit et gauche, séparés par la région ombilicale. Les flancs contiennent le côlon (flèches blanches) (ascendant et descendant, ainsi que les angles coliques droit et gauche) (astérisques). La région ombilicale contient le côlon transverse (flèche blanche) et l'intestin grêle (flèches noires), principalement le jéjunum. Les quadrants inférieurs sont les fosses iliaques droite et gauche, séparées par l'hypogastre. La fosse iliaque droite contient le cæcum et l'appendice vermiculaire ; la fosse iliaque gauche contient le côlon sigmoïde ; l'hypogastre contient l'iléon, la vessie et le rectum. Les quatre densités sont visibles : densité aérique de l'air contenu dans le tube digestif (noir sur l'image), densité osseuse du rachis, du bassin et des côtes (blanc sur l'image), densité graisseuse de la graisse sous-cutanée (gris sombre sur l'image) et densité hydrique du foie et des reins (gris clair sur l'image).
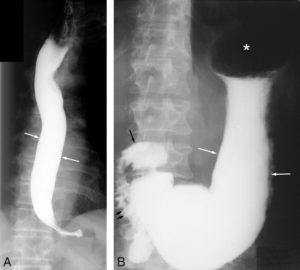
Exemple de TOGD.
La lumière de l'œsophage (A) et de l'estomac (B) est opacifiée par un produit de contraste liquide à base de sulfate de baryum ingéré par le patient. Le produit de contraste vient mouler les parois de l'œsophage et de l'estomac, qui correspondent à l'interface avec la muqueuse appelée le liseré muqueux (flèches blanches). Le TOGD permet également d'objectiver l'anatomie (forme, taille et position) de l'œsophage, de l'estomac, du bulbe (flèche noire), et du cadre duodénal (double flèche noire). Plusieurs clichés peuvent être réalisés en faisant tourner le patient pour dégager toutes les portions et toutes les faces de l'œsophage, de l'estomac et du cadre duodénal. Astérisque : fundus gastrique.
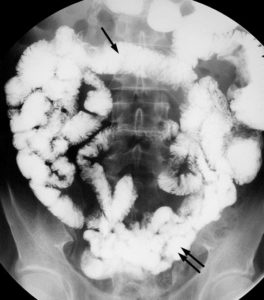
Exemple de transit du grêle.
La lumière des anses jéjunales (flèche noire) et iléales (double flèche noire) est opacifiée par l'ingestion d'une grande quantité de sulfate de baryum. Des clichés comme celui-ci étaient réalisés à intervalles réguliers pour suivre la progression du produit de contraste au travers des anses grêles jusqu'à la dernière anse. Des clichés sous compression dosée et sur différentes incidences pouvaient être réalisés pour étudier le contenu, le calibre et le liseré muqueux de chacune des anses intestinales.
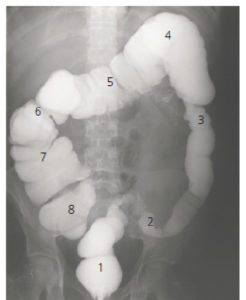
Exemple de lavement opaque.
La lumière de l'ensemble du cadre colique est opacifiée grâce à l'introduction par une canule rectale d'un produit de contraste liquide à base de sulfate de baryum. Les clichés réalisés donnent des informations sur l'anatomie du cadre colique, son calibre et la régularité du liseré muqueux de chacune de ses portions. 1. Rectum ; 2. côlon sigmoïde ; 3. côlon descendant (gauche) ; 4. angle colique gauche ; 5. côlon transverse ; 6. angle colique droit ; 7. côlon ascendant (droit) ; 8. cæcum.
Ces techniques ne permettaient cependant pas d'explorer efficacement les organes pleins. Elles sont, à l'exception du TOGD, toutes remplacées par de l'imagerie en coupes qui permet d'explorer la cavité des organes creux, leurs parois, les organes pleins et l'ensemble de l'atmosphère autour de ces organes (péritoine, graisse rétropéritonéale). Les endoscopies digestives (fibroscopie œso-gastro-duodénale et coloscopie optique) participent également à l'exploration des anomalies de la paroi et de la muqueuse de l'œsophage, de l'estomac, du duodénum et du côlon, permettant de plus la réalisation de biopsies ou d'actes interventionnels.
Ainsi, désormais :
- l'ASP a été remplacé par l'échographie et la TDM abdominales. Il n'est plus indiqué que dans quelques cas (recherche de corps étrangers, surveillance de lithiase rénale, etc.) ;
- le lavement radio-opaque a été largement remplacé par la coloscopie optique et le coloscanner. Il conserve néanmoins quelques indications en pédiatrie ;
- le transit du grêle est totalement remplacé par l'entéroscanner (voir plus loin) et l'entéro-IRM. Des techniques de vidéocapsule ingérées par le patient sont également désormais disponibles ;
- le TOGD conserve des indications ponctuelles, notamment pour la chirurgie bariatrique car l'imagerie en coupes ne remplace pas totalement les informations anatomiques globales (taille, morphologie, position) qu'il peut fournir (voir figure 27.2).
Techniques d'imagerie actuelles
TDM
Cette technique utilise, comme en radiographie, les rayons X. La séméiologie tomodensitométrique est donc fondée sur les quatre densités fondamentales aérique, hydrique, graisseuse et calcique. Elles sont mieux identifiées que sur un ASP car l'image réalise une coupe anatomique et non une image en projection (figure 27.5).
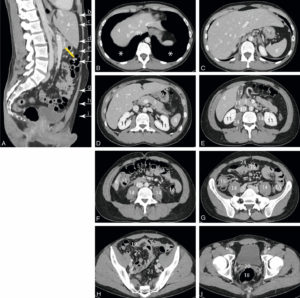
Reconstruction sagittale médiane (A) et coupes horizontales (B-I) de la région abdominopelvienne en TDM après injection intraveineuse de produit de contraste.
La région abdominale est divisée en deux par le plan du mésocôlon transverse (trait jaune), tendu entre le pancréas et le côlon transverse. L'étage sus-mésocolique comprend toutes les glandes annexes du tube digestif et la rate ; l'étage sous-mésocolique contient principalement l'intestin grêle et le côlon. Les lobes inférieurs des poumons sont visibles et sont de densité aérique (astérisque). La cavité péritonéale est normalement virtuelle ; les différents replis du péritoine, correspondant aux lames porte-vaisseaux des organes (mésentère, mésocôlon, omentum), sont de densité graisseuse. Le rachis est de densité osseuse. 1. Aorte ; 2. veine porte ; 3. pancréas ; 4. foie ; 5. côlon transverse ; 6. veines hépatiques ; 7. branche gauche de la veine porte ; 8. rate ; 9. estomac ; 10. veine cave inférieure ; 11. reins ; 12. vésicule biliaire ; 13. duodénum ; 14. muscles grands psoas ; 15. côlon ascendant ; 16. côlon descendant ; 17. côlon sigmoïde ; 18. rectum ; 19. intestin grêle ; 20. récessus rectovésical (Douglas) ; 21. mésocôlon transverse ; 22. mésentère ; 23. mésosigmoïde ; 24. grand omentum (épiploon).
L'injection intraveineuse de produit de contraste iodé sert à rehausser le parenchyme des organes pleins, les vaisseaux et la paroi des anses digestives (figure 27.6). Son rôle est d'apporter une information supplémentaire qui concerne l'importance de la vascularisation des tissus étudiés. Plus le tissu (sain ou pathologique) est vascularisé, plus il « s'imbibera » de produit de contraste et plus il apparaîtra « rehaussé », c'est-à-dire « hyperdense » par rapport à son aspect avant l'injection du contraste. La TDM injectée donne donc des informations sur l'anatomie (image en coupe), sur la composition des organes (grâce aux quatre densités radiologiques) et sur la richesse de leur vascularisation (rehaussement après injection de produit de contraste iodé intraveineux). Il est également parfois nécessaire d'utiliser des produits de contraste spécifiques introduits dans la lumière digestive par ingestion (opacification digestive haute) ou par lavement (opacification digestive basse). Contrairement aux techniques historiques, les produits de contraste digestifs utilisés en TDM ne sont pas toujours des produits radio-opaques (sulfates de baryum ou iode), mais peuvent être des liquides radiotransparents tels que de l'eau ou le CO2. L'ingestion d'eau sert à distendre la lumière intestinale et, associée à l'injection intraveineuse d'un produit de contraste iodé, permet de visualiser les anomalies du rehaussement des parois digestives (tumeurs, ischémie, inflammation).
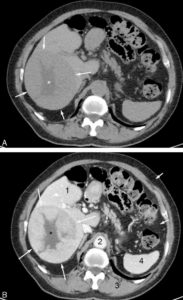
Exemple d'examen tomodensitométrique réalisé avant (A) et après (B) injection de produit de contraste iodé par voie intraveineuse.
Avant injection de produit de contraste, la lésion qui occupe la majeure partie du foie (flèches) présente une densité très proche de celle du parenchyme hépatique adjacent. Seule sa portion centrale apparaît de densité moins élevée (astérisque). Après injection de produit de contraste, les lumières vasculaires telles que l'aorte (2) se rehaussent fortement. Les organes richement vascularisés tels que le foie (1) ou la rate (4) se rehaussent également de façon plus marquée que les structures très peu vascularisées comme le muscle (3) ou les tissus graisseux (flèches courtes). La tumeur (flèches) est moins vascularisée que le foie. Elle est donc mieux visible après injection car elle se rehausse moins que le parenchyme adjacent. Sa portion centrale (astérisque) n'est le siège d'aucun rehaussement visible. Elle est probablement dévascularisée, nécrotique au centre.
Modalités pratiques de réalisation d'une TDM abdominopelvienne
Exploration standard de l'abdomen et du pelvis
L'examen dure entre 5 et 10 minutes (installation du patient comprise). Les patients n'ont pas besoin d'être à jeun sauf en cas d'entéroscanner (voir plus loin). Le patient est placé en décubitus dorsal, puis passe au travers de l'anneau de la TDM au cours de l'examen. Sur les machines modernes, les anneaux sont larges et peu épais. Il n'y a donc le plus souvent pas de problème pour les patients claustrophobes. Selon les indications, l'examen est effectué sans ou après injection intraveineuse de produit de contraste iodé. La décision d'injection est prise par le radiologue responsable de l'examen après recherche des contre-indications (voir chapitre 4). De même, la décision de demander au patient de boire du produit de contraste ou de l'eau pour réaliser un balisage digestif est prise par le radiologue en fonction des anomalies recherchées.
Entéroscanner
L'entéroscanner consiste à positionner une petite sonde flexible (sonde d'entéroclyse) par le nez jusque dans l'angle duodénojéjunal (de Treitz) sous contrôle radioscopique. Branchée sur l'extrémité proximale de cette sonde, une pompe injecte ensuite régulièrement, sans à-coups, environ 1 à 1,5 litre d'eau tiède pour bien remplir la lumière de la totalité des anses grêles jusqu'à la dernière anse iléale. Ce remplissage est indolore et ne prend que quelques minutes. Il est bien toléré si l'extrémité distale est positionnée au-delà de l'angle duodénojéjunal car, dans ce cas, il n'y a pas de reflux d'eau vers l'estomac. Le patient doit être à jeun car le bol alimentaire gêne considérablement la pose de la sonde et l'avancée de l'eau dans la lumière de l'intestin grêle. Des coupes TDM avant puis après injection intraveineuse de produit de contraste iodé permettent enfin d'étudier la totalité de l'intestin grêle en coupes fines : le diamètre des anses intestinales, le liseré muqueux, le rehaussement des parois de l'intestin et l'ensemble des autres organes de la cavité péritonéale (figure 27.7). Cet examen dure 10 à 20 minutes et a définitivement remplacé le transit du grêle. Il existe une variante sans mise en place d'une sonde d'entéroclyse, donc « moins invasive », en faisant boire un mélange eau-macromolécule. Le remplissage des anses est cependant de moins bonne qualité.
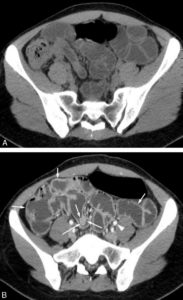
Exemple d'entéroscanner avant (A) et après (B) injection intraveineuse de produit de contraste iodé.
L'instillation par une pompe dans une sonde nasojéjunale placée au-delà de l'angle dudodénojéjunal permet de remplir rapidement d'eau les anses grêles d'eau et de les déplisser. Après injection de produit de contraste, confirmée par l'observation d'un rehaussement net de la lumière des vaisseaux comme l'artère iliaque externe gauche par exemple (tête de flèche), la paroi des anses intestinales vascularisées se rehausse (flèches courtes) et permet de mettre en évidence une tumeur (flèches) développée dans la lumière d'une anse intestinale à partir de la paroi.
Coloscanner ou coloscopie virtuelle
Le coloscanner a désormais remplacé le lavement opaque (en dehors de la pédiatrie). Il consiste à introduire une canule dans le rectum et à insuffler à l'aide d'une pompe du CO2 de façon douce et régulière afin de gonfler le côlon et de distendre ses parois. Une préparation préalable est nécessaire (régime sans résidu et prise de laxatifs pour vider le côlon la veille et jeûne le jour de l'examen) pour que le côlon soit vide de matières fécales. Une fois la distension obtenue (ce qui prend environ 1 minute), des coupes TDM jointives sont effectuées sur l'ensemble du cadre colique. Les pixels qui sont situés à l'interface entre la lumière colique et la paroi du côlon (le liseré muqueux) sont ensuite extraits automatiquement et empilés pour obtenir une reconstruction en 3D du liseré muqueux. Il est ensuite possible, à la manière d'un jeu vidéo, de naviguer de façon virtuelle à l'intérieur de la lumière du côlon ainsi reconstruite. En général, une coloration artificielle destinée à reproduire la couleur de la muqueuse est appliquée aux images, et les images obtenues sont très comparables à celles qui peuvent être vues par coloscopie optique (figure 27.8). La principale différence est que, si un polype ou une tumeur sont identifiés, la coloscopie virtuelle n'en permet ni la biopsie, ni la résection.
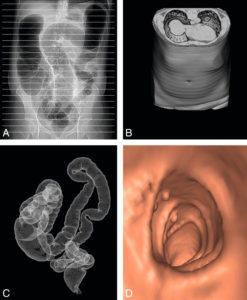
Les différentes étapes de réalisation d'un coloscanner.
Dans un premier temps, le côlon est gonflé par une pompe au CO2 via une canule introduite dans le rectum, puis des coupes tomodensitométriques axiales fines jointives sont réalisées (A). Ces coupes sont empilées les unes sur les autres pour reconstruire l'abdomen et son contenu en 3D (B). De ce volume sont extraits les pixels situés à l'interface entre l'air de la lumière colique et la paroi et qui correspondent aux pixels situés sur le liseré muqueux (C). Il est possible de faire naviguer une caméra virtuelle au sein de la lumière de cette reconstruction de la muqueuse du côlon en appliquant une couleur artificielle à la paroi. L'image obtenue est très similaire à celle d'une endoscopie (D).
IRM
Les séquences utilisées en IRM abdominale sont le plus souvent des séquences pondérées T2 ou T1 avant et/ou après injection de chélates de gadolinium (voir chapitre 8). Les séquences fortement pondérées en T2 sont utiles en IRM abdominale : les liquides non circulants sont en hypersignal (blanc), tout le reste restant en hyposignal (noir). Elles permettent d'étudier les canaux biliaires et pancréatiques et sont appelées séquences de cholangio-IRM (ou bili-IRM). Seuls l'arbre biliaire, la vésicule biliaire et le liquide contenu dans le conduit pancréatique (canal de Wirsung) restent visibles en hypersignal (figure 27.9), permettant de détecter des anomalies de type distension, sténose, présence de calcul dans la lumière des voies biliaires ou des canaux du pancréas.
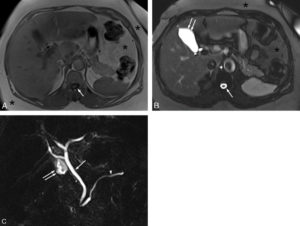
Exemple d'IRM centrée sur la partie haute de l'abdomen en pondération T1 (A), pondération T2 (B) et séquences de cholangio-IRM (C).
En pondération T1 (A), les différents organes explorés (foie, pancréas, rate, etc.) présentent des niveaux de gris intermédiaires. On reconnaît la séquence en pondération T1 car le LCS est noir (flèche). La graisse apparaît en hypersignal relatif (astérisques). Sur la coupe en pondération T2 (B), le LCS (flèche) et le liquide contenu dans la vésicule biliaire (double flèche) sont blancs. Les différents organes qui composent la partie haute de l'abdomen ont des niveaux de gris intermédiaires, légèrement différents de ceux de la coupe en pondération T1. La graisse reste en hypersignal relatif (astérisques). La séquence de cholangio-IRM est une séquence hyperpondérée T2 (C) dans laquelle seuls les liquides stagnants sont blancs. Tout le reste est noir. Cette coupe coronale oblique passe par la voie biliaire principale (flèche), quelques voies biliaires intrahépatiques, le conduit pancréatique (de Wirsung, tête de flèche). On voit également une portion de la vésicule biliaire (double flèche). Cette séquence est très utile pour analyser les processus pathologiques qui peuvent toucher les voies biliaires (sténose, dilatation, calcul, tumeur, etc.).
Pour reconnaître une image en pondération T2, il faut chercher une structure liquidienne (vésicule biliaire, vessie, LCS) et identifier si elle est en hypersignal par rapport à un muscle adjacent (blanche). Le plus simple est de regarder le LCS dans le canal vertébral car il est visible sur toute la hauteur de l'abdomen. Sur les images en pondération T1, les liquides sont en hyposignal (noir) (voir figure 27.9).
Modalités pratiques de réalisation d'une IRM abdominale
L'examen dure entre 15 et 45 minutes. Les patients n'ont pas besoin d'être à jeun, sauf en cas d'entéro-IRM ou de cholangio-IRM. Le patient est placé en décubitus dorsal. Pour les examens abdominaux, le patient sera positionné de façon à ce que son abdomen se situe au centre du tunnel, ce qui peut poser problème chez les patients claustrophobes.
Selon l'indication, l'examen peut requérir une injection intraveineuse de chélates de gadolinium dont l'effet sera le même qu'en TDM avec les produits de contraste iodés, c'est-à-dire obtenir des informations sur la richesse de la circulation sanguine dans chaque tissu. La décision d'injection et le choix des différentes séquences réalisées incombent au radiologue responsable de l'examen en fonction de la pathologie recherchée (ce qui rend une demande d'examen complète indispensable). Les examens d'IRM sont en général centrés sur une région anatomique. L'enregistrement du signal en IRM est réalisé par des antennes dites « de surface » et positionnées au plus près des organes étudiés. Cela signifie que toute la cavité abdominale ou pelvienne n'est pas systématiquement explorée, contrairement à une TDM abdominopelvienne. Une IRM hépatique n'explore pas le pelvis. Une IRM pelvienne ou rénale n'explore pas le foie. Il est possible d'effectuer en IRM un examen global de la cavité abdominopelvienne, mais cela nécessite d'anticiper en plaçant les antennes de surface sur l'ensemble des segments à étudier et cela rallonge le temps d'acquisition.
Échographie
L'échographie permet d'explorer l'abdomen – principalement les organes pleins – en temps réel, sans radiations ionisantes et à un coût moindre qu'en IRM (voir chapitres 7 et 14). L'emploi du Doppler (figure 27.10) et/ou de produits de contraste spécifiques (figure 27.11) (microbulles, voir chapitre 7) est également très utile pour enrichir la séméiologie de l'échographie.
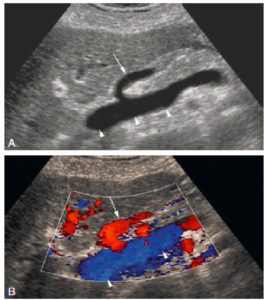
Exemple d'image échographique en mode B (A) et en mode Doppler couleur (B) centrée sur le pédicule hépatique.
En mode B, les vaisseaux circulants apparaissent anéchogènes (ici la veine porte ; têtes de flèche). On note un vaisseau qui vient se jeter dans la veine porte et qui correspond à la veine gastrique gauche (flèche). Le Doppler couleur permet de savoir dans quelle direction circule le flux sanguin. Par définition, les flux codés en bleu s'éloignent de la sonde, et les flux codés en rouge se dirigent vers la sonde. Le flux dans la veine porte s'éloigne donc de la sonde en se dirigeant vers le foie. Le flux dans la veine gastrique gauche se dirige vers la sonde, donc s'échappe de la veine porte pour aller se diriger vers l'estomac, ce qui est pathologique.
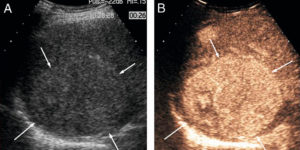
Exemple d'échographie de contraste.
Lésion hépatique (flèches) avant injection de produit de contraste (A) et après injection (B). Avant injection, l'anomalie présente des niveaux de gris quasi identiques au foie adjacent (isoéchogène). Après injection, on observe un rehaussement (ici arbitrairement codé en orange) plus important au sein de la tumeur que du foie alentour car cette lésion est plus richement vascularisée que le foie.
L'échographie permet également de mesurer la souplesse ou la dureté des organes et en particulier du foie. Cette « palpation » échographique s'appelle l'élastométrie ultrasonore ou élastographie. Plus le foie est dur, plus il est fibreux. Il est donc possible, grâce à l'élastographie, de suivre l'évolution des hépatopathies chroniques jusqu'au stade de la cirrhose en évitant le plus possible la réalisation de biopsies hépatiques (figure 27.12).
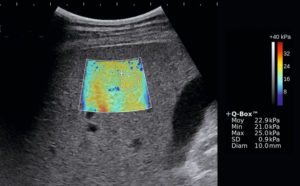
Exemple d'élastographie (ou élastométrie ultrasonore) du foie.
Sur une image du foie en mode B, on positionne une région conique tronquée dans laquelle la machine va émettre des ondes ultrasonores particulières à l'origine de la propagation d'ondes de cisaillement dans le foie. La mesure de la vitesse de propagation de ces ondes de cisaillement par l'échographe renseigne sur la valeur du module de Young, affichée avec une échelle de couleur en chaque point de la zone de mesure et qui correspond à la dureté du tissu. Ici, les valeurs sont élevées (22,9 kPa dans la région d'intérêt ronde), ce qui correspond à un foie très dur de cirrhose.
Modalités de réalisation d'une échographie abdominale
Pour une échographie abdominale, les patients doivent être à jeun depuis 6 heures. En effet, lors du repas, l'ingestion concomitante d'air remplit l'estomac et l'intestin. Or, l'air réfléchit totalement le faisceau ultrasonore. Ainsi, si l'air est abondant dans l'estomac et l'intestin, les structures et les organes pleins situés en arrière sont masqués et l'échographie n'est pas contributive. De plus, si l'échographie est destinée à étudier la vésicule biliaire (pour rechercher un calcul par exemple), un repas récent conduit à une vidange de la vésicule ; elle est alors collabée, ce qui empêche d'étudier son contenu et ses parois. Pour toutes ces raisons, être à jeun signifie ne pas manger mais également ne pas boire d'eau ou de café, ne pas fumer et ne pas mâcher de chewing-gum (c'est-à-dire toute action qui entraîne une déglutition accrue de salive et donc d'air).
La sonde échographique utilisée est une sonde basse fréquence, autour de 3,5 MHz, pour étudier des organes volumineux et/ou profonds. Le patient est habituellement placé en décubitus dorsal, mais l'examen peut être pratiqué dans n'importe quelle position, y compris assis ou debout pour permettre à l'opérateur d'accéder aux organes intra- ou rétropéritonéaux. La durée d'un examen varie de 5 à 30 minutes selon la complexité des anomalies recherchées.
Séméiologie de base en imagerie abdominale
Cette séméiologie est fondée sur l'étude des quatre densités radiologiques, l'étude de l'échostructure en échographie, du signal en IRM ainsi que sur l'emploi des produits de contraste intraveineux et les opacifications digestives.
Péritoine
Pneumopéritoine
La présence de clartés aériques dans la cavité abdominale en dehors de la lumière du tube digestif définit un pneumopéritoine. Elle peut refléter soit la perforation d'un organe creux (tube digestif), soit le passage d'air depuis l'extérieur restant piégé dans la cavité abdominale (traumatisme pénétrant, chirurgie récente). Un pneumopéritoine est identifié avec les meilleures sensibilité et spécificité en TDM, sous la forme d'images de densité aérique généralement piégées dans les zones les plus antérieures chez un sujet en décubitus dorsal (sous la paroi abdominale, en avant du foie, sous le ligament rond, proche du lit vésiculaire notamment). La TDM est incontournable pour la détection d'une perforation digestive débutante (figure 27.13).
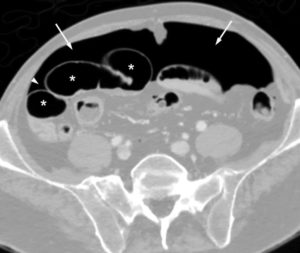
Pneumopéritoine en TDM.
La coupe transversale anatomique permet de localiser avec précision les plages de densité aérique. Certaines sont situées dans la lumière des anses digestives, de façon physiologique (astérisques) ; d'autres sont situées en dehors des anses digestives (flèches), ce qui correspond à un pneumopéritoine et donc à la perforation du tube digestif. La topographie extradigestive de l'air est affirmée par la constatation d'un angle aigu avec les parois des anses digestives (tête de flèche).
Ascite
L'ascite correspond à l'accumulation de liquide dans l'espace normalement virtuel de la cavité péritonéale. En échographie, sa présence est détectée sous forme d'un liquide anéchogène (figure 27.14A) ou faiblement échogène. Son accumulation déclive fait que le liquide intrapéritonéal est d'abord retrouvé dans le récessus rectovésical (de Douglas) ou dans les gouttières pariétocoliques. En TDM, l'épanchement se traduit par des plages de densité liquidienne visibles autour des organes, dans la cavité péritonéale qui ne se rehaussent pas après injection intraveineuse de produit de contraste iodé. En l'absence d'injection, les limites entre les organes (de densité hydrique) et de l'ascite (de densité hydrique) ne sont pas toujours identifiables et une ascite peu abondante peut être méconnue (figure 27.14B).
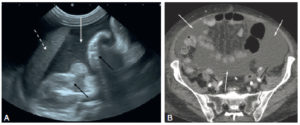
Ascite en échographie et en TDM.
En échographie (A), une coupe longitudinale passant par le bord inférieur du foie (flèche en pointillés). L'ascite est hypoéchogène (flèche blanche) et les anses digestives (flèches noires) sont visibles dans le liquide. En TDM (B), en coupe axiale après injection de produit de contraste iodé par intraveineuse (comme le montre le rehaussement des lumières vasculaires des artères iliaques) (flèches noires), on observe autour des anses digestives dont les parois sont rehaussées ou qui contiennent de l'air, une plage de densité hydrique (flèches blanches) qui correspond à un épanchement intrapéritonéal.
Infiltration de la graisse péritonéale
L'infiltration de la graisse péritonéale se traduit par une augmentation de densité des tissus graisseux infiltrés par du liquide, réalisant un aspect voilé de la graisse, dont les contours sont flous, avec une densité intermédiaire entre du tissu graisseux pur et du tissu hydrique pur.
Cet aspect signe une inflammation de la graisse qui a souvent pour origine une inflammation d'un organe situé à proximité (voir chapitre 18). Identifier une infiltration et sa topographie suffit souvent à obtenir une orientation diagnostique. Par exemple, une infiltration de la graisse dans l'hypochondre droit doit faire rechercher une affection vésiculaire (figure 27.15) ; en fosse iliaque droite, une pathologie appendiculaire ; en fosse iliaque gauche, une affection diverticulaire ; autour du pancréas, une pancréatite, etc.
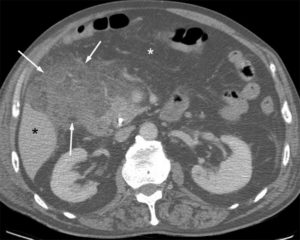
Aspect caractéristique d'une infiltration inflammatoire de la graisse des mésos (flèches) réalisant une augmentation de densité du tissu graisseux sous la forme d'un voile de densité intermédiaire entre la graisse pure (astérisque blanc) et la densité hydrique (astérisque noir).
La topographie de cette infiltration inflammatoire renseigne sur l'organe touché. Il s'agit ici d'une infiltration située à la face inférieure du foie dans l'hypochondre droit consécutive à une cholécystite aiguë non visible sur cette coupe.
On peut alors rechercher les signes directs de l'inflammation (recrutement inflammatoire avec hyperhémie et œdème) de l'organe intra-abdominal responsable de l'infiltration de la graisse péritonéale qui sont :
- la vésicule biliaire : un épaississement des parois de la vésicule biliaire supérieur à 3 mm lors d'une cholécystite aiguë ;
- l'appendice : un épaississement des parois de l'appendice supérieur à 3 mm lors d'une appendicite aiguë ;
- le tube digestif : un épaississement des parois du côlon lors d'une colite (voir plus loin « Anomalies de la paroi digestive »).
Tube digestif
Dysphagie
En imagerie, la sensation de blocage des aliments est explorée par une opacification digestive haute ou TOGD qui consiste en l'ingestion d'un produit de contraste. L'analyse sémiologique des images élémentaires est présentée en figure 27.16.
Images d'addition (A, B) et de soustraction (C-F) en TOGD.
Les images d'addition sont définies par un débord du produit de contraste au-delà du liseré muqueux supposé (flèches). Ce débord peut être limité à l'épaisseur de la paroi et correspond plutôt à une ulcération (A). Il peut également être plus régulier et faire une hernie au-delà de la paroi qui correspond à un diverticule (B). Les images de soustraction sont définies par une absence d'opacification au contact du liseré muqueux supposé (flèches). Lorsque le refoulement a des bords irréguliers (C), cela témoigne plutôt du développement sur la paroi d'une tumeur maligne. Le refoulement régulier du produit de contraste par rapport à la ligne théorique du liseré muqueux avec des angles obtus évoque un processus bénin (D). Les sténoses sont des rétrécissements de la lumière du tube digestif. Ces rétrécissements peuvent être centrés, longs et réguliers (E) (flèches). Dans ce cas, cela évoque une atteinte bénigne. Les sténoses peuvent être plus courtes, irrégulières et excentrées (F) (flèches) ; l'aspect est évocateur d'une tumeur maligne.
Le TOGD permet par ailleurs une analyse dynamique du passage du bol de produit de contraste et de différencier les dysphagies organiques des dysphagies fonctionnelles (par atteinte motrice de l'œsophage). Une fibroscopie œsophagienne (avec biopsies) et une TDM sont indispensables lorsqu'il existe une tumeur de l'œsophage.
Enfin, si une compression extrinsèque est suspectée, une TDM thoracique avec injection est réalisée.
Syndrome occlusif
L'air est normalement situé dans la lumière du tube digestif (de l'œsophage jusqu'au rectum). Il est réparti de manière harmonieuse au sein du tube digestif.
Une distension des anses digestives est un signe de mauvaise progression du bol alimentaire et peut, lorsqu'elle est segmentaire, témoigner d'un syndrome occlusif, c'est-à-dire de l'arrêt complet du transit intestinal. La répartition de l'air digestif et le diamètre des anses digestives sont donc des éléments séméiologiques fondamentaux en imagerie de l'abdomen.
Les niveaux hydroaériques (NHA) témoignent d'une stagnation concomitante d'air et de liquide au sein d'une anse digestive. La présence d'un NHA dans l'estomac est physiologique : après un repas, l'estomac est rempli de liquide et l'air surnage dans le fundus en position debout. La présence de NHA en dehors de l'estomac doit faire rechercher des signes d'arrêt du transit car, dans le tube digestif, une stase liquidienne et aérique survient si le péristaltisme des anses digestives disparaît (iléus réflexe, iléus postopératoire, ischémie, etc.), ou le plus souvent en amont d'un obstacle et donc une occlusion du grêle ou du côlon (figure 27.17). Ainsi, une distension significative des anses grêles (au-delà de 30 mm) combinée avec des NHA évoque une occlusion digestive. En imagerie de coupe (échographie, TDM, IRM), les NHA sont facilement identifiés. La position en décubitus dorsal, dans laquelle sont classiquement réalisées ces imageries de coupe, fait rechercher de l'air en position antérieure, car le liquide s'accumule dans les zones déclives.
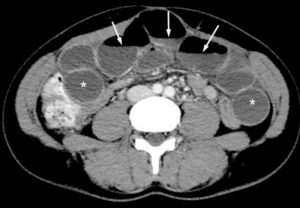
Niveaux hydroaériques en TDM sur une coupe axiale après injection de produit de contraste.
Les niveaux hydroaériques sont reconnaissables sous la forme d'une ligne parfaitement horizontale (flèches) limitant en haut des clartés aériques, et en bas des densités hydriques. On observe par ailleurs que les anses grêles sont dilatées et pleines de liquide (astérisques) ; l'ensemble signe une stagnation du liquide et de l'air dans l'intestin, et donc une occlusion.
La cause d'un NHA dans la vessie est soit une fistule entre la vessie et le tube digestif, soit un sondage vésical qui a introduit de l'air.
Anomalies de la paroi digestive
La paroi digestive est analysable en échographie. Il existe une alternance de couches hyper- et hypoéchogènes correspondant aux couches muqueuse, sous-muqueuse et musculeuse. Cet aspect est modifié en cas d'anomalie. Cependant, l'échographie de la paroi du tube digestif n'est informative que chez le patient mince et chez l'enfant.
La paroi digestive est plus couramment étudiée en TDM. La paroi est une structure fine, en règle générale de moins de 3 mm, de densité tissulaire qui se rehausse après injection de produit de contraste. L'épaisseur et le rehaussement des anses au temps portal (ou parenchymateux) sont modifiés en cas de processus ischémique, inflammatoire, infectieux ou tumoral (figure 27.18).
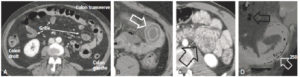
Aspects normaux et anormaux de la paroi des anses digestives en TDM.
A. Épaisseur et rehaussement normaux de la paroi des anses grêles et du côlon en coupe axiale. Noter qu'en fonction de leur degré de remplissage, les anses n'ont pas le même diamètre, ni le même aspect sur cet examen standard, réalisé sans remplissage de la lumière digestive. B. Aspect en cible de la paroi d'une anse grêle dans la fosse iliaque gauche : la muqueuse se rehausse fortement par rapport au muscle de la paroi abdominale et par rapport à la sous-muqueuse qui est œdématiée et à la séreuse (flèche blanche). Cet aspect est en rapport avec des anomalies inflammatoires, infectieuses ou ischémiques. C. Hypervascularisation d'anses grêles (flèche noire) dans le cadre de troubles de la perfusion vasculaire : la paroi se rehausse globalement de façon plus marquée que la paroi musculaire abdominale, réalisant un aspect « blanc » de la paroi. D. Pneumatose pariétale d'une anse grêle : l'aspect de la paroi est globalement noir en raison de la présence de bulles d'air dans l'épaisseur de la paroi (densité autour de –1000 = air) (flèche blanche). Noter la présence de bulles d'air dans le mésentère (aéromésentérie) (flèche noire).
Foie et voies biliaires
Calculs vésiculaires
Les calculs sont des formations cristallines ou non développées dans des cavités ou des canaux (vésicule biliaire, voies biliaires, voies urinaires, vessie). Ils peuvent être ronds ou plus irréguliers.
En radiographie et en TDM, les calculs, lorsqu'ils sont calciques, entraînent une forte atténuation des rayons X – générant ainsi une opacité en radiographie ou une image hyperdense en TDM. Il est important de savoir que les calculs biliaires ne sont cependant pas toujours calcifiés. Ils sont alors invisibles en TDM. Le meilleur examen pour détecter des calculs biliaires est l'échographie. En échographie, les calculs sont hyperéchogènes, avec une atténuation postérieure également appelée cône d'ombre postérieur (figure 27.19).
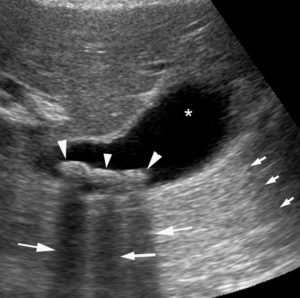
Aspect d'un calcul vésiculaire en échographie.
Le contenu de la vésicule biliaire est principalement anéchogène (astérisque), responsable d'un renforcement postérieur (flèches courtes), ce qui témoigne du contenu liquidien de sa lumière. On observe aussi trois formations hyperéchogènes (têtes de flèche) responsables de trois cônes d'ombre postérieur (flèches longues). Il s'agit de trois calculs vésiculaires.
Anomalies des voies biliaires
Lorsque les voies biliaires sont dilatées, elles apparaissent en échographie sous la forme d'une structure tubulée de contenu anéchogène. L'obstacle en aval de la dilatation est parfois identifiable en échographie (calcul, tumeur des voies biliaires).
Lorsqu'une lésion tumorale est suspectée, on s'oriente vers la TDM abdominopelvienne avec injection.
Enfin, la cholangio-IRM permet d'analyser le calibre des voies biliaires ; la présence de sténoses multifocales, d'épaississements pariétaux et de dilatations de l'arbre biliaire est évocatrice d'une inflammation plus que d'une tumeur (cholangite sclérosante).
Surcharge hépatique
Il existe deux grandes anomalies de surcharge : une surcharge en graisse appelée aussi stéatose et une surcharge en fer.
Stéatose
La stéatose correspond à une surcharge du foie en graisse. La graisse étant hyperéchogène (plus blanche que le tissu sur l'image échographique), une surcharge en graisse du parenchyme hépatique se traduit par un aspect plus blanc (figure 27.20A). En TDM, la graisse étant hypodense, une stéatose hépatique se traduit par une diminution de la densité du foie par rapport à la rate (figure 27.20B). L'IRM hépatique est le meilleur examen pour étudier l'importance d'une stéatose car il existe des séquences particulières (spectroscopie, Dixon) qui permettent de quantifier de la graisse contenue dans le foie (figure 25.20C, D) et d'éviter ainsi une biopsie hépatique.
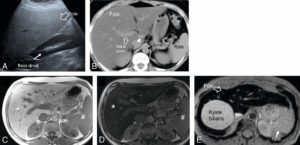
Aspects en imagerie des surcharges hépatiques.
A. Stéatose hépatique en échographie sur une coupe longitudinale passant par le foie et le rein droit : le parenchyme hépatique (flèche creuse) est plus hyperéchogène car plus riche en graisse que le parenchyme rénal (flèche pleine). B. Stéatose hépatique en coupe axiale en TDM après injection de produit de contraste au temps portal : le parenchyme hépatique est plus hypodense que la rate car il contient de la graisse qui diminue sa densité. C, D. IRM avec séquence Dixon. On observe une nette chute de signal du parenchyme hépatique (astérisque) sur l'image obtenue en opposition de phase (D) par rapport à la même image obtenue en phase (C). Cette chute de signal signe la présence d'une stéatose qui peut être quantifiée (ici 18 %). Noter que l'intensité du signal de la rate (#) n'est pas modifiée entre les deux images en phase et en opposition de phase car elle ne contient pas de graisse. E. Surcharge hépatique en fer en IRM en coupe axiale en pondération T2. Le foie présente un hyposignal (un aspect noir) très marqué en rapport avec une importante surcharge en fer. Noter par comparaison l'aspect en hypersignal du kyste biliaire et en isosignal de la rate qui ne contiennent pas de fer.
Surcharge en fer
Une surcharge en fer du foie n'est pas détectable échographiquement. L'IRM est la méthode aujourd'hui de référence pour estimer la surcharge en fer hépatique. Le fer perturbe le champ magnétique local en IRM et induit une chute du signal sur les séquences T2 dans le parenchyme (figure 27.20E). Plus cette chute est importante, plus la surcharge en fer est importante, ce qui permet sa quantification sans qu'une biopsie hépatique soit nécessaire.
Syndrome tumoral
Lésions kystiques
En échographie, les formations de contenu liquidien pur sont anéchogènes avec un renforcement postérieur des ultrasons (figure 27.21). L'échographie est une des rares techniques qui permette d'affirmer avec certitude qu'une formation présente un contenu liquidien. L'aspect anéchogène avec renforcement postérieur est rencontré pour toute formation liquidienne, qu'il s'agisse d'une structure anatomique (vésicule biliaire, vessie) ou d'une formation pathologique (kyste ou tumeur liquidienne).
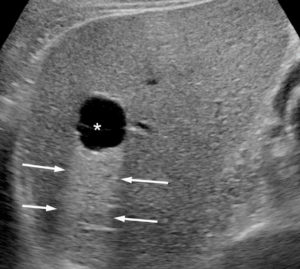
Exemple de kyste hépatique en échographie.
Au centre du foie, on identifie une formation anéchogène (astérisque). En arrière de cette formation, il existe un net renforcement du faisceau ultrasonore (flèches). Il s'agit donc d'une image liquidienne pure ; c'est un kyste bénin du foie.
Seule l'IRM avec des séquences en pondération T2 est capable de fournir des informations similaires sur le caractère purement liquidien d'une lésion (figure 27.22).
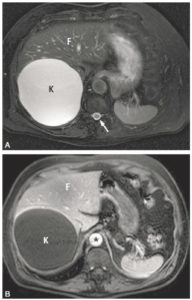
Exemple d'IRM en pondération T2 (A) et T1 (B) du foie (F).
La séquence en pondération T2 est reconnue car le LCS est en hypersignal (flèche). À la face postérieure du foie, on observe une volumineuse formation en franc hypersignal T2 et en franc hyposignal T1 (K). La séquence en pondération T1 a été effectuée après injection de produit de contraste, comme en témoigne le rehaussement de la lumière de l'aorte (astérisque). Cela a permis de confirmer que cette formation n'était le siège d'aucune prise de contraste. Cette formation est donc une formation liquidienne pure qui correspond à un kyste bénin.
Lésions solides
En échographie, les formations solides renvoient à un large spectre d'anomalies (tumeurs bénignes, tumeurs malignes, infections). Elles sont identifiées par des différences d'échogénicité et d'échostructure avec les organes adjacents dans lesquels elles se développent. Elles sont le plus souvent hypoéchogènes sans modification du faisceau d'ultrasons en arrière (figures 27.23 et 27.24).
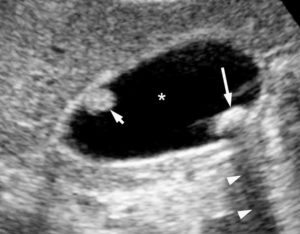
Coupe échographique de la vésicule biliaire : le contenu vésiculaire est principalement anéchogène (astérisque), avec un calcul (flèche longue) qui présente un cône d'ombre postérieur (têtes de flèche).
Accroché à sa paroi antérieure (la plus haute sur l'image), il existe une formation moins hyperéchogène que la précédente, isoéchogène par rapport à la paroi de la vésicule biliaire (flèche courte). Elle n'est pas déclive et ne génère aucun cône d'ombre en arrière. Il ne s'agit donc pas d'un calcul mais d'une formation tissulaire qui correspond ici à un polype bénin.
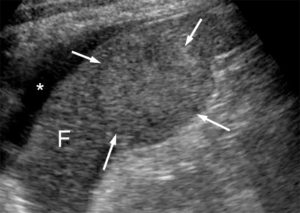
Coupe échographique du foie (F).
Autour du foie, le long de sa face antérieure, on note une lame de liquide anéchogène (astérisque). Au sein du parenchyme hépatique, on retrouve une lésion tumorale isoéchogène au foie adjacent (flèches) et qui n'est visible que parce qu'elle déforme les contours de la face inférieure du foie. Il s'agit d'une métastase hépatique de mélanome.
Devant une lésion solide (ou tissulaire), l'injection d'un produit de contraste est essentielle car l'intensité du rehaussement de la lésion reflète l'importance de sa vascularisation et c'est souvent cette information qui permet de distinguer les lésions entre elles. Cette injection de produit de contraste peut être réalisée en échographie (utilisation de microbulles) (voir chapitre 7), mais ce sont surtout l'imagerie par TDM et celle par IRM qui sont utilisées. On décrit ainsi des lésions hypervascularisées ou hypovascularisées par rapport aux organes adjacents (voir figure 27.5). Les formations liquidiennes strictes, kystiques, ou des épanchements, seront de densité liquidienne avant injection et ne présentent aucun rehaussement après injection.
La séméiologie en IRM est fondée sur l'analyse du contraste obtenu par une combinaison de séquences en pondération T1 et T2 et des séquences après injection de produit de contraste (figure 27.25). L'IRM est plus sensible que la TDM pour détecter le rehaussement des structures faiblement vascularisées, ce qui rend l'IRM plus performante que la TDM pour caractériser la vascularisation des tumeurs.
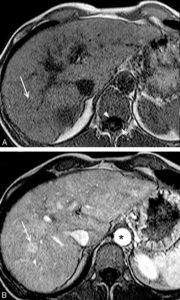
Exemple d'IRM en pondération T1 du foie avant (A) et après (B) injection intraveineuse de chélates de gadolinium.
La séquence T1 est reconnue car le LCS est noir (têtes de flèche). L'injection de gadolinium est reconnue car la lumière de l'aorte devient blanche (astérisque). Au sein du parenchyme hépatique, on identifie après injection un nodule (B, flèche) qui est plus rehaussé que le foie adjacent. Ce nodule était invisible avant injection. Il existe donc une petite tumeur hépatique plus vascularisée que le foie adjacent.
Enfin, certaines séquences spécifiques sont réalisées pour obtenir une information fonctionnelle : les séquences de diffusion, qui sont dérivées des séquences T2 permettent d'apprécier le degré de cellularité dans une région du corps en étudiant les mouvements protoniques à l'échelle du voxel.
Principales indications en imagerie abdominale
Principales indications de l'échographie
L'échographie est une technique d'imagerie très efficace pour l'étude :
- des organes pleins de l'abdomen (foie, rate, pancréas, reins) et, comme on l'a vu plus haut, pour rechercher des calculs biliaires ;
- de la progression de la fibrose présente dans le foie dans le cadre des hépatopathies chroniques grâce à l'élastographie ultrasonore, ce qui limite le recours aux biopsies hépatiques ;
- du tube digestif car son caractère « temps réel » permet de montrer le péristaltisme digestif et d'étudier l'épaisseur de la paroi ;
- des structures anatomiques contenant physiologiquement du liquide (vésicule biliaire, voies biliaires, vessie) et pour les lésions kystiques ;
- du sens et de la vitesse de la circulation sanguine artérielle et veineuse grâce aux Dopplers pulsé et couleur.
La limite de l'échographie tient à la présence de structures osseuses ou de structures contenant de l'air qui renvoient la totalité du faisceau ultrasonore vers la sonde et génèrent un cône d'ombre acoustique. Son utilisation est limitée chez les patients en surpoids.
Principales indications de la TDM
La TDM sans et/ou avec injection intraveineuse de produit de contraste iodé permet une imagerie en coupe de la totalité de l'abdomen. La TDM est particulièrement utile pour :
- l'étude des organes pleins et des organes creux (entéroscanner, coloscanner), et pour la recherche d'air extradigestif – d'où l'intérêt de la TDM dans l'imagerie des urgences digestives ;
- l'étude de la vascularisation des organes et donc la détection de lésions dont la vascularisation diffère de celle des organes sains (détection de lésions tumorales avec angiogenèse, caractérisation de leur vascularisation, détection de zones d'ischémie ou d'inflammation) ;
- l'étude des vaisseaux de l'abdomen à la recherche d'anomalies de diamètre (anévrisme) ou des réductions de calibre des vaisseaux (sténoses) ;
- la recherche de lésions traumatiques, ou de plaies pénétrantes.
Principales indications de l'IRM
Le contraste tissulaire est mieux étudié en IRM qu'en TDM (T1, T2, caractérisation de la graisse et des liquides, etc.), ce qui fait de l'IRM un examen plus performant que la TDM et l'échographie pour la caractérisation des lésions kystiques et solides se développant dans l'abdomen, en particulier dans le foie et le rectum.
Par ailleurs, l'IRM n'étant pas irradiante, elle est préférée à la TDM pour le suivi au long cours des entéropathies inflammatoires chroniques qui nécessitent des examens répétés.
Enfin, les séquences cholangiographiques sont complémentaires de l'échographie et de la TDM pour l'étude des voies biliaires et du pancréas.
Description et indications des examens de médecine nucléaire
La médecine nucléaire utilise des particules ou molécules marquées par un isotope radioactif, appelées médicaments radiopharmaceutiques (MRP), administrées aux patients pour révéler des processus physiopathologiques.
En ce qui concerne l'abdomen, l'imagerie nucléaire peut être classée en trois types d'explorations :
- les études dynamiques des transits digestif et hépatobiliaire ;
- les suivis cellulaires ;
- les études métaboliques ou moléculaires ciblées.
Études dynamiques des transits digestifs
Ce sont des examens anciens et peu connus car actuellement souvent remplacés par les explorations endoluminales (endoscopies). Néanmoins, ces examens peuvent toujours être réalisés, dans des services de médecine nucléaire spécialisés, dans des cas particuliers lorsque les explorations conventionnelles n'ont pas répondu à la question posée. Parmi ces examens, il existe :
- la scintigraphie explorant les reflux gastro-œsophagiens permettant, en condition physiologique, de quantifier la fréquence et les volumes des reflux ainsi que de rechercher des inhalations ;
- les études des motricités digestives permettant d'explorer le péristaltisme œsophagien, colique et la vidange gastrique ;
- la scintigraphie du transit hépatobiliaire qui permet d'évaluer la fonction hépatique, globale et segmentaire, par l'administration de la mébrofénine marquée au 99mTc, dont l'élimination purement hépatique suit le même transit que la bilirubine sans réabsorption (figure 27.26). Cette scintigraphie peut être demandée pour prédire la fonction hépatique d'un foie restant après chirurgie ou radiothérapie.
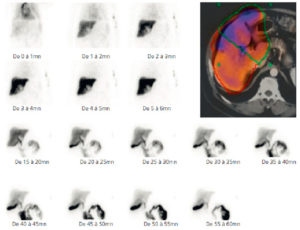
Images dynamiques d'une scintigraphie hépatobiliaire normale.
Captation hépatique du MRP et cinétique d'excrétion satisfaisantes (sans retard), suivie d'un passage digestif dans un délai normal du radiopharmaceutique. Image tomoscintigraphique en coupe axiale fusionnée à une TDM (image en couleur) permettant une segmentation du foie droit et gauche pour des mesures respectives de clairances.
Suivis cellulaires
Scintigraphie splénique
Cet examen consiste à prélever des hématies du patient, à les vieillir artificiellement en les chauffant à 49 °C, les marquer in vitro au 99mTc, puis à les réinjecter au patient. Il a pour but d'explorer la séquestration, par le parenchyme splénique fonctionnel, des hématies fragilisées (figure 27.27). Il peut être demandé pour caractériser une formation tissulaire apparue chez un patient splénectomisé en cas de suspicion de splénose (repousse d'une rate).
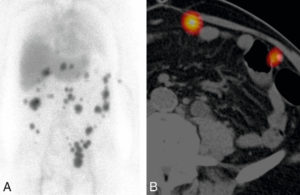
Image d'une scintigraphie splénique chez un patient présentant de multiples formations tissulaires abdominales apparues dans les suites d'une splénectomie.
Image d'une scintigraphie splénique en projection abdominale (A) : multiples lésions tissulaires intra-abdominales responsables d'une séquestration des hématies fragilisées radiomarquées, confirmant leur nature splénique (splénose abdominale). Image scintigraphique en coupe axiale fusionnée à une TDM (B).
Recherche scintigraphique d'une hémorragie chronique
Cet examen est demandé exceptionnellement pour localiser le site d'un saignement occulte digestif. Il consiste à marquer les hématies du patient in vivo ou in vitro au 99mTc pour localiser une radioactivité extravasculaire, digestive, témoignant d'un saignement actif.
Scintigraphie aux leucocytes marqués
Cet examen consiste à prélever les leucocytes du patient, les marquer in vitro avec de l'111In, puis à les lui réinjecter pour rechercher une accumulation digestive des leucocytes montrant une inflammation active en cas de maladie inflammatoire chronique de l'intestin (Crohn ou rectocolite hémorragique), ou une accumulation vasculaire révélant une inflammation et/ou un processus infectieux d'un anévrisme, d'une valve ou d'une prothèse.
Étude scintigraphique de la cinétique des plaquettes
Cet examen consiste à prélever les plaquettes du patient, les marquer in vitro avec de l'111In, puis à les lui réinjecter pour confirmer le site splénique de destruction des plaquettes chez les patients atteints d'un purpura thrombopénique idiopathique, avant d'envisager une splénectomie.
Études métaboliques et moléculaires ciblées
Ces études représentent la très grande majorité des imageries nucléaires digestives réalisées en pratique clinique. Elles ont pour objectif de caractériser l'activité et l'évolutivité d'une maladie tumorale ou inflammatoire, d'aider au diagnostic histologique de lésions tumorales, de participer au bilan d'extension des maladies inflammatoires et/ou tumorales, d'évaluer précocement l'efficacité des traitements. Comme pour le reste du corps, on utilise largement la TEP.
TEP au 18F-FDG
La TEP au 18F-FDG étudie le métabolisme glucidique (figure 27.28). Celui-ci est majoré dans les maladies tumorales et souvent corrélé à l'évolutivité de la maladie. Le métabolisme glucidique permet également d'observer les phénomènes inflammatoires. Cette TEP est donc utile pour caractériser l'évolutivité d'une lésion et pour rechercher par l'étude du métabolisme d'autres tumeurs ou inflammations.
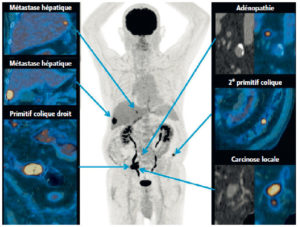
Évaluation métabolique en TEP au 18F-FDG d'un cancer du côlon droit.
L'étude métabolique permet d'évaluer l'extension de la maladie.
TEP aux analogues de la somatostatine radiomarqués
C'est une imagerie moléculaire ciblée qui permet de rechercher une surexpression des récepteurs à la somatostatine (figure 27.29). Ces récepteurs cellulaires à la somatostatine sont souvent surexprimés par certains tissus, en particulier les tumeurs neuroendocrines. Ces examens permettent donc d'aider au diagnostic et au bilan d'extension des tumeurs neuroendocrines.
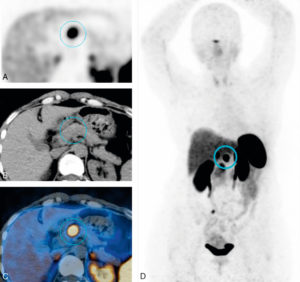
Évaluation moléculaire en TEP aux analogues de la somatostatine radiomarqués au 68Ga d'une lésion pancréatique.
L'intense fixation des analogues de la somatostatine témoigne d'une surexpression des récepteurs à la somatostatine par la lésion, caractéristique d'une tumeur neuroendocrine.
TEP à la 18F-DOPA (précurseur dopaminergique)
Cette imagerie métabolique recherche un métabolisme anormal des catécholamines. Cet examen permet donc d'aider au diagnostic histologique et de participer au bilan d'extension de tumeurs qui produisent des catécholamines (dérivées du neuroectoderme ou, pour certaines, de l'endoderme).
TEP à la 18F-Choline (précurseur des phospholipides membranaires)
La TEP à la 18F-Choline (18F-FCH) étudie le métabolisme lipidique membranaire témoignant indirectement du métabolisme cellulaire (renouvellement membranaire) et de la prolifération cellulaire (synthèse de nouvelles membranes). Ce MRP a la particularité d'être fortement métabolisé par les carcinomes hépatocellulaires bien différenciés. Ainsi, la TEP à la18F-FCH peut être indiquée pour la caractérisation d'une lésion hépatique, notamment la caractérisation pronostique des patients atteints d'un carcinome hépatocellulaire avant transplantation hépatique.
Essentiel à retenir
- L'imagerie de l'abdomen est en pleine mutation et les techniques d'imagerie historiques reposant sur les rayons X en projection (radiographies) et sur les opacifications digestives (lavement, transit du grêle) ont désormais laissé la place aux techniques d'imagerie en coupes (TDM, IRM et échographie).
- L'imagerie en coupes sert à l'exploration des organes pleins, de l'intestin grêle et de la paroi du côlon, en cas d'échec ou en complément de l'endoscopie.
- L'injection intraveineuse de produit de contraste permet d'enrichir considérablement la séméiologie et les possibilités diagnostiques de la TDM, de l'IRM mais également de l'échographie en étudiant la vascularisation des organes et des processus pathologiques.
- Pour un résultat équivalent, il est toujours préférable de remplacer l'imagerie par rayons X par une technique d'imagerie n'exposant pas aux rayonnements ionisants telle que l'échographie ou l'IRM. L'échographie est utilisée en première intention pour explorer l'abdomen, suivie de la TDM.
- L'IRM est plus onéreuse et moins disponible. Elle doit être réservée à la résolution des problèmes qui persistent après réalisation d'une échographie et/ou d'une TDM. L'IRM est rarement un examen de première intention pour explorer l'abdomen sauf pour les cancers du rectum.
- L'imagerie nucléaire recherche et étudie des phénomènes métaboliques ou cibles moléculaires (selon les MRP utilisés) pathologiques. Couplée à une TDM, elle permet de localiser et de souvent décrire morphologiquement l'anomalie repérée.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 26 - Imagerie cardiovasculaire
A. Cochet et D. Mandry
Plan du chapitre
- Introduction
- Techniques d'imagerie
- Grands syndromes et leurs moyens d'exploration
Objectifs
- Connaissance
- Connaître les spécificités des principales techniques d'exploration de l'appareil cardiovasculaire : radiographie conventionnelle, angiographie, échographie, TDM, IRM, techniques scintigraphiques.
- Connaître leurs intérêts, limites et principales indications en pathologie cardiaque et vasculaire.
- Reconnaître les principales structures anatomiques du cœur et des vaisseaux sur des images d'IRM et de TDM.
- Savoir reconnaître un œdème aigu pulmonaire sur une radiographie de thorax et sur une TDM.
- Savoir reconnaître une ischémie et une nécrose sur une scintigraphie myocardique.
- Reconnaître et savoir décrire une séquelle d'infarctus sur une IRM cardiaque.
- Reconnaître et savoir décrire les éléments sémiologiques des principales pathologies vasculaires : anévrisme (échographie, TDM, IRM) ; dissection aortique (TDM, échographie) ; sténose artérielle (TDM, IRM, échographie, angiographie).
- Communication
- Savoir expliquer les principes de réalisation des examens à un patient.
Introduction
Ce chapitre présente les différentes techniques d'imagerie utilisées pour les explorations cardiovasculaires en insistant sur les particularités de l'exploration cardiaque, et sur leur utilité dans l'exploration des grands syndromes (pathologies vasculaires, ischémie et infarctus myocardique, insuffisance cardiaque).
Les prérequis sont les bases physiques des principales techniques d'imagerie, l'anatomie et la physiologie du cœur et de l'aorte, la physiopathologie et la séméiologie élémentaire des grands syndromes cardiovasculaires.
Techniques d'imagerie
Particularités des explorations cardiovasculaires en imagerie
Les techniques d'imagerie cardiovasculaire doivent tenir compte des particularités anatomiques et physiologiques du cœur.
Orientation des plans de coupe
L'imagerie en coupes (TDM, IRM, scintigraphie) du cœur nécessite généralement une orientation selon le grand axe du ventricule gauche (VG). Celui-ci est défini comme une ligne qui passe par le centre de l'orifice mitral et par l'apex du VG. Il permet de définir trois plans de coupe : le plan dit « grand axe vertical » (ou plan « deux cavités »), le plan dit « grand axe horizontal » (ou « quatre cavités »), et le plan « petit axe », perpendiculaire aux précédents (figure 26.1). Cette orientation standardisée est commune à toutes les techniques d'imagerie en coupe du cœur, et permet en particulier une analyse précise de chacune des cinq parois du VG (parois antérieure, septale, inférieure, latérale et apicale).
Orientation des trois principaux plans de coupe utilisés en imagerie cardiaque, définis selon le grand axe du ventricule gauche (VG).
VD : ventricule droit.
Source : Mitchell C, Rahko PS, Blauwet LA, et al. Guidelines for performing a comprehensive transthoracic echocardiographic examination in adults: recommendations from the American Society of Echocardiography. J Am Soc Echocardiogr 2019 ; 32 : 1–64..
À partir de ces trois plans standardisés, d'autres orientations sont possibles, par exemple dans le plan de la chambre de chasse du VG, ou l'infundibulum pulmonaire.
Synchronisation à l'électrocardiographie (ECG)
Le cœur présente des mouvements cycliques (cycle cardiaque). Il est parfois nécessaire, selon le type d'imagerie et l'information que l'on veut obtenir, de tenir compte de ces mouvements lors de l'acquisition des images. Cela nécessite un enregistrement de l'ECG du patient en même temps que l'acquisition des images.
La synchronisation de la séquence d'acquisition se fait généralement avec l'onde R de l'ECG ; celle-ci constitue un bon indicateur de synchronisation car elle est brève et de bonne amplitude, ce qui facilite sa détection par des algorithmes de traitement du signal. Comme les phénomènes électriques du cœur précèdent les phénomènes mécaniques, l'onde R, qui signe le début de la systole électrique, précède la systole mécanique et correspond donc à la télédiastole (TD) mécanique.
Cette synchronisation à l'ECG peut être utilisée de deux manières : 1) en réalisant une acquisition à un moment donné du cycle cardiaque, généralement lorsque le VG est le moins mobile, en milieu de diastole (mésodiastole), afin d'obtenir une image « figée » du cœur. Il s'agit d'une synchronisation prospective, c'est-à-dire que les acquisitions des données sont déclenchées par la détection de l'onde R. Cette approche est choisie pour une exploration morphologique ou anatomique du cœur et des artères coronaires ; 2) en réalisant une acquisition tout au long du cycle cardiaque pour obtenir une série d'images consécutives dans le cycle cardiaque et afin de pouvoir produire des boucles d'images en mode « ciné ». Chaque intervalle R-R, correspondant à un cycle cardiaque, est divisé en segments de durée égale (généralement entre 8 et 32). Selon le type de technique d'imagerie, il peut être nécessaire d'associer les données de plusieurs cycles cardiaques (de quelques cycles en IRM jusqu'à plusieurs centaines en ventriculographie isotopique) afin d'obtenir suffisamment de signal pour représenter un seul cycle cardiaque (figure 26.2), à partir d'un cycle cardiaque moyenné à partir de plusieurs cycles acquis. Il s'agit d'une acquisition rétrospective, c'est-à-dire que les acquisitions des données sont simultanées avec celles de l'ECG et les images reconstruites ensuite en prenant en compte cette information. Cette approche est choisie pour une exploration fonctionnelle du cœur.
Concept d'acquisition synchronisée à l'ECG, exemple de la ventriculographie isotopique.
Une série de N images de durées égales est acquise au cours de chaque cycle cardiaque. Les premières images de chaque cycle sont associées entre elles pour obtenir une première image combinée, même chose pour les secondes images, etc. jusqu'à obtention d'une série d'images combinées représentant l'évolution du signal au cours d'un cycle.
L'analyse des images ainsi obtenues tout au long du cycle cardiaque permet d'évaluer la fonction ventriculaire gauche ou droite, en mesurant les volumes ventriculaires : volume télédiastolique (VTD) en fin de diastole, volume télésystolique (VTS) en fin de systole. La différence entre ces deux volumes, appelée volume d'éjection systolique (VES = VTD – VTS), correspond au volume sanguin éjecté par chaque ventricule à chaque contraction. Enfin, la fraction d'éjection ventriculaire (FEV) (%) est le rapport entre le volume d'éjection systolique et le volume télédiastolique (FEV = VES/VTD). La diminution de celle-ci (moins de 50 % pour le VG, moins de 45 % pour le ventricule droit [VD]) est un bon indice pour mesurer la dégradation de la fonction systolique ventriculaire dans les cardiopathies9.9..
D'autres paramètres fonctionnels sont également évaluables par l'imagerie, notamment la fonction diastolique, mais leur usage clinique est encore limité. C'est également sur ces images « ciné » que s'analyse la fonction contractile régionale, c'est-à-dire la contraction de chaque segment du cœur, en particulier du VG.
Elle s'apprécie essentiellement visuellement par l'épaississement de chaque segment :
- un segment se contractant normalement est normokinétique ;
- un segment dont la fonction est diminuée est hypokinétique ;
- un segment ne se contractant pas est akinétique ;
- un segment présentant une expansion en systole au lieu d'une contraction est dyskinétique.
De nouvelles modalités d'analyse automatisée de ces mouvements se développent afin de quantifier ce mouvement et cette déformation, ou analyse du strain.
Angiographie
Étymologiquement, l'angiographie est l'exploration des vaisseaux par imagerie. Sans précision, elle désigne les techniques radiographiques avec opacification directe des vaisseaux. Par extension, on parle également d'angiographie par TDM ou d'angiographie par IRM pour les explorations à visée vasculaire par ces techniques (ou plus simplement d'angio-TDM ou d'angio-IRM), voire en précisant les vaisseaux cibles (coroscanner, coro-IRM par exemple).
L'angiographie « classique » par rayons X concerne désormais quasi exclusivement les artères (artériographie), dont les artères du cœur (coronarographie) (figure 26.3A), et plus rarement les veines (phlébographie) ou les lymphatiques (lymphographie). Cet examen nécessite une ponction vasculaire, pour l'introduction d'un guide et d'un cathéter qui seront ensuite amenés sous contrôle radioscopique jusqu'au vaisseau à analyser (voir chapitres 15 et 21), ou le plus près possible de celui-ci ; il est alors procédé à l'acquisition des images concomitamment à une injection de produit de contraste iodé. Progressivement, l'angiographie par projection bidimensionnelle, qui requiert la réalisation de plusieurs incidences, est remplacée par des techniques d'acquisition tridimensionnelle. Cela reste néanmoins une analyse uniquement de la lumière du vaisseau, c'est-à-dire de l'intérieur, sans visualisation de sa paroi ; pour pallier cette limite, des techniques d'échographie endovasculaire et de mesures locales de pression se développent.
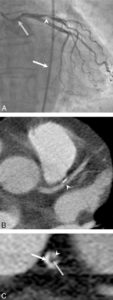
Exploration des coronaires par coronarographie et par coroscanner.
A. Coronarographie montrant un rétrécissement du calibre de l'artère interventriculaire antérieure proximale (tête de flèche). Cathéter dans l'aorte (flèche blanche) et extrémité (flèche grise) à l'ostium du tronc coronaire gauche pour une injection sélective du vaisseau. B. Coroscanner en coupe fine (< 1 mm) montrant la même sténose (tête de flèche) par une plaque d'athérome mixte (composante hypodense, thrombus, et composante hyperdense calcifiée). C. Coroscanner avec reconstruction perpendiculaire à l'axe du vaisseau montrant la lumière circulante, excentrique (tête de flèche), et la plaque d'athérome mixte (thrombus, flèche grise) et calcifiée (flèche blanche).
L'artériographie, en raison de son caractère invasif, est de moins en moins réalisée dans un but purement diagnostique, mais après un (des) examen(s) diagnostique(s) non invasif(s). Elle est utilisée dans un but thérapeutique : angioplastie, qui consiste à dilater un vaisseau, voire à y placer une endoprothèse (stent) pour le maintenir ouvert, ou embolisation pour stopper une hémorragie, par exemple. Cet aspect thérapeutique explique pourquoi l'artériographie reste l'examen de première intention dans certaines situations d'urgence, comme dans un tableau clinique et biologique de syndrome coronarien aigu (SCA).
Échographie et Doppler
L'échographie cardiaque transthoracique (figure 26.4) est l'examen d'imagerie de première intention dans les cardiopathies en raison de son innocuité, de sa disponibilité, et aussi grâce à son excellente résolution temporelle, particulièrement adaptée à l'exploration de cet organe ; en effet, l'échographie est une technique « temps réel », qui ne requiert donc pas le moyennage de données acquises sur plusieurs cycles cardiaques. Il est également possible de la réaliser lors d'un effort ou d'une épreuve de stress pharmacologique, pour analyser les modifications induites (recherche d'ischémie notamment, de modifications de gradients de pression dans certaines cardiomyopathies hypertrophiques).
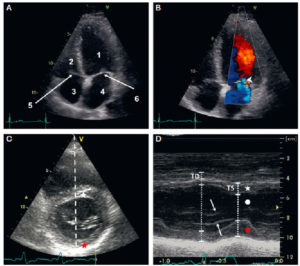
Échographie cardiaque par voie transthoracique.
A. Coupe apicale quatre cavités (grand axe horizontal) en niveaux de gris. 1. VG ; 2. VD ; 3. atrium droit ; 4. atrium gauche ; 5. valve tricuspide ; 6. valve mitrale. B. Même coupe, avec mode Doppler couleur, pour étudier les flux de remplissage ventriculaire et évaluer la sévérité d'une valvulopathie ; noter d'ailleurs ici une insuffisance mitrale physiologique (tête de flèche). C. Repérage, sur la coupe petit axe, de la ligne analysée en mode TM. D. Les segments permettent de mesurer la paroi septale (étoile blanche), la cavité ventriculaire gauche (rond blanc), et la paroi latérale (étoile rouge) en télédiastole (TD) et télésystole (TS), et ainsi de calculer une fraction de raccourcissement – diamètre de la cavité en TD-diamètre en TS)/diamètre en TD ; feuillets valvulaires mitraux (flèches).
La fenêtre acoustique (région de l'espace qui n'est pas masquée par les obstacles aux ultrasons), réduite par la présence des poumons, du sternum et des côtes, est la principale limite de cette technique ; cette limite est majorée chez les patients corpulents, ayant une déformation du thorax ou atteints de bronchopneumopathie chronique obstructive (BPCO).
Dans certains cas, l'échographie transthoracique est complétée par une échographie cardiaque transœsophagienne ; cette voie permet une meilleure appréciation des structures anatomiques proches de l'œsophage : atrium gauche, septum interatrial, valve mitrale, aorte descendante.
De nombreux paramètres fonctionnels peuvent être mesurés en échographie cardiaque, en utilisant différents modes : bidimensionnel, TM (temps-mouvement), Doppler.
En mode bidimensionnel, on analyse la morphologie du cœur, et on apprécie le fonctionnement des valves ainsi que la cinétique segmentaire et globale des ventricules ; la mesure des dimensions des cavités permet de calculer les volumes de celles-ci et la fraction d'éjection. Une autre façon d'apprécier la fonction systolique du VG est de calculer la fraction de raccourcissement entre télédiastole et télésystole de son diamètre interne (mode unidimensionnel TM). Le
Doppler est utilisé pour caractériser la sévérité des valvulopathies, fuyantes ou sténosantes.
De plus, de nouvelles approches d'acquisition et d'analyse se développent, permettant une description plus objective. On citera notamment l'échographie tridimensionnelle et des méthodes d'étude de la cinétique segmentaire (strain pariétal).
L'échographie est également un examen très utile en pathologie vasculaire (figure 26.5), notamment pour les vaisseaux superficiels (troncs supra-aortiques, vaisseaux des membres). En revanche, l'analyse des vaisseaux profonds et l'exploration « corps entier » sont limitées ; l'échographie est donc un examen de première intention, ou bien elle est réalisée pour préciser l'atteinte d'une zone localisée. Ses avantages cités précédemment en font par exemple un examen adapté au dépistage des anévrismes de l'aorte abdominale.
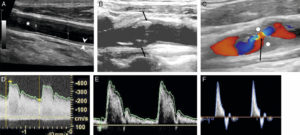
A. Échographie en niveaux de gris d'une artère carotide commune normale montrant la lumière normalement anéchogène (étoile blanche), la paroi (entre les deux têtes de flèche) avec la ligne hyperéchogène côté lumière correspondant à l'intima et la bande hypoéchogène à la média ; ici a été mesurée l'épaisseur intima-média, marqueur d'athérosclérose (valeur normale < 1 mm). B. Présence d'une plaque athéromateuse du bulbe carotidien avec une composante calcifiée (flèche blanche ; cône d'ombre acoustique postérieur) et une composante hypoéchogène (flèche grise). C. Sténose serrée d'une artère carotide interne par une plaque hypoéchogène (rond blanc) avec étude en Doppler couleur montrant un phénomène d'aliasing (flèche noire). D. Spectre Doppler correspondant avec mesure de la vitesse maximale à 4,1 m/s (sténose significative si > 2 m/s). E. Spectre Doppler normal d'une artère à faible résistivité, type carotide commune (vitesse maximale systolique autour de 1 m/s ici). F. Spectre Doppler normal d'une artère à haute résistivité, musculaire.
En mode bidimensionnel, le vaisseau se présente comme une structure à contenu anéchogène, avec une paroi fine hyperéchogène. Avec des sondes à très haute fréquence permettant une très bonne résolution spatiale, il est même possible de distinguer les différentes couches de la paroi artérielle de vaisseaux superficiels comme les carotides et de mesurer l'épaisseur intima-média, qui traduit une atteinte athéromateuse lorsqu'elle est augmentée. Les plaques d'athérome apparaissent, quant à elles, comme des épaississements focaux de la paroi ; selon leur composition, elles seront hypoéchogènes (plaques « molles » et thrombus), ou hyperéchogènes avec cône d'ombre acoustique postérieur en cas de calcifications (voir figure 26.5B, C). Les modes Doppler couleur et pulsé permettent de mesurer les vitesses circulatoires localement.
Les modes utilisés sont le bidimensionnel – pour une analyse morphologique d'un vaisseau, d'une sténose artérielle ou d'un anévrisme par exemple, de varices veineuses – et le Doppler, en mode couleur et/ou en mode pulsé – pour une analyse fonctionnelle avec par exemple la mesure de la vitesse de circulation au sein d'un vaisseau.
TDM
Les explorations de l'appareil cardiovasculaire par TDM nécessitent quasi systématiquement une injection intraveineuse de produit de contraste iodé. Pour une opacification satisfaisante, le débit d'injection doit être assez élevé (4 à 6 mL/s en général), et l'acquisition des images réalisée après un délai adapté au vaisseau à explorer (figures 26.6 et 26.7). Les acquisitions en contraste spontané (sans injection) sont rarement utiles en pathologie cardiovasculaire, en dehors des contextes d'urgence pour chercher du sang frais spontanément hyperdense – exemple du syndrome aortique aigu avec possiblement un hématome intramural de l'aorte, ou des accidents de la voie publique. Une exception est la mesure du « score calcique » qui permet de quantifier la charge calcique, c'est-à-dire la quantité de calcifications dans les parois des artères coronaires d'un patient, qui est un facteur pronostique du risque cardiovasculaire d'un sujet (voir figure 26.3B, C).
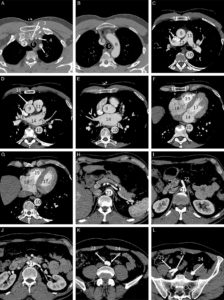
A-L. Anatomie normale en angio-TDM thoraco-abdominale (coupes axiales) au temps artériel.
1. Veine brachiocéphalique gauche ; 2. Veine brachiocéphalique droite ; 3. tronc artériel brachiocéphalique ; 4. artère carotide commune gauche ; 5. artère subclavière gauche ; 6. trachée ; 7. veine cave supérieure ; 8. crosse de l'aorte ; 9. aorte ascendante (segment 1) ; 10. aorte thoracique descendante (segment 3) ; 11. tronc de l'artère pulmonaire ; 12. branche droite de l'artère pulmonaire ; 13. branche gauche de l'artère pulmonaire ; 14. atrium gauche ; 15. auricule gauche ; 16. veines pulmonaires ; 17. ventricule gauche ; 18. atrium droit ; 19. ventricule droit ; 20. sinus coronaire ; 21. aorte abdominale ; 22. artère mésentérique supérieure ; 23. artère iliaque commune droite ; 24. artère iliaque commune gauche ; 25. artère iliaque externe droite ; 26. artère iliaque interne droite.
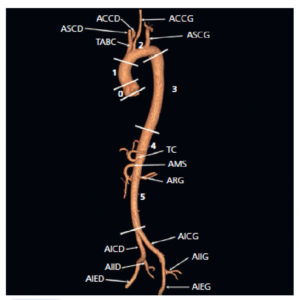
Aorte normale en angio-TDM au temps artériel avec reconstruction tridimensionnelle de type rendu volumique.
Segment 0 : racine de l'aorte, de l'anneau à la jonction sinotubulaire ; segment 1 : aorte ascendante ; segment 2 : crosse de l'aorte ou arc aortique ; segment 3 : aorte thoracique descendante ; segment 4 : aorte abdominale suprarénale ; segment 5 : aorte abdominale intrarénale. ACCD : artère carotide commune droite ; ACCG : artère carotide commune gauche ; AICD : artère iliaque commune droite ; AICG : artère iliaque commune gauche ; AIED : artère iliaque externe droite ; AIEG : artère iliaque externe gauche ; AIID : artère iliaque interne droite ; AIIG : artère iliaque interne gauche ; AMS : artère mésentérique supérieure ; ARG : artère rénale gauche (sous cette incidence, l'artère rénale droite n'est pas visible) ; ASCD : artère subclavière droite ; ASCG : artère subclavière gauche ; TABC : tronc artériel brachiocéphalique ; TC : tronc cœliaque.
Pour les explorations cardiaques, et également de l'aorte ascendante, il faut recourir à la synchronisation à l'ECG. L'acquisition est alors réalisée en systole pour l'anneau aortique, par exemple avant remplacement valvulaire (transcatheter aortic valve implantation [TAVI]), en diastole pour l'exploration des autres segments de l'aorte thoracique, l'imagerie des coronaires notamment, ou sur tout le cycle cardiaque pour l'analyse des valves par exemple. L'acquisition reste relativement longue par rapport au cycle cardiaque et donc au déplacement des artères coronaires, et la résolution spatiale est actuellement limitée pour les vaisseaux de moins de 1 mm. Aussi, cet examen peut requérir une préparation du patient pour réduire ou simplement stabiliser sa fréquence cardiaque (utilisation de bêta-bloquants) et dilater ses vaisseaux (dérivés nitrés par voie sublinguale par exemple).
L'analyse des images sur une console de post-traitement adaptée est une étape cruciale de l'examen. En particulier, pour mesurer correctement le calibre d'un vaisseau, il est impératif de procéder à une reconstruction de l'image perpendiculairement à son axe.
Parmi les techniques d'imagerie en coupes, la TDM est l'examen de référence pour l'exploration non invasive des vaisseaux de gros (voir figure 26.7) et moyen calibres (y compris les coronaires) (voir figure 26.3).
En pathologie cardiovasculaire, les principaux examens scanographiques sont :
- l'angio-TDM pulmonaire (suspicion d'embolie pulmonaire, ou de bilan malformatif) ;
- l'angio-TDM de l'aorte (recherche et suivi d'anévrisme, de coarctation, de dissection) ;
- l'angio-TDM des artères coronaires (diagnostic non invasif de la maladie coronaire).
Techniques scintigraphiques
Comme toutes les techniques de médecine nucléaire, les techniques scintigraphiques dédiées aux explorations cardiaques nécessitent l'administration d'un
MRP, dont les propriétés biologiques détermineront l'information qui sera obtenue sur les images. Comme la plupart des MRP, leur administration est contre-indiquée chez la femme enceinte.
Ventriculographie isotopique
La ventriculographie isotopique consiste en l'administration d'un MRP se distribuant uniquement mais de manière homogène dans l'espace vasculaire. On utilise généralement des globules rouges autologues marqués au 99mTc.
L'étude des variations temporelles de la radioactivité du sang contenu dans les cavités cardiaques permet d'obtenir des informations qualitatives et quantitatives sur la fonction ventriculaire gauche et droite, et surtout de manière fiable et reproductible la mesure des FEV.
Les images peuvent être acquises en mode bidimensionnel, en position oblique antérieure gauche afin d'être perpendiculaire à l'axe du septum interventriculaire et ainsi de bien séparer les deux ventricules (figure 26.8), ou en mode tomographique (tridimensionnel). La synchronisation à l'ECG permet d'obtenir une série d'images (16 voire 32) tout au long du cycle cardiaque.
Ventriculographie isotopique.
Traceurs de la perfusion myocardique
Pour évaluer la perfusion myocardique, les MRP les plus utilisés sont des cations lipophiles marqués au 99mTc, le sestamibi et la tétrofosmine. Ils traversent la membrane cellulaire passivement dans le sens du gradient de potentiel électrique transmembranaire et vont s'accumuler préférentiellement dans les cardiomyocytes proportionnellement aux débits coronaires locaux. Cette captation est rapide, dès la première minute suivant l'injection.
Tous ces traceurs sont émetteurs monophotoniques et les images sont donc obtenues en scintigraphie conventionnelle, les acquisitions étant réalisées en mode tomographique, avec orientation des coupes selon les trois plans principaux du cœur.
Il est généralement réalisé une synchronisation à l'ECG pour améliorer la qualité de l'image et obtenir des informations fonctionnelles du VG (évaluation de la FEVG et de la contractilité des différentes parois du VG).
Le 201Tl, un cation monovalent dont le comportement est proche de celui du potassium, est plus irradiant et donc moins utilisé.
D'autres MRP aux caractéristiques biologiques proches ont également été développés pour la TEP (en particulier le rubidium-82 et le 18F-Flurpiridaz) avec un avantage en termes de qualité d'image, mais ces MRP ne sont pas encore employés en routine en France.
Autres traceurs
Le métabolisme glucidique du myocarde peut être exploré grâce au 18F-FDG, traceur TEP largement disponible. Dans ce cas, les territoires myocardiques non viables ne présenteront pas de fixation du 18F-FDG, tandis qu'au contraire les territoires ischémiques présenteront une hyperfixation relative, la glycolyse anaérobie étant dans ce cas la source d'énergie privilégiée du fait du manque d'O2.
Le 18F-FDG peut également être utile pour la détection de foyers infectieux cardiaques (endocardite infectieuse) ou vasculaires (anévrisme mycotique) ou encore pour le diagnostic de certaines pathologies inflammatoires pouvant atteindre le myocarde (sarcoïdose).
La scintigraphie à la MIBG marquée à l'123I (123I-MIBG), un analogue de la noradrénaline, permet d'évaluer et de quantifier l'innervation sympathique du myocarde, qui est altérée dans de nombreuses affections cardiaques, mais la place de cet examen en routine clinique reste encore à préciser.
IRM
Pour les explorations du cœur et des gros vaisseaux en IRM, la synchronisation à l'ECG est indispensable, et il est nécessaire également de tenir compte des mouvements respiratoires (réaliser une synchronisation aux mouvements respiratoires ou bien, le plus souvent, procéder à l'acquisition des images en apnée).
Cette synchronisation est généralement combinée avec des séquences d'acquisition très rapides ; de nombreuses sont disponibles qui permettent une exploration très complète du cœur et des gros vaisseaux.
Séquences ciné
La cinétique cardiaque peut être explorée avec une assez grande précision en IRM, en répétant l'acquisition du même plan de coupe à différents moments du cycle cardiaque. Les séquences utilisées sont des séquences d'écho de gradient segmentées rapides présentant un contraste très particulier avec une pondération T2/T1 (figure 26.9). Cette pondération se révèle intéressante en imagerie cardiaque car elle montre un fort contraste entre le myocarde (hyposignal) d'une part, et les espaces liquidiens et la graisse (hypersignal) d'autre part, de sorte que les contours endocardiques et épicardiques des ventricules sont nets.
Séquences ciné-IRM dans les plans grand axe horizontal (A), grand axe vertical (B), petit axe (C) et un plan passant par la chambre de chasse du VG (D).
1. VG ; 2. VD ; 3. atrium droit ; 4. atrium gauche ; 5. aorte descendante ; 6. aorte ascendante. À noter qu'il existe un épanchement pleural droit liquidien, apparaissant en hypersignal sur ces images pondérées en T2/T1 (astérisque).
Ces séquences sont à la base des mesures fonctionnelles des VG et VD. L'excellente résolution spatiale et la bonne résolution temporelle de ces séquences, l'absence de zone muette font de l'IRM une technique de référence pour la mesure de la fraction d'éjection des deux ventricules, de la masse myocardique et des volumes télédiastolique et télésystolique. La masse et les volumes sont généralement indexés à la surface corporelle du patient.
Séquences d'imagerie morphologique « sang noir »
L'IRM permet également de caractériser les composantes tissulaires autour ou au sein du myocarde et des parois des gros vaisseaux. On utilise pour cela des séquences morphologiques dérivées de l'écho de spin, pondérées en T1 ou T2, pour lesquelles le signal du sang circulant apparaît en noir (figure 26.10).
Séquence d'IRM morphologique « sang noir » pondérée en T1, dans le plan grand axe horizontal.
Le myocarde apparaît en isosignal, la graisse en hypersignal. Le sang circulant ayant quitté le plan de coupe entre l'impulsion préparatoire de 90° et l'impulsion refocalisatrice de 180°, les cavités cardiaques apparaissent en noir (vide de signal). 1. VG ; 2. VD ; 3. atrium droit ; 4. atrium gauche ; 5. aorte descendante ; 6. poumon gauche ; 7. poumon droit ; 8. graisse péricardique.
Les acquisitions sont réalisées lorsque le myocarde a un mouvement minimal, c'est-à-dire durant la mésodiastole ventriculaire.
Séquences d'imagerie de phase (cartographie des flux)
La cartographie des flux est possible avec l'IRM tout comme avec le Doppler en échographie. En contraste de phase, le signal mesuré est proportionnel à la vitesse des protons qui traversent le plan de coupe. Quand on pondère cette mesure par la surface de la zone d'intérêt (coupe du vaisseau selon son petit axe), on peut obtenir une mesure des débits (antéro- et rétrograde). Le contraste de phase permet donc une approche quantitative des flux vasculaires ou valvulaires. Le codage tridimensionnel des flux permet de visualiser ceux-ci au sein des gros vaisseaux et d'analyser les shunts, les fuites et les turbulences (technique dite « de flux 4D ») (figure 26.11).

Imagerie de cartographie des flux dans un plan axial passant par l'aorte ascendante (en blanc) et l'aorte descendante (en noir).
Le niveau de gris de chaque point représente une vitesse et une direction (blanc et noir correspondent aux vitesses maximales, gris correspond à une vitesse nulle). 1. Aorte ascendante ; 2. aorte descendante ; 3. artère pulmonaire ; 4. poumon gauche ; 5. poumon droit.
Séquences de perfusion et de rehaussement tardif
L'imagerie de la perfusion myocardique en IRM repose essentiellement sur l'utilisation de séquences rapides fortement pondérées en T1, associées à l'injection d'un produit de contraste à base de gadolinium qui augmente le contraste T1 dans son volume de distribution.
Dans des conditions normales, le signal du myocarde augmente rapidement au moment du passage du produit de contraste dans la circulation coronaire, puis dans le milieu extravasculaire du myocarde, pour ensuite diminuer progressivement au fur et à mesure que le produit de contraste quitte le secteur extravasculaire pour retourner dans le secteur vasculaire et être progressivement éliminé par voie rénale. Cependant, une altération locale de la perfusion se traduit par un rehaussement moindre et/ou un retard dans ce territoire lors de la phase initiale (figure 26.12). Cette analyse de la perfusion myocardique est notamment utilisée avec des agents pharmacologiques vasodilatateurs pour diagnostiquer une ischémie myocardique.
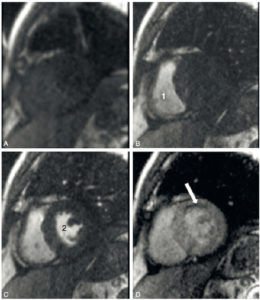
Images IRM successives d'un même plan de coupe petit axe au cours du premier passage d'un agent de contraste à base de gadolinium (séquence turbo FLASH précédée d'une impulsion saturation-récupération).
A. Avant le passage de l'agent de contraste. Les seules zones en hypersignal (blanc) correspondent à la graisse sur cette séquence fortement pondérée en T1. B. Arrivée de l'agent de contraste dans la cavité ventriculaire droite (1). C. Passage de l'agent de contraste dans la cavité ventriculaire gauche (2). D. Passage de l'agent de contraste dans le myocarde dont le signal augmente, sauf dans la région antérieure (flèche). L'hyposignal correspond à un déficit de perfusion du myocarde.
Plus tardivement, dans les minutes qui suivent l'injection, certaines régions du myocarde peuvent présenter un ralentissement de la phase d'évacuation du produit de contraste, voire une stagnation, et donc un hypersignal T1 par rapport au myocarde normal (figure 26.13). Ces mécanismes d'accumulation sont probablement liés à l'altération de la membrane capillaire, à l'augmentation du volume du liquide interstitiel, voire à la rupture des membranes cellulaires, qui augmente le volume de distribution du produit de contraste. Cela concerne donc toutes les situations pathologiques qui entraînent une destruction des cardiomyocytes (nécrose), une augmentation du volume interstitiel (maladies infiltratives de type amylose) et/ou la présence d'œdème (maladies inflammatoires de type myocardite).
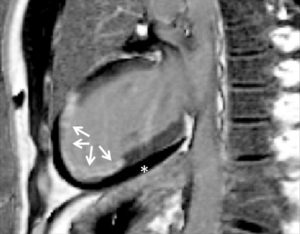
Séquence IRM de rehaussement tardif, 10 minutes après injection d'un agent de contraste à base de gadolinium.
Orientation grand axe vertical. On observe un hypersignal dans le tiers distal du VG, transmural, correspondant à une rétention du traceur du fait d'une large séquelle d'infarctus myocardique (flèches). Il existe également un épanchement péricardique liquidien, apparaissant en noir sur cette séquence fortement pondérée en T1 (astérisque).
Il est donc possible de réaliser des acquisitions dynamiques précoces, immédiatement après injection, permettant d'évaluer la perfusion myocardique (voir figure 26.12), et des acquisitions plus tardives (généralement 5 à 10 minutes après injection), appelées de « rehaussement tardif » pour dépister des anomalies structurelles du myocarde (voir figure 26.13).
Séquences de caractérisation tissulaire : T1 et T2 mapping
Toujours pour la caractérisation des anomalies structurelles myocardiques, ont été développées récemment des séquences produisant des images paramétriques fondées sur les temps de relaxation (T1, T2, T2⁎), appelées par exemple T1 mapping ou cartographie T1. De nombreux processus pathologiques peuvent entraîner des modifications des temps de relaxation : la présence d'œdème ou de fibrose entraîne une augmentation du T1 et du T2, tandis que l'infiltration lipidique ou la surcharge en fer entraînent leur diminution. Ces processus affectent également le volume extracellulaire myocardique, qui peut être calculé en comparant les valeurs de T1 avant et après injection d'un produit de contraste à base de gadolinium. Ces séquences complètent et précisent ainsi l'analyse tissulaire myocardique par IRM.
Angiographie par résonance magnétique (ARM)
Les séquences d'ARM peuvent utiliser un produit de contraste (chélate de gadolinium) ou le signal spontané du sang (séquence sang blanc). Dans le premier cas, on réalise une acquisition 3D millimétrique ou submillimétrique centrée sur le passage artériel du produit de contraste. Cette technique est excellente pour les vaisseaux peu mobiles, plus délicate pour les segments mobiles comme l'aorte ascendante qui produisent des artefacts de mouvement. La technique sang blanc sans injection est de plus en plus utilisée ; elle permet une acquisition en mode ciné et des mesures très précises en systole ou en diastole.
Compte tenu de ses capacités, l'IRM est devenue un examen de référence pour l'analyse des maladies du myocarde, des atteintes péricardiques et des cardiopathies congénitales opérées.
Grands syndromes et leurs moyens d'exploration
Pathologie des vaisseaux
Sténose artérielle
Une sténose, synonyme de rétrécissement localisé, est une diminution permanente du calibre d'un conduit anatomique, comme un vaisseau ou une valve cardiaque ; cela exclut donc les diminutions transitoires comme dans un spasme artériel. La cause principale des sténoses artérielles est l'athérosclérose.
L'imagerie (échographie et/ou TDM) permet de caractériser les sténoses en mesurant le degré de sténose (voir figure 26.3), souvent exprimé en pourcentage d'un calibre de référence (diamètre du vaisseau ou surface), et leur longueur. Une sténose d'au moins 70 % en diamètre est généralement à l'origine d'une diminution du débit d'aval, et est un seuil opératoire dans les sténoses de l'artère carotide interne par exemple, y compris chez les patients asymptomatiques.
Une autre approche est fondée sur les modifications hémodynamiques induites par la sténose, avec une accélération du flux sanguin à la zone de sténose maximale, mesurable en échographie-Doppler (voir figure 26.5).
Le degré ultime de sténose est la thrombose, ou occlusion de la lumière vasculaire, qui peut se constituer progressivement ou survenir brutalement en raison d'une rupture de plaque.
Un thrombus est un caillot sanguin qui se forme dans le cœur ou dans un vaisseau (figure 26.14) ; il peut ne pas être obstructif. Un des risques principaux de ces thrombus est leur migration dans la circulation sanguine, avec occlusion d'un vaisseau en aval ; on parle alors d'embolie – par exemple, un AVC ischémique secondaire à l'embolie d'un thrombus auriculaire gauche, classique dans la fibrillation atriale et justifiant le traitement anticoagulant au long cours. À noter que l'on parle également d'embolie avec d'autres « corps étrangers » migrés : embolie graisseuse, embolie gazeuse, embolie de cristaux de cholestérol, embolie de tout ou partie d'une tumeur, etc.
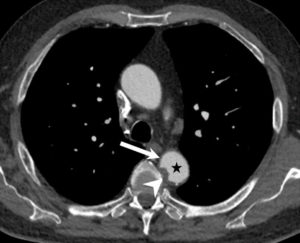
Angio-TDM aortique dans le plan axial.
Dans la lumière circulante de l'aorte thoracique descendante (étoile), il existe une hypodensité correspondant à un thrombus (tête de flèche). Noter également la paroi aortique (flèche) visible sur cet examen, modérément épaissie.
Anévrisme
Un anévrisme (figure 26.15) se définit comme une augmentation localisée et permanente du calibre d'un vaisseau d'au moins 50 %, ce qui engendre une perte de parallélisme des bords. Il est exploré en TDM. Il se distingue des méga-artères dont le calibre est augmenté de façon généralisée.
Anévrismes.
A. Reconstruction en MIP épaisse en sagittal oblique d'une angio-TDM de l'aorte abdominale, montrant un anévrisme fusiforme de celle-ci. Noter les calcifications pariétales diffuses (athérome), la lumière et le thrombus. B. Coupe axiale du même patient, à environ mi-hauteur de cet anévrisme ; lumière circulante (étoile noire) et thrombus (étoile blanche). C, D. Anévrisme sacciforme de l'aorte abdominale en angioTDM en reformation (C) et rendu volumique 3D (D). Noter le développement unilatéral à gauche de cet anévrisme (étoile noire : lumière circulante ; étoile blanche : thrombus). E. Rendu volumique 3D d'un angioTDM de l'aorte chez un patient présentant de multiples anévrismes sacciformes (flèches blanches). F. Coupe axiale au niveau de la racine de l'aorte montrant un de ces anévrismes (étoile noire) développé aux dépens du sinus antérieur droit (rond noir), et situé à côté de l'ostium de la coronaire droite (tête de flèche).
Un anévrisme se caractérise par : sa localisation (vaisseau et partie du vaisseau atteints), sa forme (sacciforme, en sac, ou fusiforme, en fuseau), son diamètre maximal et sa longueur.
La zone de communication entre la lumière vasculaire normale et l'anévrisme s'appelle le collet ; il y en a un seul en cas d'anévrisme sacciforme et deux en cas de fusiforme.
Les anévrismes peuvent être uniques ou multiples, et toucher les vaisseaux de tout calibre ainsi que les cavités cardiaques, mais concernent principalement les artères. Il est important de considérer l'état du vaisseau atteint, ainsi que celui des autres vaisseaux, pour guider la prise en charge thérapeutique.
Il existe également des faux anévrismes (ou pseudo-anévrismes) qui se distinguent des anévrismes car leur paroi est constituée par un autre tissu que celui de la paroi artérielle (par exemple par du péricarde en cas de rupture ventriculaire gauche après un infarctus du myocarde).
Dissection
Une dissection (figure 26.16) est un clivage dans la paroi artérielle (entre l'intima et la média), avec création d'un hématome, spontanément hyperdense en TDM, voire d'un faux chenal qui peut être circulant ou thrombosé. Elle peut survenir sur toutes les artères, mais le cas le plus emblématique est la dissection de l'aorte. La classification de Stanford distingue les dissections de l'aorte de type A lorsque l'aorte ascendante est atteinte, et celles de type B lorsque l'atteinte débute au-delà de l'artère subclavière gauche. La dissection aortique est une urgence diagnostique, et s'intègre dans le syndrome aortique aigu avec l'hématome intramural de l'aorte et l'ulcère athéromateux pénétrant. Une dissection de type A, avec atteinte de l'aorte ascendante donc, est aussi une urgence chirurgicale (risque de rupture et de tamponnade).
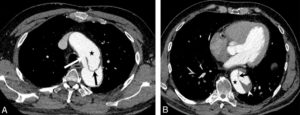
Dissection.
Coupes axiales d'angio-TDM au temps artériel passant par la crosse aortique (A) et l'aorte thoracique descendante distale (B). Brèche intimale (flèche blanche) située ici au niveau de la crosse aortique, au pied de l'artère subclavière gauche (dissection de type B selon Stanford), se présentant comme une discontinuité dans la paroi aortique ; il peut exister une ou plusieurs réentrées, qui se présentent de la même façon et situées plus en distalité sur l'aorte ou ses collatérales. Existence d'un vrai chenal (étoiles noires) et d'un faux, séparés par le flap intimal (flèches noires et blanche) ; noter le thrombus (tête de flèche blanche) qui obstrue partiellement la lumière du faux chenal de l'aorte thoracique descendante distale dans ce cas.
Dans un contexte d'urgence, pour l'étude de l'aorte et des gros vaisseaux, l'examen de première intention est la TDM en raison de sa disponibilité, de sa rapidité de réalisation, de la couverture corps entier possible et de sa résolution spatiale. Elle permet de visualiser le voile intimal, la porte d'entrée et celles de réentrée, l'état du faux chenal (perméable ou thrombosé), l'extension aux collatérales, les signes de rupture et les éventuels retentissements parenchymateux (ischémie).
En cas d'instabilité hémodynamique majeure, une échocardiographie transthoracique, voire transœsophagienne, permet souvent de confirmer ou d'infirmer le diagnostic de dissection de type A, sans toutefois permettre un bilan d'extension et de retentissement aussi exhaustif.
Pour le suivi des atteintes connues (anévrisme, dissection au stade chronique), l'IRM peut être choisie en raison de l'absence d'exposition du patient aux radiations ionisantes ; le choix peut également s'orienter vers la TDM, pour la reproductibilité des mesures et une couverture anatomique plus large actuellement (des troncs supra-aortiques aux iliaques en quelques secondes par exemple).
Thrombose veineuse profonde
La thrombose veineuse profonde des membres inférieurs (phlébite) est explorée en échographie en première intention. Les signes directs sont l'absence de flux en Doppler et la visibilité d'un caillot complètement ou partiellement occlusif dans la lumière du vaisseau. Les signes indirects sont l'absence de compressibilité de la veine sous la sonde et la présence de voies de suppléance.
Une embolie pulmonaire est une complication classique d'une thrombose veineuse profonde des membres inférieurs et est explorée préférentiellement en angio-TDM (en scintigraphie plus rarement) (voir chapitre 25).
Pathologies des coronaires : ischémie myocardique et infarctus
Rappels physiopathologiques
L'ischémie myocardique est liée à une inadéquation entre besoins et apports en oxygène au myocarde. Elle est généralement provoquée par une diminution de la perfusion myocardique, secondaire à une occlusion partielle ou totale d'une artère coronaire ou d'une de ses branches.
Si cette ischémie se prolonge, elle évoluera soit vers une ischémie chronique (on parle d'hibernation myocardique), soit vers une nécrose cellulaire, irréversible.
Le myocarde ischémique présente une dysfonction contractile, qui est généralement réversible si le débit sanguin est restauré, après un passage par une phase de sidération myocardique (dysfonction contractile transitoire malgré la restauration de la perfusion). On parle de myocarde viable. En revanche, en cas de nécrose, la dysfonction contractile est irréversible (tableau 26.1).
Tableau 26.1 - Tableau comparatif des caractéristiques des différents états du myocarde
|
Perfusion |
Fonction contractile |
Métabolisme glucidique |
Viabilité |
|
|
Myocarde normal |
Normale |
Normale |
Normal |
Oui |
|
Ischémie |
Diminuée |
Altérée |
Augmenté |
Oui |
|
Nécrose |
Diminuée ou stoppée |
Altérée |
Stoppé |
Non |
|
Hibernation (ischémie chronique) |
Diminuée |
Altérée |
Augmenté |
Oui |
|
Sidération |
Normalisée |
Altérée |
Normal ou augmenté |
Oui |
La vascularisation coronaire présente plusieurs caractéristiques qui sont importantes à rappeler pour comprendre la physiopathologie de l'ischémie myocardique :
- dans des conditions normales, le réseau coronaire est terminal, c'est-à-dire qu'en situation normale il n'y a pas de suppléance entre les territoires coronaires ;
- la distribution du flux coronaire dans l'épaisseur du muscle cardiaque n'est pas homogène : les artères coronaires et leurs branches cheminent à la surface épicardique du muscle cardiaque et donnent naissance à des artères perforantes qui pénètrent dans l'épaisseur du myocarde et qui sont, elles, terminales. Le myocarde sous-endocardique est donc moins bien perfusé que le myocarde sous-épicardique, et est plus sensible à l'ischémie. Ainsi, la nécrose cellulaire résultant de l'infarctus apparaît au niveau de l'endocarde pour s'étendre progressivement en front de vague vers l'épicarde ;
- dans des conditions normales, le débit sanguin coronaire peut s'adapter de manière quasi linéaire aux besoins en oxygène et nutriments du myocarde et, ainsi, lors d'un effort important, être multiplié par un facteur 3 à 5 par rapport au repos. Cette adaptation se fait essentiellement grâce aux capacités vasomotrices des artérioles (propriété de se dilater ou de se contracter et ainsi de moduler leur rayon). Le rapport entre le débit coronaire au repos et à l'effort est appelé « réserve de débit coronaire », ou « réserve coronaire ».
L'atteinte des artères coronaires est le plus souvent la conséquence de l'athérosclérose, avec constitution de plaques d'athérome dans les parois des artères.
Ces plaques évoluent de deux manières :
- soit elles se développent lentement et entraînent une sténose d'aggravation progressive de la lumière coronaire. Cette sténose est dans un premier temps compensée par une vasodilatation des artérioles coronaires en aval, voire la constitution d'un réseau collatéral d'importance variable. Ce type de lésion entraîne alors une ischémie qui n'apparaît initialement qu'à l'effort, du fait de la diminution de la réserve coronaire. L'expression clinique est un angor stable d'effort. Lorsque la sténose devient trop importante, l'ischémie survient même au repos ; l'expression clinique évoluera vers un angor de repos ;
- soit elles se fracturent ou se fissurent, ce qui entraîne la formation d'un thrombus intracoronaire au contact, une réduction brutale du diamètre artériel, voire une occlusion complète aboutissant à une ischémie ou une nécrose. L'expression clinique est la survenue d'un syndrome coronarien aigu (SCA) : angor instable ou infarctus du myocarde. La nécrose résultant de l'infarctus apparaît au niveau de l'endocarde pour s'étendre progressivement vers l'épicarde. La plaque d'athérome instable est donc plus à risque qu'une simple sténose progressive.
Indications de l'imagerie
Les examens complémentaires viennent en complément de l'analyse clinique, qui doit toujours se situer en amont de leur prescription.
Le choix des examens complémentaires d'imagerie varie donc en fonction de la situation et de la question posée. De manière schématique, il peut s'agir de détecter une pathologie des coronaires (et d'en apprécier l'importance), d'évaluer la présence de viabilité myocardique (généralement chez un patient coronarien connu) ou, enfin, de réaliser un diagnostic différentiel.
Test d'ischémie et imagerie des coronaires
Il existe deux approches possibles, qui peuvent être complémentaires : la réalisation d'un test d'ischémie couplé à une imagerie (échographie, IRM ou scintigraphie), ou l'imagerie des coronaires pour détecter directement une lésion coronarienne.
Test d'ischémie couplé à l'imagerie
Trois techniques d'imagerie peuvent être utilisées : l'échographie, l'IRM et la scintigraphie myocardique, permettant d'évaluer la contractilité et/ou la perfusion myocardique (tableau 26.2). Ces examens sont très fréquemment utilisés pour confirmer ou non le diagnostic de maladie coronaire, pour établir un pronostic de cette maladie et pour orienter les indications thérapeutiques.
Tableau 26.2 - Tableau comparatif des performances des différentes techniques d'imagerie couplées à un test d'ischémie
|
Paramètre myocardique explorable |
Test d'ischémie associé |
|||
|
Contractilité |
Perfusion |
Viabilité |
||
|
IRM |
++ |
++ |
+++ |
Vasodilatateur, dobutamine |
|
Scintigraphie au 201Tl |
+ |
++ |
++ |
Épreuve d'effort, vasodilatateur, dobutamine |
|
Scintigraphie au 99mTc-MIBI |
+ |
++ |
– |
Épreuve d'effort, vasodilatateur, dobutamine |
|
Échographie |
++ |
– |
– |
Épreuve d'effort, dobutamine |
Ces examens sont réalisés non seulement au repos, mais également au cours d'un test d'ischémie, dont l'objectif est de reproduire ou simuler les conditions d'un stress myocardique. Cela permet ainsi de comparer la contractilité et/ou la perfusion myocardique au repos et au cours d'un stress.
Les principales anomalies recherchées sont donc :
- l'existence de zones d'ischémie ou de nécrose myocardique et leur étendue (pourcentage de myocarde concerné) ;
- les paramètres de fonction ventriculaire gauche segmentaire et globale, notamment la FEVG et les volumes ventriculaires gauches.
L'absence d'anomalie (de contraction ou de perfusion) en post-stress comme au repos est en faveur de l'absence d'ischémie ou de nécrose.
La présence d'une anomalie uniquement après stress, réversible au repos, est en faveur d'une ischémie (figure 26.17).
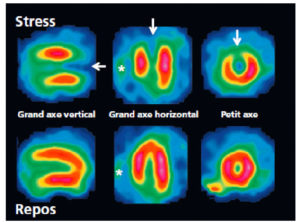
Scintigraphie myocardique au 99mTc-MIBI : ischémie.
L'injection du traceur et l'acquisition des images sont réalisées au décours d'un effort (stress) et quelques heures plus tard au repos, après réinjection. On constate une absence de perfusion dans le territoire apical et antérieur distal en post-stress (flèches), qui se rétablit au repos. Il s'agit d'un aspect d'ischémie myocardique dans ce territoire. À noter que le myocarde du VD (astérisque) n'est pas explorable en scintigraphie myocardique, sa perfusion étant beaucoup plus faible que celle du myocarde du VG et sa paroi beaucoup plus mince.
La présence d'anomalies en post-stress et non réversibles au repos est en faveur d'une nécrose ou d'une ischémie chronique (hibernation), sans pouvoir toujours faire la distinction entre les deux (figure 26.18).
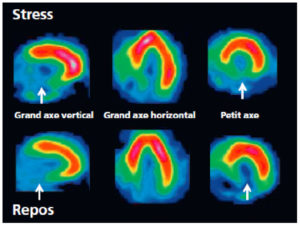
Scintigraphie myocardique au 99mTc-MIBI : nécrose.
L'injection du traceur et l'acquisition des images sont réalisées au décours d'un effort (stress) et quelques heures plus tard au repos, après réinjection. On constate une absence de perfusion dans le territoire inférieur en post-stress (flèches), non réversible au repos. Il s'agit d'un aspect évocateur de nécrose myocardique dans ce territoire. Cependant, une ischémie « chronique » non réversible au repos (hibernation) ne peut pas être exclue.
En pratique, aucune de ces techniques n'est clairement supérieure aux autres. Le choix se fait en fonction de la situation. L'échographie et la scintigraphie ont l'avantage de pouvoir être couplées à une épreuve d'effort, contrairement à l'IRM (il est effectivement difficile de faire réaliser un effort au patient lorsqu'il est confiné dans l'aimant). En revanche, l'IRM est une technique très complète permettant d'obtenir des informations fonctionnelles (contractilité, perfusion), mais également anatomiques et structurelles (voir tableau 26.2).
Il existe trois types de test d'ischémie, qui sont tous réalisés sous la responsabilité d'un cardiologue et couplés à un enregistrement de l'ECG en continu :
- l'épreuve d'effort, qui est la technique qui se rapproche le plus des conditions physiologiques ; elle permet à elle seule d'apporter des éléments diagnostiques en faveur d'une atteinte ischémique. L'effort entraîne des effets inotropes et chronotropes positifs, qui augmentent les besoins du myocarde et, en conséquence, la perfusion partout où c'est possible. En aval d'une sténose, les capacités vasodilatatrices sont déjà mobilisées et une ischémie apparaît. L'épreuve d'effort doit être dans la mesure du possible « maximale », c'est-à-dire conduire à une augmentation de la fréquence cardiaque jusqu'à obtention de la fréquence maximale théorique (FMT) qui est égale à 220 moins l'âge du patient ;
- perfusion de dobutamine à dose croissante dont les effets chronotrope et inotrope stimulent les conditions d'un effort ;
- l'injection d'un vasodilatateur coronaire (dipyridamole ou régadénoson), qui va augmenter le débit de perfusion en aval des coronaires saines, alors qu'en aval d'une sténose, les artérioles sont déjà dilatées pour compenser la diminution du débit coronaire. Le vasodilatateur ne pourra donc pas augmenter autant la perfusion que dans les autres territoires, d'où la visualisation d'une diminution relative de la perfusion myocardique en aval d'une sténose hémodynamiquement significative.
Imagerie des coronaires : TDM et coronarographie
Il s'agit dans ce cas de mettre en évidence directement une éventuelle sténose ou occlusion sur le réseau coronaire soit de manière non invasive (TDM), soit de manière invasive (coronarographie).
La TDM des coronaires (coro-TDM ou « coroscanner ») est un examen qui bénéficie d'une excellente valeur prédictive négative, c'est-à-dire qu'un examen normal permet d'éliminer avec une quasi-certitude la présence d'une lésion. Elle permet de préciser l'anatomie, notamment en cas d'anomalie de connexion (« de naissance ») ou de trajet des artères coronaires, de localiser et de quantifier de manière non invasive d'éventuelles lésions coronariennes sténosantes. Une de ses limites principales reste la résolution spatiale, en particulier en cas de calcifications coronaires ou de stent, avec une quantification alors souvent imprécise de la lumière. Mais les progrès technologiques repoussent régulièrement cette limite.
La coronarographie n'est réalisée en première intention que dans un contexte d'urgence (tableau de syndrome coronarien aigu), sinon pour confirmer les résultats d'un examen non invasif. Elle permet surtout de réaliser, si c'est possible, un traitement endoluminal (angioplastie) de la ou des lésions.
Une autre limite de cette approche morphologique est que l'on ne connaît pas l'impact fonctionnel réel d'une lésion : certaines sténoses en apparence importantes n'auront que peu d'impact du fait d'un bon réseau collatéral ; d'autres sténoses plus modérées auront au contraire un impact significatif, avec apparition d'une ischémie d'effort en aval. C'est tout l'intérêt des mesures complémentaires (pression intra-artérielle pour mesure de la réserve coronaire, directe ou simulée, et des approches fonctionnelles).
Évaluation de la viabilité myocardique
Il s'agit dans ce cas d'une maladie coronarienne connue : lésion coronaire occlusive ou pré-occlusive, et anomalies de la contractilité du myocarde en aval de cette lésion. L'objectif est de savoir si le myocarde atteint est viable ou non viable (nécrosé) et donc si une reperfusion de l'artère en cause permettrait d'obtenir un rétablissement fonctionnel.
Trois techniques d'imagerie permettent de différencier myocarde viable et myocarde nécrosé : l'IRM avec injection de chélates de gadolinium et séquences de rehaussement tardif, la scintigraphie myocardique au 201Tl, et enfin la TEP au FDG.
Parmi ces trois techniques, l'IRM est à considérer en priorité car c'est une technique sans exposition aux radiations ionisantes permettant une exploration complète du cœur (fonctionnelle et morphologique). De plus, son excellente résolution spatiale permet de faire la distinction entre séquelle de nécrose sous-endocardique et transmurale. Les techniques scintigraphiques sont à considérer en fonction de leur disponibilité.
Diagnostic différentiel
Certaines maladies non ischémiques peuvent se présenter cliniquement comme un syndrome coronarien. Le tableau 26.3 résume les principaux diagnostics différentiels et leurs techniques privilégiées d'exploration en imagerie.
Tableau 26.3 - Principaux diagnostics différentiels des syndromes coronariens aigus, et leurs moyens d'exploration en imagerie
|
Échographie |
IRM |
TDM |
Scintigraphie |
|
|
Péricardite |
++ |
++ |
+ |
– |
|
Myocardite |
– |
++ |
– |
– |
|
Dissection aortique |
++ (ETO) |
++ |
++ |
– |
|
Embolie pulmonaire |
±⁎ |
± |
++ |
++⁎⁎ |
ETO : échographie transœsophagienne.
⁎ L'échographie peut mettre en évidence des thrombus très proximaux au niveau des artères pulmonaires.
⁎⁎ Scintigraphie pulmonaire de ventilation/perfusion (voir chapitre 25).
Insuffisance cardiaque
L'insuffisance cardiaque est un syndrome clinique caractérisé par des symptômes typiques qui peut s'accompagner de signes localisateurs (augmentation de la pression jugulaire, crépitants pulmonaires et œdèmes périphériques), et qui est causé par une anomalie cardiaque structurelle ou fonctionnelle.
Rappels physiopathologiques
L'insuffisance cardiaque correspond à une réduction du débit cardiaque et/ou des pressions intracardiaques élevées au repos ou au cours d'un stress (définition 2016 de la Société européenne de cardiologie). Ses causes principales sont l'athérosclérose coronaire (insuffisance cardiaque post-infarctus ou au cours de l'ischémie) et l'HTA. D'autres causes plus rares sont possibles (pathologie valvulaire, cardiomyopathies primitives, cardiomyopathies infectieuses, inflammatoires ou infiltratives, etc.).
Indication des examens d'imagerie
Le diagnostic de l'insuffisance cardiaque repose sur l'examen clinique. L'imagerie a pour but :
- de confirmer le diagnostic de l'insuffisance cardiaque et d'établir la surveillance ;
- de rechercher des signes de complication dont l'œdème aigu du poumon ;
- de faire un diagnostic étiologique.
Estimation de la fraction d'éjection ventriculaire gauche (FEVG)
L'un des meilleurs paramètres pour évaluer l'insuffisance cardiaque est la FEVG, qui témoigne de l'efficacité de la contraction cardiaque. Dans la plupart des cas, l'insuffisance cardiaque entraîne une baisse de la FEVG proportionnelle à la gravité de l'atteinte. L'IRM et la ventriculographie isotopique constituent les techniques les plus robustes pour évaluer la FEVG, mais l'échographie est souvent privilégiée du fait de sa disponibilité et de sa portabilité. L'évaluation de la FEVG est également importante pour apprécier la gravité de l'atteinte, et assurer le suivi sous traitement. D'autres paramètres (VTD et VTS, débit cardiaque) peuvent aussi être utiles pour le suivi.
Évaluation de l'œdème aigu du poumon
La radiographie thoracique peut jouer un rôle pour diagnostiquer une décompensation aiguë de l'insuffisance cardiaque. Souvent, les cavités cardiaques, notamment gauches, sont dilatées, ce qui se traduit sur la radiographie thoracique par un élargissement de la silhouette médiastinale, objectivé par un index cardiothoracique supérieur à 0,5 (figure 26.19). L'œdème pulmonaire cardiogénique, présentation aiguë de l'insuffisance cardiaque, se présente sur la radiographie thoracique par des opacités floconneuses bilatérales, des lignes de Kerley de type B, qui sont de fines lignes (2 à 3 mm) d'environ 1 cm de longueur, perpendiculaires à la plèvre et qui prédominent aux bases, et/ou de type C (lignes B vues de face) et par un épanchement pleural le plus souvent bilatéral. En TDM, les éléments sémiologiques s'expliquent par la physiopathologie de cet œdème pulmonaire : épaississement des septums interlobulaires à prédominance apicale lié à la dilatation veineuse pulmonaire, verre dépoli par engorgement alvéolaire et épanchement pleural (figure 26.20).
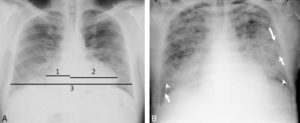
Insuffisance cardiaque.
A. L'index cardiothoracique se mesure sur une radiographie thoracique de face, rayon incident postéro-antérieur, bien inspirée. Il correspond au rapport de la somme des deux diamètres des arcs médiastinaux inférieurs droit et gauche depuis la ligne médiane (ligne des processus épineux) par le plus grand diamètre interne du thorax : (1 + 2)/3. Dans ce cas, il a été mesuré à 0,58 (valeur normale < 0,50). Cette augmentation traduit la cardiomégalie. Les culs-de-sac latéraux sont libres. B. Œdème pulmonaire cardiogénique : élargissement médiastinal ; opacités floconneuses bilatérales par comblement alvéolaire ; quelques lignes de Kerley B (flèches) et C (têtes de flèche)
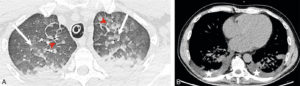
Insuffisance cardiaque.
A. Coupe axiale de TDM thoracique en fenêtre parenchymateuse pulmonaire. Épaississement des septums interlobulaires par dilatation veineuse pulmonaire (têtes de flèche) et verre dépoli intralobulaire (flèches) traduisant l'engorgement alvéolaire. Condensations parenchymateuses pulmonaires postérieures. B. Coupe axiale de TDM thoracique en fenêtre médiastinale. Épanchement pleural bilatéral (étoiles), hypodense, avec concavité vers l'avant (déclivité).
Bilan étiologique
L'insuffisance cardiaque survient le plus souvent dans un contexte étiologique connu (par exemple un patient développant une insuffisance cardiaque dans les suites d'un infarctus). Cependant, il est parfois nécessaire de faire un diagnostic étiologique. Dans ce contexte, l'échographie et surtout l'IRM jouent un rôle prépondérant. L'IRM permet de rechercher des anomalies myocardiques structurelles (présence de fibrose, de nécrose) dont l'importance et la topographie permettent d'orienter le diagnostic étiologique.
Enfin, dans le cas particulier de l'insuffisance cardiaque à FEVG préservée, l'imagerie est utile pour évaluer la fonction diastolique (capacités de remplissage du VG durant la diastole) qui est altérée. L'échographie est l'examen de choix, et à un moindre degré la ventriculographie isotopique et l'IRM.
Essentiel à retenir
- L'échographie Doppler permet d'explorer les structures vasculaires des membres et du cou en prodiguant des informations morphologiques et fonctionnelles hémodynamiques (vitesses circulatoires locales). Elle est plus limitée pour l'exploration des structures vasculaires abdominales, thoraciques et intracérébrales.
- L'échographie cardiaque transthoracique, disponible, non invasive et facile d'utilisation, constitue l'examen d'imagerie de première intention pour l'exploration du cœur. Sa bonne résolution temporelle, associée à l'étude de l'effet Doppler, permet d'analyser très finement les mouvements du myocarde et des valves.
- L'angiographie est une technique d'exploration des vaisseaux par leur opacification directe. Il s'agit d'une technique invasive mais qui présente le grand avantage de pouvoir être associée à un geste thérapeutique (angioplastie pour traitement d'une sténose, embolisation pour stopper une hémorragie, etc.).
- En imagerie en coupes (TDM et IRM), il est le plus souvent nécessaire de synchroniser l'acquisition des images avec l'ECG du patient, afin de tenir compte des mouvements cycliques du cœur, pour s'en affranchir ou au contraire les étudier.
- La TDM, du fait de son excellente résolution spatiale, est surtout utilisée pour l'exploration morphologique des artères de gros calibre (aorte et ses branches, notamment les artères coronaires), après injection d'un agent de contraste à base d'iode pour rehausser le contenu des vaisseaux. Elle est souvent l'examen de première intention dans un contexte d'urgence avec atteinte des grosses artères (aorte et branches), sauf dans l'infarctus du myocarde (coronarographie première pour traitement simultané par désobstruction de l'artère responsable).
- En médecine nucléaire, il existe de multiples MRP permettant d'explorer au choix la contractilité des ventricules, la perfusion et la viabilité myocardique, le métabolisme des cardiomyocytes ou l'innervation sympathique du cœur.
- L'IRM permet une analyse de la contractilité myocardique, de la perfusion myocardique sous couvert de l'injection d'un chélate de gadolinium, mais également de la morphologie et de la structure du myocarde (détection de la nécrose ou de la fibrose myocardique), ainsi qu'une exploration morphologique et fonctionnelle de l'aorte.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 25 - Imagerie thoracique
M. Ohana , G. Ferretti , M. Montaudon et P.-Y. Le Roux
Plan du chapitre
- Radiographie du thorax
- Tomodensitométrie thoracique
- Scintigraphie pulmonaire de ventilation-perfusion
- TEP-TDM au 18F-FDG
Objectifs
Connaissances
- Connaître les critères de qualité d'une radiographie thoracique de face.
- Connaître les différences entre une radiographie de face debout et au lit.
- Connaître la séméiologie élémentaire de la radiographie thoracique :
- pouvoir différencier une opacité d'une clarté pulmonaire et d'une image mixte ;
- savoir localiser une anomalie parenchymateuse au sein des différents lobes ;
- identifier les contours de la silhouette médiastinale ;
- connaître la morphologie normale des culs-de-sac pleuraux.
- Connaître les non-indications de la radiographie thoracique selon la Haute autorité de santé (HAS).
- Connaître la séméiologie de base de la tomodensitométrie (TDM) thoracique :
- reconnaître les fenêtres médiastinale, parenchymateuse et osseuse ;
- pouvoir déterminer si la TDM est injectée ;
- si elle est injectée, savoir déterminer s'il s'agit d'un temps artériel pulmonaire, artériel aortique ou veineux ;
- reconnaître des modifications basiques de la densité du parenchyme pulmonaire : augmentation de densité (condensation alvéolaire, verre dépoli, nodules et masses) ; réduction de densité (emphysème, excavation) ; images mixtes.
- Connaître les indications principales pour lesquelles une TDM thoracique doit être injectée, et celles pour lesquelles ce n'est pas nécessaire.
- Connaître un ordre de grandeur relatif de l'exposition aux rayonnements ionisants entre radiographie et TDM thoraciques.
Compétences
- Sur une radiographie thoracique de face, reconnaître :
- un pneumothorax de forte abondance ;
- une cardiomégalie ;
- un foyer de condensation alvéolaire lobaire ;
- un nodule/une masse parenchymateuse.
- Sur une TDM thoracique, identifier :
- une condensation alvéolaire ;
- un nodule/une masse parenchymateuse ;
- une masse médiastinale ;
- un nœud lymphatique médiastinal normal/pathologique ;
- un défaut de rehaussement au sein des artères pulmonaires ;
- une hyperclarté anormale (pleurale/parenchymateuse).
Communication
- Savoir expliquer à un patient le déroulement d'une angio-TDM thoracique pour recherche d'embolie pulmonaire.
Radiographie du thorax
La radiographie du thorax reste, en 2022, l'examen radiologique le plus pratiqué en France avec environ 13 millions de clichés annuels, concernant dans 60 % des cas des patients hospitalisés. Le coût CCAM (classification commune des actes médicaux) d'une radiographie thoracique de face (réalisation + interprétation) est d'environ 26 euros.
Ce chapitre a pour objectifs de présenter les critères de qualité d'une radiographie thoracique, les éléments essentiels de sa sémiologie et ses indications résiduelles.
Critères de qualité d'une radiographie du thorax
La radiographie thoracique de face est un examen qui doit être acquis dans la mesure du possible en incidence postéro-antérieure, patient debout, de face stricte, en inspiration profonde et correctement contrasté, afin d'être interprétable (figure 25.1).
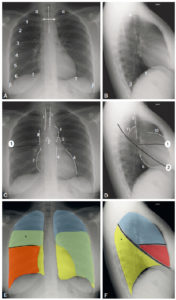
Radiographies normales du thorax, de face et de profil.
A, B. Critères de qualité et éléments anatomiques. Visibilité des apex (α) et des culs-de-sac pleuraux (β), d'au moins six arcs costaux antérieurs au-dessus des coupoles diaphragmatiques (γ) et projection symétrique des articulations sternoclaviculaires (double flèche blanche) par rapport à la ligne des processus épineux (ligne en pointillés). C, D. Structures médiastinales et scissures principales. Structures médiastinales (lignes blanches en pointillés). 1. Trachée ; 2. Carène ; 3. crosse aortique ; 4. bord gauche de l'aorte descendante ; 5. artère pulmonaire ; 6. ventricule gauche ; 7. atrium droit ; 8. veine cave supérieure ; 9. bord postérieur de la trachée ; 10. infundibulum du ventricule droit ; 11. bord supérieur et postérieur de la crosse aortique. Scissures (lignes noires). 1. Petite scissure ; 2. grande scissure (droite et gauche sont représentées superposées). E, F. Représentation des lobes pulmonaires et de leurs superpositions. En bleu : lobe supérieur ; en jaune : lobe inférieur ; en rouge : lobe moyen. Sur la radiographie de thorax de face, les lobes se superposent : la partie la plus apicale du lobe inférieur avec le lobe supérieur (*, vert) et le lobe moyen avec le lobe inférieur droit (orange). Sur le cliché de profil, seule la segmentation du poumon droit est représentée.
L'incidence postéro-antérieure répond à des critères de réalisation stricts : le patient est debout, en inspiration profonde, face contre le capteur de rayons X, dos au tube qui est situé à 1,8 mètre afin de limiter au maximum les déformations géométriques et de ne pas augmenter artificiellement la taille du cœur, situé dans le compartiment antérieur du médiastin. À l'opposé, les radiographies réalisées au lit sont acquises en incidence antéropostérieure, entraînant une majoration de taille du cœur rendant peu fiable l'appréciation du rapport cardiothoracique.
L'acquisition en position debout permet de dégager les culs-de-sac pleuraux latéraux et autorise une inspiration maximale. Les radiographies acquises en position assise ou au lit sont systématiquement de moins bonne qualité. La présence d'un niveau hydroaérique dans l'estomac, sous la coupole diaphragmatique gauche, est un bon indicateur de cliché acquis en position debout ; de même, la position couchée est généralement spécifiée sur le cliché.
L'obtention d'une face stricte est assurée par un centrage précis du patient, qui se vérifie sur le cliché de radiographie thoracique par :
- la visualisation de l'ensemble des parenchymes pulmonaires, des apex jusqu'aux culs-de-sac pleuraux ;
- le caractère médian du sternum et symétrique des articulations sternoclaviculaires par rapport à la ligne des processus épineux.
L'inspiration maximale se vérifie par la visualisation d'un nombre suffisant d'arcs costaux antérieurs ; il faut pouvoir compter au moins six arcs costaux antérieurs au-dessus de la coupole diaphragmatique droite.
Le réglage du contraste, qui peut être affiné a posteriori si l'examen est lu sur support informatique, doit permettre de visualiser la silhouette des corps vertébraux thoraciques en arrière du médiastin.
À retenir
Check-list avant de pouvoir interpréter une radiographie thoracique de face
- Vérification de l'identité du patient et de la date du cliché.
- Acquisition debout : niveau hydroaérique gastrique ; étiquetage.
- Cadrage : des apex jusqu'aux culs-de-sac pleuraux latéraux et inférieurs.
- Centrage : symétrie des clavicules par rapport à la ligne des épineuses.
- Inspiration : compter au moins 6 arcs costaux antérieurs au-dessus de la coupole diaphragmatique droite.
- Contraste : distinguer le rachis thoracique en arrière du médiastin.
Ce n'est qu'après s'être assuré de la qualité du cliché de radiographie thoracique que l'on peut passer à son interprétation. Inversement, tout cliché ne respectant pas ces critères de qualité ne doit être interprété qu'avec la plus extrême précaution ; en particulier, les radiographies thoraciques réalisées au lit sont souvent mal inspirées et mal centrées, ce qui peut très facilement créer de fausses images (syndrome interstitiel, foyer de condensation, cardiomégalie, masse médiastinale) ou, au contraire, en masquer (figure 25.2). Il ne faut pas hésiter à refaire un cliché jugé techniquement insuffisant.
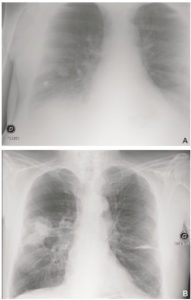
Patient de 68 ans, admis aux urgences pour altération de l'état général avec dyspnée.
Un premier cliché de radiographie du thorax (A) est réalisé à l'admission, à 23 heures. Il est techniquement insuffisant, mal cadré (il manque l'apex droit et le cul-de-sac gauche), n'est pas de face et est mal inspiré (position assise, on ne voit pas assez d'espaces intercostaux). B. Un cliché est réalisé le lendemain matin, en position debout, avec une inspiration suffisante, et démasque deux masses spiculées lobaires supérieures droites en rapport avec une néoplasie primitive.
Rappelons que le cliché radiographique montre par convention le patient vu de face ; sa droite est ainsi à la gauche du cliché.
Afin de vous aider à ne pas « oublier » de regarder un des compartiments anatomiques du thorax et à ne pas négliger une anomalie, nous vous proposons de suivre le plan de lecture systématique et organisé de la radiographie thoracique suivant :
- identification du patient ;
- qualité : centrage, position, noircissement ;
- parties molles extrathoraciques, seins ;
- cadre osseux : rachis thoracique, côtes, clavicules, scapulas ;
- médiastin : trachée, cœur, vaisseaux, lignes médiastinales ;
- hiles : taille, position, densité ;
- plèvre : diaphragmatique, costale, médiastinale ;
- champs pulmonaires : taille, situation, symétrie de transparence ;
- zones cachées : apex pulmonaires, hiles, rétrocardiaque, rétrodiaphragmatique ;
- sous le diaphragme : niveau hydroaérique gastrique.
Les acquisitions complémentaires de la radiographie thoracique standard sont :
- le profil (figure 25.1B), dont l'acquisition ne doit pas être systématique car plus irradiant que la face. Il est acquis systématiquement en profil gauche afin de minorer la taille du cœur. Il est utile pour localiser une anomalie vue sur le cliché de face (nodule, masse, condensation alvéolaire, atélectasie), explorer les espaces clairs rétrosternal et rétrocardiaque, et objectiver un épanchement pleural de faible abondance de localisation postérieure ou scissural enkysté ;
- l'acquisition de face en expiration profonde, qui peut être utile pour majorer un petit pneumothorax difficilement visible en inspiration, ou pour confirmer indirectement la présence d'un corps étranger endobronchique obstructif, entraînant l'absence de collapsus pulmonaire expiratoire du poumon d'aval (appelé également piégeage expiratoire : le poumon piégé est de grande taille et reste « noir » en expiration).
Sémiologie élémentaire de la radiographie du thorax
La radiographie standard est une imagerie de transmission et de projection (voir chapitre 3) :
- de transmission car tout ce qui atténue le faisceau de rayons X entraîne une opacité plus ou moins marquée, tandis que toute transmission anormalement facile du faisceau de rayons X (air) aboutit à une clarté ;
- de projection car la structure 3D traversée est projetée (« aplatie ») sur une image 2D.
Ces deux critères permettent de différencier et de localiser les anomalies.
Une opacité pulmonaire se traduit par une augmentation de la densité, comparativement au parenchyme pulmonaire adjacent, c'est-à-dire par une image plus « blanche ». Cette augmentation peut être plus ou moins marquée selon la composition et la taille de l'anomalie : une lésion calcifiée est plus opaque (« blanche ») qu'une lésion tissulaire, qui est elle-même plus opaque qu'une lésion graisseuse.
Une clarté est une diminution de la densité, c'est-à-dire une image plus « noire ». La clarté est due à un remplacement du parenchyme pulmonaire normal par de l'air qui n'atténue plus la transmission des rayons X (tableau 25.1).
Tableau 25.1 - Effets de l'atténuation des rayons X sur l'image radiologique
|
Absorption des RX |
Structure |
Traduction radiographique |
|
+ |
Air |
Image noire |
|
++ |
Graisse |
Image gris foncé |
|
+++ |
Tissu mou – eau |
Image gris clair |
|
++++ |
Calcification – os |
Image blanche |
|
+++++ |
Métal |
Image blanche brillante |
Une fois ces anomalies repérées, il faut déterminer leur localisation :
- médiastinale : sur le cliché de face, on définit les localisations supérieure (au-dessus de la crosse de l'aorte), moyenne et inférieure (en-dessous de la carène). Sur le cliché de profil, on détermine les positions antérieure (en avant de l'aorte ascendante et du cœur), moyenne et postérieure (derrière une ligne passant 1 cm en arrière du bord antérieur des corps vertébraux). Une opacité médiastinale se manifeste par une augmentation de densité et/ou de taille du médiastin. La clarté médiastinale, ou pneumomédiastin, se manifeste par la présence anormale d'air moulant les structures médiastinales normales ;
- parenchymateuse. Il faut préciser la position lobaire :
- à droite, il y a trois lobes : la limite entre le lobe supérieur et le lobe moyen est la petite scissure (fissure horizontale), qui du fait de sa position horizontale à mi-champ pulmonaire est souvent bien visualisée sur les clichés de face et de profil ; la grande scissure (fissure oblique) sépare le lobe inférieur, en bas et en arrière, des lobes supérieur et moyen en haut et en avant (car, en l'occurrence, un bout du lobe inférieur est au-dessus du lobe moyen). Elle n'est pas visualisée sur le cliché de face mais visible sur le profil. Le signe de la silhouette (figure 25.3) aide à localiser une anomalie. Lorsqu'une opacité anormale, ayant une densité proche des tissus, est en contact avec une structure normale de même densité (médiastin ou diaphragme) leurs contours respectifs ne sont plus visibles sur toute l'étendue du contact. Ce signe correspond à celui de la silhouette. Ce signe permet de localiser une opacité par rapport à une structure connue et parfois de la démasquer. Il n'en précise pas l'origine ;
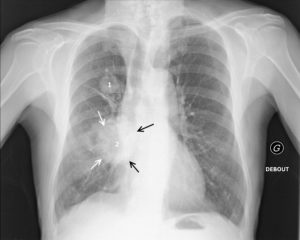
Patient de 54 ans, fumeur, avec un double cancer pulmonaire droit.
La radiographie du thorax objective un nodule du lobe supérieur droit (1) de contours spiculés, et une masse à contours spiculés (flèches blanches) en projection de la base pulmonaire droite (2). La masse 2 est soit dans le lobe moyen, soit dans le lobe inférieur. Si une opacité de tonalité hydrique se trouve dans le lobe moyen, son bord interne se confond avec le bord droit du cœur. Or, ici, la masse est silhouettée par de l'air sur son bord interne (flèches noires), ce qui signifie qu'elle n'est pas dans le plan du cœur, mais plus postérieure ; c'est le signe de la silhouette. La masse 2 se situe donc dans le lobe inférieur droit.
- à gauche, il y a deux lobes, séparés par la grande scissure. Elle est habituellement visible sur un cliché de profil et invisible sur le cliché de face.
- pleurale : il faut rechercher une opacité déclive comblant le cul-de-sac pleural (= épanchement – figure 25.4), une clarté plutôt apicale (= pneumothorax – figure 25.5) ou une opacité avec des angles de raccordement doux (= lésion d'origine pleurale – figure 25.6) ;
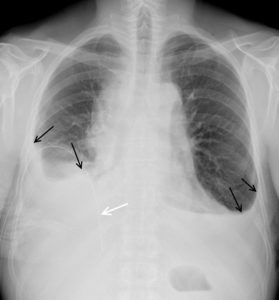
Patient de 46 ans, admis aux urgences pour dyspnée et douleur thoracique.
Comblement des culs-de-sac pleuraux latéraux par une opacité concave vers le haut, bien délimitée, à angle de raccordement pleural doux, correspondant à un épanchement pleural bilatéral. La limite de cet épanchement (flèches noires) est appelée ligne de « Damoiseau ». À droite, un drain pleural a été posé (flèche blanche). Noter la disparition des contours normaux des coupoles diaphragmatiques en raison d'un signe de la silhouette.
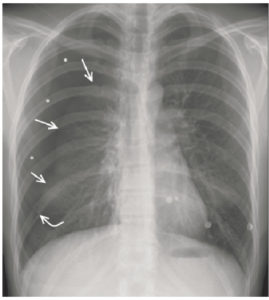
Patient de 18 ans, admis aux urgences pour douleur thoracique droite secondaire à une chute d'un arbre.
On visualise une hyperclarté hémithoracique périphérique droite (astérisques), avec une absence de trame alvéolo-interstitielle et une ligne pleurale (flèches) délimitant de manière nette le poumon droit tassé : pneumothorax droit secondaire à une fracture costale (flèche courbe).
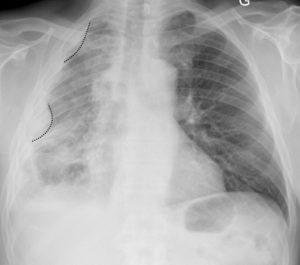
Patient de 57 ans exposé professionnellement à l'amiante.
Multiples opacités pleurales droites, à angle de raccordement doux, réalisant un aspect festonné de la plèvre. Il s'agit d'un aspect évocateur d'une tumeur primitive de la plèvre, le mésothéliome. Il s'accompagne d'une perte de volume du poumon droit.
- pariétale : les clartés pariétales témoignent de la présence anormale d'air dans la paroi. La cause la plus fréquente est l'emphysème pariétal accompagnant un pneumothorax (figure 25.7).
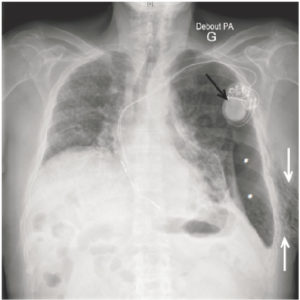
Patient de 87 ans porteur d'une fibrose pulmonaire idiopathique.
Pneumothorax gauche (astérisque) avec emphysème sous-cutané pariétal axillaire gauche (flèches blanches), se manifestant sous la forme de clartés linéaires d'extension limitée. Noter l'aspect pathologique du parenchyme pulmonaire droit en rapport avec la fibrose. Présence par ailleurs d'un pace-maker (flèche noire).
Une fois la lésion localisée, il faut étudier ses caractéristiques :
- contours : sont-ils nets (= limite claire entre la lésion et les structures saines adjacentes) ou flous ? S'ils sont nets, sont-ils réguliers ou irréguliers ? S'ils sont irréguliers, sont-ils macrolobulés, microlobulés ou spiculés ?
- forme : ronde, ovalaire, segmentaire, etc. ;
- densité : homogène ou mixte (= mélange d'opacités et/ou de clartés différentes) ?
- taille : pour les lésions du parenchyme, on parle de micronodule lorsqu'une lésion fait moins de 5 mm, de nodule jusqu'à 3 cm et de masse au-delà de 3 cm.
Indications
La radiographie est un examen très souvent demandé pour de nombreuses pathologies thoraciques.
Afin de limiter son utilisation, la HAS a établi en 2009 une liste des principales non-indications de la radiographie thoracique :
- dans les maladies respiratoires non tumorales, la radiographie thoracique n'est pas indiquée dans les infections des voies aériennes hautes, la bronchite aiguë, la bronchiolite non compliquée de l'enfant ou la douleur thoracique non spécifique en dehors de l'urgence ;
- dans les maladies cardiovasculaires, la radiographie thoracique n'est pas indiquée en cas d'hypertension artérielle (HTA) ou pour le suivi de l'insuffisance cardiaque ;
- dans les maladies tumorales, la radiographie thoracique n'est pas indiquée pour le dépistage et ne garde que de rares indications pour le suivi, entre deux examens tomodensitométriques ;
- dans le bilan pré-anesthésie, la radiographie thoracique n'est pas indiquée chez les sujets de moins de 60 ans sans comorbidités cardiopulmonaires ;
- dans les services de réanimation, la radiographie thoracique n'est pas indiquée de manière systématique chez un patient stable non ventilé ;
- dans les services d'urgences, la radiographie thoracique n'est pas indiquée systématiquement, et ne doit pas être réalisée lorsque l'on suspecte une perforation œsophagienne, une dissection aortique ou une rupture d'anévrisme.
Tomodensitométrie thoracique
Le thorax, y compris en imagerie cardiaque, est un domaine où la tomodensitométrie (TDM) excelle, du fait de sa haute résolution spatiale et du contraste naturel élevé des structures (voir chapitre 4).
Technique
L'interprétation d'une TDM thoracique doit absolument se faire sur une console informatique, qui permet une adaptation en temps réel du contraste, des zooms, des reconstructions multiplanaires dans les trois plans de l'espace, des reconstructions obliques selon le plan des vaisseaux et un défilement facilitant le repérage d'anomalies.
Il est plus simple d'analyser une TDM thoracique en trois étapes successives (figure 25.8) :
- l'étude du médiastin : elle se fait en « fenêtre médiastinale » (niveau 30 unités Hounsfield [UH]) ; largeur 350 UH), avec un filtre qui favorise le contraste et permet de bien analyser les structures tissulaires et vasculaires du médiastin ;
- l'étude du parenchyme : elle se fait en « fenêtre parenchymateuse » (niveau –400 UH ; largeur 1600 UH), avec un filtre qui favorise la résolution spatiale et fait bien ressortir les structures interstitielles fines.
- l'étude de la paroi : elle se fait en « fenêtre osseuse » (niveau 500 UH ; largeur 1500 UH), avec un filtre qui favorise la résolution spatiale et des reconstructions 2D et 3D.
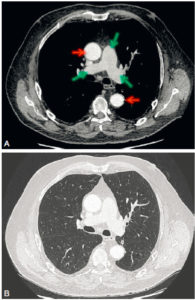
Coupes axiales d'une TDM thoracique, en fenêtre médiastinale (A) et en fenêtre parenchymateuse (B).
Le caractère injecté ou non de l'examen se détermine sur la fenêtre médiastinale. Ici, cette TDM est injectée, car il existe un rehaussement des vaisseaux (aorte, flèches rouges ; et artères pulmonaires, flèches vertes).
Pour l'analyse du médiastin, il est possible de mieux faire ressortir les structures vasculaires et tissulaires en injectant un produit de contraste iodé en intraveineux.
Les structures vasculaires et tissulaires médiastinales sont analysées après injection d'un produit de contraste iodé en intraveineux, avec possibilité de réaliser des acquisitions à différents temps (figure 25.9) :
- un temps sans injection, dit en « contraste spontané » : il est reconnu par l'aspect gris homogène des vaisseaux médiastinaux ;
- un temps artériel pulmonaire : il est reconnu par une opacification des artères pulmonaires qui apparaissent rehaussées et donc très blanches. C'est une angioTDM des artères pulmonaires, sur laquelle l'aorte n'est parfois pas encore opacifiée ;
- un temps artériel aortique : il est acquis un peu après le temps artériel pulmonaire, et est reconnu par une opacification très marquée de l'aorte thoracique. C'est une angioTDM aortique, sur laquelle les artères pulmonaires ne sont parfois déjà plus opacifiées ;
- un temps veineux : il est acquis entre 70 et 90 secondes après injection. Il sert à l'étude des lésions tissulaires comme les adénopathies, les tumeurs médiastinales, les collections pleurales, etc.
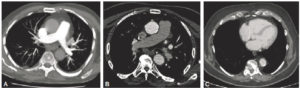
TDM thoraciques injectés, en coupe axiale et en fenêtre médiastinale.
A. L'artère pulmonaire et ses branches sont bien opacifiées (« blanches ») et l'aorte est encore grise ; il s'agit donc d'un temps artériel pulmonaire. B. L'aorte est bien opacifiée (« blanche ») et les artères pulmonaires ne sont plus aussi « blanches » qu'en (A) ; il s'agit d'un temps artériel aortique. C. Les cavités cardiaques droite et gauche sont opacifiées de manière homogène ; il s'agit d'un temps veineux (dit d'équilibre).
L'injection se réalise habituellement par une veine du membre supérieur, avec administration de 50 à 120 mL de produit de contraste iodé à un débit compris entre 1,5 et 5 mL/s. Pour le temps artériel, le déclenchement de l'acquisition se fait par méthode de suivi de l'embole (« bolus-tracking »), avec réalisation d'une coupe test au niveau de l'artère pulmonaire ou de l'aorte, permettant de déclencher l'acquisition au moment exact où ces vaisseaux sont parfaitement opacifiés.
Sémiologie élémentaire
Étude du médiastin
L'analyse des gros vaisseaux du médiastin nécessite une injection de produit de contraste.
On s'intéresse principalement à l'aorte thoracique (aorte ascendante, crosse aortique avec l'origine des troncs supra-aortiques et aorte thoracique descendante) et aux artères pulmonaires.
Pour chaque vaisseau, on analyse (voir figure 25.9) :
- la taille :
- aorte ascendante :
- normale < 45 mm de diamètre,
- si > 45 mm : anévrisme,
- artère pulmonaire :
- normale < 29 mm,
- si > 29 mm, forte suspicion d'hypertension pulmonaire.
- le contenu (figure 25.10) :
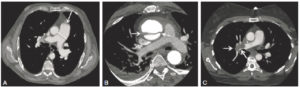
TDM thoraciques en coupe axiale et en fenêtre médiastinale, montrant différentes pathologies visibles grâce à l'injection de produit de contraste.
A. Artère pulmonaire augmentée de taille (flèche), avec un tronc mesurant 37 mm de diamètre, ce qui est un signe d'hypertension pulmonaire. B. Image hypodense linéaire au sein de l'aorte ascendante, correspondant à un flap intimal (flèches) : dissection aortique ascendante. Il existe un épanchement péricardique et pleural associé. C. Image hypodense de type défect endoluminal au sein de l'artère pulmonaire droite : une embolie pulmonaire aiguë (flèches).
- le contenu normal des vaisseaux opacifiés est homogène mais la densité est variable en fonction du temps d'injection, de la concentration et du débit d'injection du produit de contraste ;
- une image linéaire hypodense (gris sombre) au sein de l'aorte traduit un flap intimal (intima + média) de dissection aortique ;
- une image hypodense centrale au sein des artères pulmonaires est en rapport avec une embolie pulmonaire aigue.
La recherche de nœuds lymphatiques médiastinaux anormaux est facilitée par l'injection de produit de contraste, qui permet de mieux les différencier des vaisseaux. Ils sont principalement recherchés au niveau des hiles, autour de la trachée et à gauche de la crosse aortique (figure 25.11). La TDM thoracique peut aussi révéler des nœuds lymphatiques axillaires, supraclaviculaires ou jugulocarotidiens bas.
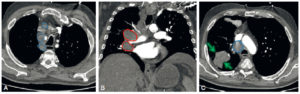
Patient de 56 ans suivi pour adénocarcinome pulmonaire.
TDM thoracique injectée en coupes axiales (A, C) et coronale (B), mettant en évidence de multiples adénomégalies médiastinales en latérotrachéal droit (A, C, ronds bleus) et en hilaire droit (B, ronds rouges) secondaires au cancer lobaire inférieur droit (C, flèches vertes).
Pour chaque nœud lymphatique décelé, on étudie :
- la taille : il est normal de voir des nœuds lymphatiques inférieurs à 10 mm de petit axe dans le médiastin et les hiles. Un nœud lymphatique dont le petit axe est supérieur à 10 mm est suspect : on parle d'adénomégalie. Plus le nœud lymphatique est de grande taille, plus le caractère pathologique est fort ;
- la morphologie : un nœud lymphatique rond, se rehaussant de manière importante ou contenant des plages hypodenses de nécrose est suspect ;
- la densité : la présence de calcifications est fréquente, témoignant soit de séquelles infectieuses (tuberculose), soit de maladies chroniques granulomateuses (sarcoïdose, silicose). Un centre graisseux est en faveur d'un nœud lymphatique bénin.
Un épanchement pleural ou péricardique se visualise facilement en TDM (figure 25.12).
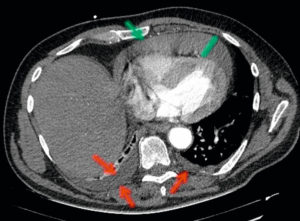
Patient de 74 ans avec syndrome inflammatoire.
TDM thoracique injectée en coupe axiale et en fenêtre médiastinale montrant un épanchement pleural bilatéral (flèches rouges) et un épanchement péricardique (flèche verte) de plus de 1 cm d'épaisseur, de forte abondance. Tous ces épanchements ont une densité faible (ils sont « gris foncé ») qui correspond à une densité liquidienne.
Son abondance peut être évaluée par la mesure de son épaisseur dans un plan horizontal ; un épanchement pleural de plus de 4 cm et un épanchement péricardique de plus de 1 cm peuvent être considérés comme abondants.
Devant tout épanchement pleural, il faut rechercher des nodules tissulaires accolés aux parois, reconnus à leur densité différente du liquide d'épanchement (figure 25.13). La constatation de tels nodules signe l'origine néoplasique de l'épanchement (soit lésion pleurale primitive type mésothéliome, soit métastase pleurale).
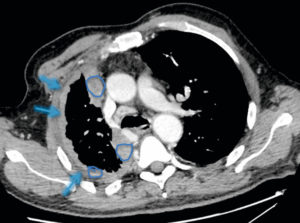
TDM thoracique injectée en coupe axiale du patient de la figure 25.6, montrant un épaississement pleural droit (flèches) dense constitué de plusieurs nodules tissulaires (ronds bleus) (a contrario des anomalies de densité liquidienne de la figure 25.12), différents d'un simple épanchement liquidien, en rapport avec un mésothéliome.
Étude du parenchyme
La condensation alvéolaire (figure 25.14) correspond à une plage de parenchyme pulmonaire dense (« blanche ») au sein de laquelle on parvient encore à distinguer des bronches normalement aérées, donc encore noires (signe du bronchogramme aérique).
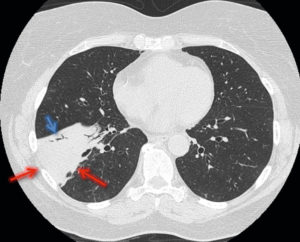
TDM thoracique en coupe axiale et en fenêtre parenchymateuse chez une patiente de 61 ans admise aux urgences pour dyspnée fébrile.
Mise en évidence d'une condensation alvéolaire bien systématisée lobaire inférieure droite (flèches rouges) avec bronchogramme aérique (flèche bleue), correspondant à une pneumopathie franche lobaire aiguë.
La condensation alvéolaire, lorsqu'elle est systématisée à un segment pulmonaire et associée à un syndrome infectieux clinique et biologique, correspond généralement à une pneumopathie infectieuse (bactérie, virus ou champignon). Mais de nombreuses autres causes sont responsables de condensations alvéolaires d'évolution aiguë : œdème pulmonaire cardiogénique ou non, pneumonie d'aspiration par fausse route, hémorragie pulmonaire, infarctus parenchymateux compliquant une embolie pulmonaire, pneumonie médicamenteuse. En présence d'une condensation alvéolaire d'évolution chronique, il faut éliminer un adénocarcinome pulmonaire à forme pneumonique ou un lymphome.
Un nodule pulmonaire correspond à une lésion tissulaire plus ou moins arrondie située au sein du parenchyme pulmonaire.
Devant un nodule pulmonaire, il faut analyser (figure 25.15) :
- sa taille : comme en radiographie, un nodule de moins de 5 mm est un micronodule ; un nodule de plus de 30 mm est appelé masse pulmonaire et est hautement suspect de lésion tumorale ;
- ses contours : réguliers ou spiculés ; l'aspect spiculé « en étoile » est également très suspect de tumeur ;
- sa densité, étudiée en fenêtre médiastinale : le nodule peut être de densité tissulaire, donc gris, prenant plus ou moins le contraste, ou être de densité graisseuse (donc noir), ou calcique (très blanc) ;
- le nombre et la localisation.
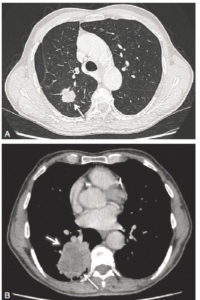
A. Patient de 69 ans, fumeur. TDM thoracique en coupe axiale et en fenêtre parenchymateuse montrant un nodule spiculé du lobe supérieur droit (flèche). Le caractère spiculé et la taille de ce nodule sont très évocateurs d'un cancer pulmonaire primitif. B. Patient de 79 ans, fumeur. TDM thoracique injectée en coupe axiale et en fenêtre médiastinale démontrant une masse de 7 cm du lobe inférieur droit, avec des contours irréguliers spiculés et un centre hypodense correspondant à de la nécrose (flèches). L'association d'une lésion de plus de 3 cm (masse), de contours irréguliers et d'un centre nécrotique est très évocatrice d'une néoplasie pulmonaire primitive. Cependant, cet aspect peut également être trouvé en présence d'un abcès pulmonaire.
Indications
La TDM thoracique utilise des rayons X, avec des doses qui sont nettement plus élevées que celles d'une radiographie du thorax : habituellement entre 5 et 100 fois plus qu'une radiographie thoracique selon le morphotype du patient. Ainsi, ses indications se doivent d'être parfaitement justifiées afin de limiter l'exposition des patients
Dans la recherche et/ou l'analyse d'anomalies parenchymateuses (pneumopathies infectieuses compliquées, nodules parenchymateux, pneumopathies interstitielles, recherche d'un pneumothorax, etc.), une TDM thoracique sans injection est suffisante.
Dans le bilan d'anomalies médiastinales, qu'elles soient tissulaires (recherche d'adénopathies médiastino-hilaires, bilan de tumeurs médiastinales, analyse d'épanchements chroniques ou cloisonnés) ou vasculaires (analyse des artères pulmonaires, analyse de l'aorte, bilan d'hémoptysies, etc.), une injection est nécessaire, avec un temps d'acquisition (artériel pulmonaire, artériel aortique ou veineux) adapté à la pathologie recherchée.
Scintigraphie pulmonaire de ventilation-perfusion
Technique
La scintigraphie pulmonaire permet de visualiser la distribution régionale des deux grands systèmes nécessaires à l'hématose : la perfusion et la ventilation pulmonaire.
L'étude de la perfusion se fait après injection dans une veine périphérique de macro-agrégats de sérum albumine marqués au 99mTc. Ces particules ont un diamètre de l'ordre de quelques dizaines de microns, supérieur au diamètre des capillaires pulmonaires. La fixation du traceur est donc mécanique, par blocage (embolisation) au niveau des précapillaires pulmonaires. Environ 1 capillaire sur 10 000 est obstrué ; l'examen ne présente donc pas de risque pour le patient.
L'étude de la ventilation se fait après inhalation d'un gaz radioactif (krypton 81mKr) ou d'aérosols (particules de carbone ou phytates) marqués avec du 99mTc, qui vont se déposer au niveau des parois bronchiques selon la ventilation régionale.
L'examen est réalisé à l'aide d'une gamma-caméra. Deux modes d'acquisition sont possibles : planaire (six incidences sont classiquement réalisées : antérieure, postérieure, deux incidences obliques postérieures et deux profils) ou tomographique, qui permet, comme pour une TDM, la reconstruction multiplanaire des images dans les trois plans de l'espace.
Sémiologie élémentaire
Dans une scintigraphie de perfusion normale, la distribution du radiotraceur est homogène sur l'ensemble du parenchyme pulmonaire. Les hiles et le médiastin ne sont pas hyperfixants (les macro-agrégats sont bloqués au niveau des précapillaires pulmonaires ; ils ne circulent plus). L'acquisition étant réalisée en décubitus dorsal, il existe fréquemment un gradient de fixation antéropostérieur du fait de la gravité.
Quand le flux sanguin est interrompu ou significativement altéré dans une région du poumon, celle-ci apparaît comme une zone hypofixante ou non fixante.
Ainsi, la scintigraphie de perfusion permet de visualiser la distribution régionale du flux sanguin artériel pulmonaire.
Dans une scintigraphie de ventilation normale, la distribution du radiotraceur est également homogène. Si un gaz radioactif est utilisé (81mKr), la trachée et les bronches proximales sont visualisées. Avec les aérosols, des foyers très hyperfixants sont parfois visualisés, correspondant à des impactions focales du radiotraceur au niveau des bifurcations bronchiques.
Comme pour les images de ventilation, une diminution ou l'absence de ventilation dans un territoire apparaît comme une zone hypofixante ou non fixante.
L'interprétation d'une scintigraphie pulmonaire de ventilation-perfusion repose sur une analyse comparative des images de ventilation et de perfusion.
Pour chaque hypofixation décelée, on précise :
- sa topographie (lobe, segment) ;
- sa taille : typiquement segmentaire ou sous-segmentaire ;
- l'intensité de l'hypofixation ;
- son aspect systématisé ou non. Pour qu'un défaut de perfusion soit évocateur d'une embolie pulmonaire, il doit être systématisé, c'est-à-dire triangulaire à base pleurale, correspondant anatomiquement à un territoire vasculaire (lobe, segment ou sous-segment) ;
- la concordance des anomalies perfusionnelles et ventilatoires.
Indications
L'indication principale de la scintigraphie pulmonaire de ventilation-perfusion est la recherche d'embolie pulmonaire (figure 25.16). L'embolie pulmonaire correspond à l'obstruction d'un ou de plusieurs vaisseaux artériels pulmonaires par un caillot de sang (thrombus). Celui-ci a le plus souvent migré depuis une veine des membres inférieurs atteinte par une phlébite, appelée aussi thrombose veineuse. Selon le niveau de l'obstruction et le diamètre du caillot, tout ou une partie du poumon est privé de sang. Cette obstruction se traduit en scintigraphie pulmonaire par une hypofixation systématisée sur les images de perfusion (absence de vascularisation en aval de l'embole), non retrouvée sur les images de ventilation (absence de conséquence sur la ventilation à la phase aiguë de l'embolie pulmonaire).
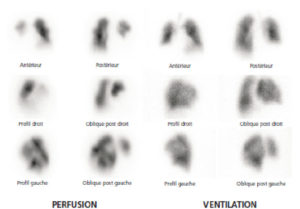
Patient de 68 ans adressé aux urgences pour dyspnée et douleur thoracique.
La scintigraphie de perfusion met en évidence de multiples hypofixations segmentaires et sous-segmentaires systématisées, bilatérales, non retrouvées sur les images de ventilation. L'examen est donc très évocateur d'une embolie pulmonaire récente.
L'examen peut également être utilisé pour évaluer la distribution régionale de la perfusion et de la ventilation pulmonaire, par exemple dans le cadre du bilan préopératoire d'un cancer pulmonaire.
TEP-TDM au 18F-FDG
Sémiologie élémentaire
De façon physiologique, les poumons, remplis d'air, apparaissent hypofixants. Le médiastin présente une hyperfixation modérée correspondant au FDG présent dans la circulation sanguine. Une hyperfixation du myocarde est fréquente et physiologique.
Lors de l'interprétation, on recherche des hyperfixations pathologiques sur les images TEP, les images TDM couplées permettant de préciser leur correspondance anatomique. Pour chaque hyperfixation, on précise son intensité, son caractère focal ou diffus, sa correspondance anatomique.
Indications
La TEP-TDM pulmonaire est indiquée pour caractériser les nodules pulmonaires de taille supérieure à 1 cm. Un nodule ne fixant pas le FDG (non hypermétabolique) peut être surveillé en tomodensitométrie. En revanche, un nodule hypermétabolique doit faire l'objet d'un contrôle histologique.
La TEP-TDM est également indiquée lors du bilan d'extension des cancers pulmonaires pour évaluer l'extension lymphatique et métastatique à distance de la maladie (figure 25.17). Elle permet de plus d'apprécier la réponse aux traitements antitumoraux et de détecter les récidives.
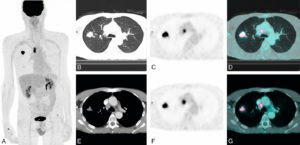
Patient de 65 ans, fumeur, adressé pour caractérisation et bilan d'extension d'une masse pulmonaire droite.
Images TDM (B et E), TEP-FDG (A, C et F) et TEP-FDG fusionnées à la TDM (D et G) montrant une hyperfixation très intense de la masse pulmonaire droite, confirmant son caractère très suspect. Il s'y associe une hyperfixation très intense d'une adénopathie latérotrachéale droite, faisant fortement suspecter une extension ganglionnaire médiastinale homolatérale. En revanche, absence d'hyperfixations évocatrices d'une atteinte ganglionnaire médiastinale controlatérale, viscérale ou osseuse.
La TEP-TDM au 18F-FDG présente aussi un intérêt pour le bilan de maladies inflammatoires (sarcoïdose par exemple) ou en pathologie infectieuse (infection de prothèse) (voir chapitre 19).
Essentiel à retenir
- La radiographie thoracique de face reste l'examen princeps en imagerie thoracique, même si ses performances en termes de sensibilité et de spécificité sont modestes. Elle doit répondre à des critères de qualité strictes afin d'être interprétable. Elle s'analyse de manière systématique.
- La TDM thoracique est l'examen de référence pour l'analyse du parenchyme (injection de produit de contraste non obligatoire) et du médiastin (injection de produit de contraste nécessaire). Elle s'analyse sur console de travail, de manière dynamique, en exploitant les possibilités de reconstructions et de modification du contraste. Elle est entre 5 et 100 fois plus exposante aux rayonnements ionisants qu'une radiographie thoracique de face.
- La scintigraphie pulmonaire permet la visualisation de la distribution régionale de la ventilation et de la perfusion pulmonaires. Sa principale indication est la suspicion d'embolie pulmonaire.
- La TEP-TDM au 18FDG est un examen essentiel en oncologie thoracique, notamment pour la caractérisation des nodules pulmonaires et le bilan d'extension des cancers pulmonaires.
Pour en savoir plus
- Lacey G, Morley S, Berman L. La radiographie thoracique. Manuel pratique. Traduction L. Arrivé. Paris: Elsevier Masson ; 2009.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 24 - Imagerie oto-rhino-laryngologique
S. Molière , S. Cahen-Riehm et R. Abgral
Plan du chapitre
- Introduction
- Imagerie de l'oreille et de l'os temporal
- Imagerie cervicofaciale non oncologique
- Imagerie morphologique des cancers des VADS
- Imagerie moléculaire des cancers des VADS : TEP au 18F-FDG
Objectifs
- Connaître les différentes modalités radiologiques utilisées en imagerie ORL.
- Savoir quelles modalités radiologiques utiliser pour explorer les différentes régions de la sphère ORL (os temporal, massif facial, cou).
- Connaître quelques éléments d'anatomie et de séméiologie normales en imagerie ORL.
- Connaître quelques éléments séméiologiques pathologiques en imagerie ORL.
- Connaître les principales indications de l'imagerie ORL.
Introduction
La sphère ORL correspond à trois régions anatomiques de l'extrémité céphalique :
- l'os temporal et son contenu auquel on associe les angles pontocérébelleux ;
- les sinus de la face et l'étage antérieur (os frontal et ethmoïde) et moyen (sphénoïde) de la base du crâne ;
- la filière oro-pharyngo-laryngée qui s'étend du nasopharynx (rhinopharynx) jusqu'à la traversée cervicothoracique et inclut l'ensemble des espaces cervicaux.
L'imagerie de la sphère ORL fait appel à différentes modalités d'imagerie, dont les indications et les performances varient selon la région et les pathologies explorées (échographie, TDM, cone beam computed tomography [CBCT], IRM, TEP au 18F-FDG).
Imagerie de l'oreille et de l'os temporal
Technique
L'étude de l'os temporal et de la base du crâne repose sur deux techniques complémentaires d'imagerie en coupes : la TDM et l'IRM.
La TDM du rocher, réalisée sans injection de produit de contraste, en filtre osseux avec des coupes très fines (épaisseur < 0,6 mm), permet une analyse fine de l'os temporal, de ses cavités et des osselets. Elle permet des reconstructions dans les trois plans de l'espace (figures 24.1 et 24.2) – le plan du canal semi-circulaire latéral est le plan axial de référence –, des reconstructions dans le plan des différents osselets et selon le V ossiculaire, formé par la branche longue de l'incus (enclume) et le stapes (étrier).
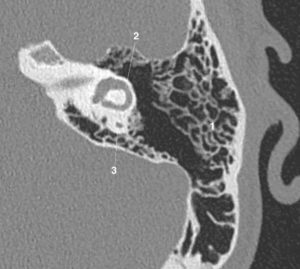
TDM d'un rocher normal en coupe axiale dans le plan de référence (plan du canal semi-circulaire latéral).
1. Cellules mastoïdiennes ; 2. labyrinthe osseux : canal semi-circulaire latéral ; 3. labyrinthe osseux : canal semi-circulaire postérieur.
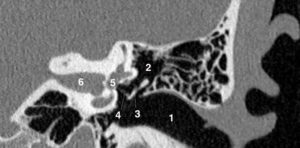
TDM d'un rocher normal en coupe coronale.
1. Méat acoustique externe ; 2. récessus épitympanique de la cavité tympanique ; 3. incus ; 4. incus (incus et stapes formant le « V ossiculaire ») ; 5. labyrinthe osseux : vestibule ; 6. méat acoustique interne.
L'IRM du rocher permet l'étude des cavités du rocher (asignal de la cavité tympanique normalement aérée, signal liquidien des cavités de l'oreille interne, signal variable de la mastoïde et de la pointe du rocher en fonction du degré de pneumatisation), du méat acoustique interne et des angles pontocérébelleux (figure 24.3). Elle inclut des séquences en pondération T1 avant et surtout après injection de gadolinium, des séquences tridimensionnelles à forte pondération T2 (dites « liquidiennes ») en haute résolution (épaisseur de coupe < 0,8 mm) et une séquence de diffusion.
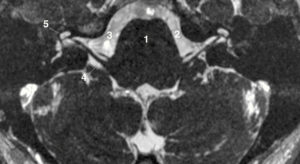
IRM de l'angle pontocérébelleux en séquence « liquidienne » haute résolution.
1. Pont ; 2. LCS de la citerne prépontique ; 3. nerf facial (VII) ; 4. nerf vestibulocochléaire (VIII) ; 5. liquide périlymphatique du tour basal de la cochlée.
Indications et éléments de séméiologie
Oreille externe et oreille moyenne
Ce sont des cavités aérées, dont les structures physiologiques (osselets) et pathologiques (comblements liquidien ou tissulaire) bénéficient d'un bon contraste spontané en TDM.
La TDM permet également l'étude des parois osseuses et des osselets grâce à une excellente résolution spatiale.
Les affections de l'oreille externe et de l'oreille moyenne sont généralement responsables d'une surdité de transmission. Nous distinguerons les pathologies aiguës et chroniques.
Pathologie aiguë
Une otite externe ou une otite moyenne aiguë ne justifient pas d'imagerie dans leur forme simple. En revanche, lorsqu'une complication endocrânienne d'une otite moyenne et/ou d'une mastoïdite est suspectée, la TDM ou, mieux, l'IRM permet de rechercher un abcès intracrânien, une thrombophlébite cérébrale, voire, sur l'IRM, des signes de méningite ou de labyrinthite (figure 24.4).
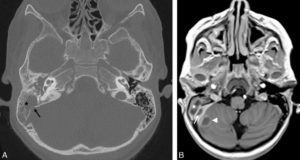
Céphalées fébriles chez un enfant de 5 ans : mastoïdite droite compliquée de thrombose du sinus latéral et d'abcès cérébelleux.
A. La TDM du rocher montre un comblement des cellules mastoïdiennes droites (étoile) et de la cavité tympanique associée à une lyse osseuse de la corticale postérieure du rocher (flèche). B. L'IRM en séquence pondérée T1 après injection de gadolinium montre le comblement des cellules mastoïdiennes (étoile) et les complications endocrâniennes : thrombus au sein du sinus veineux latéral droit sous forme d'un défaut de rehaussement au sein du sinus (flèche) et abcès cérébelleux droit sous forme d'une collection intra-axiale avec prise de contraste périphérique (tête de flèche).
La TDM et l'IRM permettent également de rechercher des signes d'ostéite dans le cadre d'une otite externe nécrosante (otite maligne externe), forme particulièrement grave d'otite externe survenant sur un terrain fragilisé (diabète, immunodépression, etc.).
La TEP au 18F-FDG peut apporter des informations complémentaires à l'imagerie morphologique pour le diagnostic d'ostéite (imagerie du métabolisme cellulaire).
Pathologie chronique
Devant une surdité de transmission associée ou non à un écoulement persistant, la TDM est l'examen d'imagerie de première intention. Cependant, elle n'est réalisée qu'après un examen ORL complet comprenant otoscopie et audiogramme ; l'aspect du tympan n'est pas correctement évaluable en TDM. L'examen clinique permet de différencier une surdité de transmission à tympan altéré (rétracté, perforé) d'une surdité de transmission à tympan normal.
Si, cliniquement, le tympan est anormal, on s'oriente le plus souvent vers une otite chronique, cholestéatomateuse (le tympan est le siège d'une perforation marginale et la cavité est colonisée par une masse de nature épidermique) ou non cholestéatomateuse (pas de perforation tympanique ou perforation non marginale, calcifications, etc.). La TDM permet de confirmer le diagnostic d'otite cholestéatomateuse ou d'otite non cholestéatomateuse (otite séromuqueuse, otite fibro-adhésive, tympanosclérose, etc.), et fait le bilan des destructions osseuses et ossiculaires avant un éventuel traitement chirurgical.
Si, cliniquement, le tympan est normal, la TDM permettra de rechercher une éventuelle malformation, des anomalies de la chaîne ossiculaire (malformations, traumatismes, etc.) ou une déminéralisation de l'os labyrinthique en avant de la platine du stapes dans le cadre d'une otospongiose.
L'IRM a des indications plus limitées dans l'exploration des cavités de l'oreille externe et moyenne (notamment bilan d'extension des processus tumoraux de voisinage). Elle est utile pour rechercher une récidive de cholestéatome après une chirurgie.
Oreille interne
L'oreille interne est incluse dans le labyrinthe osseux, dont les contours sont analysables à la TDM (voir figures 24.1 et 24.2).
La TDM est principalement indiquée pour analyser la morphologie du labyrinthe osseux : malformations, extension locale d'une tumeur, déminéralisation dans le cadre d'une otospongiose.
L'IRM permet d'analyser le contenu liquidien du labyrinthe (périlymphe et endolymphe), qui est en hypersignal en pondération T2, comme le LCS. Baignant dans ces milieux liquidiens, certaines structures neurosensorielles labyrinthiques et les nerfs du méat acoustique interne sont visibles en IRM (voir figure 24.3). Les voies auditives et vestibulaires du tronc cérébral et du cervelet sont également explorées en IRM.
L'IRM est l'examen de choix pour explorer des symptômes cochléovestibulaires (surdité de perception, acouphènes, vertiges) afin d'éliminer un neurinome du nerf vestibulocochléaire (VIII) (figure 24.5) et pour vérifier le signal des liquides de l'oreille interne (modifié en cas de labyrinthite). D'autres affections des voies auditives et vestibulaires, dans le cadre par exemple de maladies démyélinisantes, sont également recherchées.
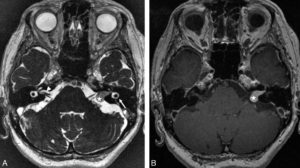
Surdité gauche révélant un schwannome (ou neurinome) du nerf vestibulocochléaire.
A. L'IRM des méats acoustiques internes en séquence pondérée T2 haute résolution permet de visualiser le « paquet » acousticofacial droit cheminant dans le méat acoustique interne et moulé par le LCS (tête de flèche), alors qu'à gauche le méat acoustique interne est comblé par une masse (étoile). Cette séquence permet aussi la visualisation des liquides de l'oreille interne, dont le signal est abaissé (plus gris) à gauche par le neurinome obstructif (flèche). B. Après injection de gadolinium sur une séquence pondérée T1, le schwannome se rehausse fortement (étoile).
Traumatismes du rocher
Les traits de fracture peuvent atteindre toutes les cavités de l'oreille.
La TDM des rochers est réalisée en complément de la TDM cérébrale en présence de signes d'alerte (otorragie, surdité, paralysie faciale) après un traumatisme crânien sévère. Elle permet de localiser le trait de fracture et de classifier les fractures selon leur trajet et les régions atteintes (une atteinte de l'oreille interne est de moins bon pronostic). Elle permet aussi de rechercher une luxation ossiculaire, une atteinte du ganglion géniculé du nerf facial ; en cas de paralysie faciale, une incarcération du nerf facial nécessite une décompression chirurgicale en urgence (figure 24.6).
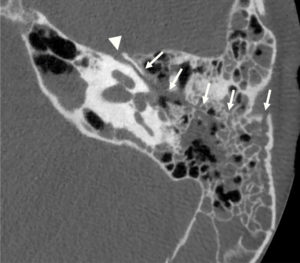
Fracture longitudinale du rocher gauche passant par la loge du ganglion géniculé avec paralysie faciale immédiate post-traumatique.
CBCT en coupes axiale du rocher gauche : trait de fracture (flèches) de l'écaille du temporal passant par le ganglion géniculé (tête de flèche).
La TDM est également indiquée devant un accès vertigineux survenant après un traumatisme, même mineur (gifle, effort de mouchage), pour rechercher une fistule périlymphatique.
Pathologie du nerf facial dans son trajet intrapétreux
Le trajet du nerf facial dans l'os temporal est composé de trois segments (labyrinthique, tympanique et mastoïdien). Il est analysable en TDM (qui visualise la paroi osseuse du canal facial) et en IRM. La paralysie faciale périphérique est le plus souvent idiopathique (a frigore) ; elle apparaît rapidement (en moins de 72 heures) et régresse spontanément dans les 3 mois. L'imagerie est indiquée si la paralysie faciale survient après un traumatisme ou si la présentation clinique est atypique (installation progressive ou association avec d'autres atteintes de nerfs crâniens, évolution défavorable), à la recherche d'une cause tumorale ou infectieuse.
Imagerie cervicofaciale non oncologique
Fosses nasales et sinus paranasaux
Les cavités sinusiennes de la face sont étudiées en première intention en CBCT avec un filtre osseux, incluant les apex des dents maxillaires (figure 24.7 et 24.8). Une sinusite aiguë simple ne nécessite pas d'imagerie : l'imagerie est envisagée en cas de dysfonctionnement nasonosinusien chronique (persistant plus de 3 mois) ou de complication d'une sinusite aiguë, parmi lesquelles notamment les complications orbitaires ou encéphaliques d'une ethmoïdite (figure 24.9).
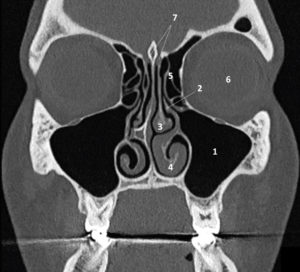
TDM d'un massif facial normal en coupe coronale et en fenêtre osseuse.
1. Sinus maxillaire ; 2. méat moyen ; 3. cornet moyen ; 4. cornet inférieur ; 5. cellule ethmoïdale ; 6. orbite ; 7. gouttière olfactive (dans laquelle est localisé le bulbe olfactif).
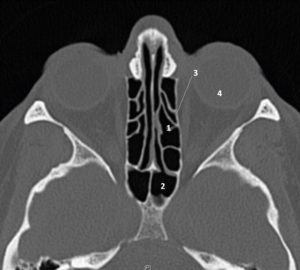
TDM d'un massif facial normal en coupe axiale.
1. Cellule ethmoïdale ; 2. sinus sphénoïdal ; 3. lame papyracée ; 4. orbite.
Ethmoïdite droite compliquée d'un abcès sous-périosté extraconal de l'orbite chez un enfant de 12 ans.
A. La TDM du massif facial en fenêtre osseuse met en évidence le comblement bilatéral des cellules ethmoïdales (étoiles). B. La TDM après injection en fenêtre tissus mous révèle une collection abcédée sous-périostée intra-orbitaire, mais extraconale (flèches) – c'est-à-dire située en dehors du cône musculaire de l'orbite – contenant une bulle de gaz (tête de flèche). À noter que la graisse orbitaire intraconale est légèrement infiltrée (plus blanche).
En cas d'obstruction nasale et/ou de sinusite chronique résistante à un traitement médical bien conduit (antibiotiques et corticoïdes) et après consultation ORL et endoscopie nasale, un CBCT est indiqué. Les principales causes sont la polypose nasosinusienne et la sinusite maxillaire « plus » avec obstruction du méat moyen par une pyocèle, un polype solitaire, un papillome inversé ou un aspergillome (moyen mnémotechnique « PPPA » pour Pyocèle, Polype solitaire, Papillome inversé, Aspergillome).
L'infection d'origine dentaire est la cause la plus fréquente de la sinusite antérieure ; elle doit être recherchée par CBCT dentosinusien (cone beam ou tomographie X à faisceau conique) en première intention (imagerie 7 fois moins irradiante et avec une meilleure définition que la TDM conventionnelle).
L'IRM de la face est un examen de seconde intention (pathologie infectieuse compliquée, mycotique ou tumorale des sinus de la face) dans le cadre des bilans d'extension et de la surveillance post-thérapeutique, en complément du CBCT ou de la TDM.
Traumatismes du massif facial
Les radiographies standard du massif facial ont une faible sensibilité et ne doivent plus être réalisées en cas de traumatisme, exception faite d'un traumatisme nasal isolé.
La TDM de l'ensemble du massif facial couvrant la mandibule permet une analyse fine, complète et en trois dimensions des fractures du massif facial.
Elle permet de classer les fractures selon la classification de Lefort et conforte le diagnostic de certaines urgences thérapeutiques : fracture du canal optique, du plancher de l'orbite avec incarcération musculaire (figure 24.10), complications endocrâniennes, brèche ostéoméningée.
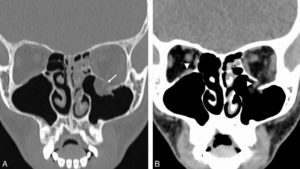
Traumatisme contondant de l'orbite avec déficit de l'élévation du regard : fracture du plancher de l'orbite gauche par enfoncement (blow-in), avec incarcération du muscle droit inférieur au sein du foyer fracturaire.
A. La TDM du massif facial en fenêtre osseuse met en évidence le trait de fracture du plancher de l'orbite (flèche). B. La fenêtre tissus mous met en évidence le muscle droit inférieur incarcéré dans le foyer de fracture à gauche, à comparer au côté droit normal (têtes de flèche).
Elle peut objectiver une fracture de la mandibule (les fractures ouvertes des portions dentées de la mandibule doivent être traitées en urgence) et/ou de l'articulation temporomandibulaire.
Des reconstructions dans les trois plans de l'espace et en rendu volumique permettent la planification chirurgicale.
Glandes salivaires
Les glandes salivaires sont explorées en échographie en première intention. En cas de tuméfaction d'une glande salivaire, l'échographie permet d'identifier s'il existe un calcul bloquant l'écoulement de la salive. Si l'obstacle n'est pas certain en échographie ou si une tumeur des glandes salivaires est suspectée, une IRM est réalisée. La séquence de sialo-IRM est une séquence à fort contraste liquidien, en haute résolution, montrant les canaux intraglandulaires normaux ou dilatés. Cette séquence est indiquée dans la pathologie obstructive ou inflammatoire comme une excellente alternative non invasive à la sialographie (opacification par cathétérisme des canaux salivaires). Les séquences morphologiques classiques (écho de spin T1, T2, post-gadolinium) et fonctionnelles (imagerie de perfusion et de diffusion) sont utiles au diagnostic de nature et d'extension des lésions tumorales salivaires.
La scintigraphie des glandes salivaires peut conforter le diagnostic d'hyposialie par analyse dynamique de sécrétion du médicament radiopharmaceutique (MRP).
Pathologie non tumorale des voies aérodigestives supérieures (VADS)
La filière viscérale pharyngolaryngée ainsi que les vaisseaux et nœuds lymphatiques du cou sont étudiés en TDM avec un filtre adapté aux parties molles.
Une TDM avec injection de produit de contraste est utile en cas de suspicion d'abcès cervical profond ou devant des signes de cellulite extensive. L'imagerie permet de rechercher le site de l'infection et ses limites anatomiques pour guider le drainage chirurgical.
En cas de cellulite cervicale extensive, une TDM thoracique complémentaire est indiquée pour rechercher une médiastinite associée (en raison d'une communication anatomique entre les espaces cervicaux rétropharyngés et le médiastin).
Thyroïde
La thyroïde est explorée par échographie en première intention, pour caractériser un nodule ou rechercher des signes de thyroïdite (voir chapitre 30).
Imagerie morphologique des cancers des VADS
Techniques
L'imagerie oncologique des VADS repose en première intention sur la TDM avec injection de produit de contraste. Certaines manœuvres sont utilisées pour sensibiliser l'examen, comme la phonation (étude de l'étage glottique, figure 24.11) ou la manœuvre de Valsalva, qui consiste à prendre une grande inspiration tout en se bouchant le nez et en fermant la bouche pour empêcher l'air de sortir et obtenir une augmentation de la pression dans les VADS (étude du laryngopharynx, figure 24.12).
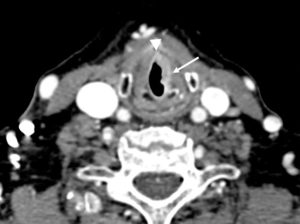
Carcinome de la corde vocale gauche.
TDM injectée en coupe axiale centrée sur l'étage glottique. Épaississement tumoral irrégulier rehaussé par le contraste de l'ensemble de la corde vocale gauche (flèche) avec extension à la commissure antérieure (tête de flèche).
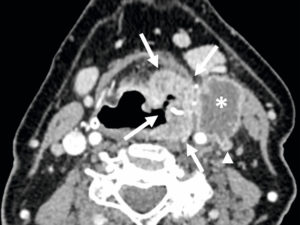
Carcinome épidermoïde du sinus piriforme gauche.
TDM injectée en coupe axiale centrée sur les sinus piriformes. Formation tumorale des parois du sinus piriforme gauche (flèches) rehaussée par le produit de contraste ; volumineuse adénopathie jugulocarotidienne homolatérale nécrotique en rupture capsulaire (étoile) englobant la veine jugulaire gauche thrombosée (tête de flèche).
L'étude de certaines régions anatomiques (cavité orale, oropharynx, nasopharynx) bénéficie particulièrement de l'excellente résolution en contraste de l'IRM (figure 24.13).
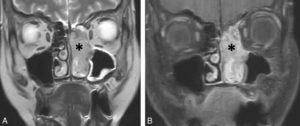
Adénocarcinome de l'ethmoïde gauche.
IRM en séquence coronales T2 (A) et T1 avec suppression de graisse après injection intraveineuse de gadolinium. B. Masse tumorale ethmoïdale gauche de signal tissulaire (étoiles) (hypo-intense T2 (A), globalement rehaussée après injection de gadolinium (B).
Indications
L'imagerie cervicofaciale par TDM et, éventuellement, par IRM permet de préciser l'extension locale d'une tumeur ORL (stade « T » de la classification tumour, node, metastasis [TNM]), de rechercher des contre-indications opératoires (envahissement circonférentiel de l'axe carotidien, envahissement osseux de la base du crâne ou intracrânien), d'évaluer l'extension lymphatique cervicale (figure 24.14).
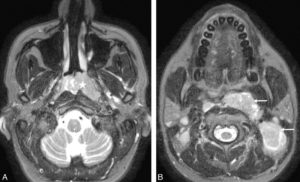
Bilan d'extension d'une tumeur du nasopharynx.
A. L'IRM à l'étage des fosses nasales montre une masse du nasopharynx (étoile) infiltrant à gauche les espaces parapharyngés et les muscles prévertébraux. B. À l'étage oropharyngé, on met en évidence de volumineuses adénopathies latérocervicales et rétropharyngées (flèches).
L'imagerie post-thérapeutique, réalisée entre 3 et 6 mois, permet la recherche d'un reliquat tumoral et sert de référence pour le suivi ultérieur. En cas de suspicion clinique de récidive, une TDM et/ou une IRM sont réalisées.
L'IRM de l'oropharynx et du nasopharynx est également indiquée, en complément de la TDM, dans le bilan d'une adénopathie cervicale sans primitif connu, à la recherche d'une petite lésion nasopharyngée, amygdalienne ou basilinguale. Dans le cadre des tumeurs du nasopharynx et des espaces profonds de la face, la TDM et l'IRM sont complémentaires. La fixité de ces régions, non soumises aux artefacts respiratoires, et l'excellente résolution en contraste et spatiale de l'IRM en font l'examen le plus adapté pour rechercher les extensions profondes et à la base du crâne.
Imagerie moléculaire des cancers des VADS : TEP au 18F-FDG
Généralités
La cellule de carcinome épidermoïde (95 % des cancers des VADS) est particulièrement hypermétabolique, ce qui fait de la TEP au 18F-FDG un examen de choix pour la caractérisation de ces tumeurs.
Une hyperfixation du traceur est pathologique lorsqu'elle est visuellement d'intensité supérieure à celle du bruit de fond physiologique et qu'elle n'est pas en rapport avec une cause de faux positif (inflammation post-thérapeutique, infection active intercurrente, etc.).
Sa localisation anatomique (étage des VADS, aire lymphatique, etc.), sa latéralité (gauche/droite), son caractère focal ou diffus doivent être spécifiés.
La quantification de l'intensité de fixation tumorale par la SUV (standard uptake value) peut être utile pour évaluer le pronostic initial de la maladie et sert de référence pour l'évaluation de la réponse au traitement.
Indications
Les indications actuelles de la TEP au 18F-FDG en pathologie cancéreuse sont consultables dans les « Recommandations de bonne pratique clinique pour l'utilisation de la TEP en cancérologie » proposées par la Société française de médecine nucléaire (SFMN) en 2018 sous le label HAS-INCa, disponibles en ligne (https://www.sfmn.org/).
Quelle que soit l'indication, les performances diagnostiques de l'examen sont améliorées en cas d'injection de produit de contraste iodé de l'examen TDM couplé.
Bilan d'extension
La TEP au 18F-FDG est recommandée dans le bilan d'extension des carcinomes épidermoïdes de stades avancés III, IV (T3-4, N1-3) pour rechercher des métastases à distance et peut être proposée, quel que soit le stade, pour la recherche d'une localisation synchrone (figure 24.15), en particulier pulmonaire et œsophagienne (facteurs de risque communs).
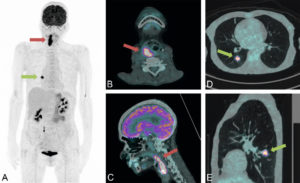
Bilan d'extension d'un carcinome épidermoïde du laryngopharynx droit.
Images TEP au 18F-FDG en reconstruction MIP (A) et fusionnées au TDM en coupes axiales (B en fenêtre tissus mous et D en fenêtre pulmonaire) et sagittales (C en fenêtre tissus mous et E en fenêtre pulmonaire). Hyperfixation très intense (SUVmax = 12,6) d'une lésion comblant le laryngopharynx droit et s'étendant localement à l'oropharynx sur 7 cm de hauteur (flèches rouges). Absence d'adénomégalies hyperfixantes associées suspectes. Hyperfixation intense (SUVmax = 9,4) d'un nodule pulmonaire centimétrique unique du segment apical du lobe inférieur droit (flèches vertes) sans adénopathie médiastino-hilaire associée. Conclusion : hypermétabolisme pathologique de la tumeur laryngopharyngée droite localement avancée. Absence d'arguments scintigraphiques en faveur d'une extension lymphatique cervicale. Foyer hypermétabolique significatif d'une opacité pulmonaire isolée du segment apical du lobe inférieur droit suggérant en premier lieu une tumeur synchrone.
Adénopathie métastatique sans porte d'entrée
La TEP au 18F-FDG est recommandée dans la recherche de tumeur primitive en cas d'adénopathie métastatique cervicale carcinomateuse sans cancer primitif connu (carcinoma of unknown primary [CUP]). Elle doit être réalisée de préférence avant les biopsies pharyngées exploratrices pour éviter le risque de faux positifs par inflammation et permet de détecter la tumeur primitive dans 30 à 50 % des cas selon les études.
Recherche de récidive et évaluation thérapeutique
La TEP au 18F-FDG est recommandée en cas de suspicion clinique de récidive et pour le bilan de stadification d'une récidive avérée.
Elle peut être proposée en fin de traitement pour l'évaluation thérapeutique à la recherche d'une maladie résiduelle avec un délai minimal de 3 mois à respecter.
Elle peut également être proposée dans la surveillance systématique pour la mise en évidence d'une récidive occulte, notamment dans un contexte de mauvais pronostic initial.
La valeur prédictive négative de l'examen est excellente (proche de 100 %) dans toutes ces indications.
Essentiel à retenir
- La modalité d'imagerie dépend de la structure anatomique étudiée : TDM en première intention pour l'oreille moyenne, TDM et IRM pour l'oreille interne, TDM ou cone beam en première intention pour le massif facial, TDM et, éventuellement, IRM pour les espaces viscéraux du cou.
- La majorité des atteintes inflammatoires aiguës de la sphère ORL ne requièrent pas d'imagerie, sauf devant une suspicion de complications (abcès, cellulite, complications neuro-ophtalmologiques), notamment dans les localisations anatomiques à risque (ethmoïdite, mastoïdite).
- La TDM est la modalité de choix en cas de traumatisme du massif facial ou du rocher.
- En oncologie ORL, l'imagerie morphologique repose en première intention sur la TDM cervicofaciale injectée, complétée par une TDM thoracique. L'IRM est utile dans certaines localisations anatomiques (oropharynx, nasopharynx) ou dans le cadre d'une adénopathie cervicale sans primitif.
- La TEP au 18F-FDG est recommandée dans le bilan d'extension des carcinomes des VADS pour rechercher des métastases à distance ou une localisation synchrone, dans le cadre d'une adénopathie cervicale métastatique sans porte d'entrée pour la recherche du site primitif ou en cas de récidive tumorale. Elle peut être proposée pour l'évaluation de fin de traitement ou dans la surveillance systématique.
 |
Chapitre suivant |
 |
Retour au sommaire |
Les fondamentaux - Chapitre 23 - Imagerie du système nerveux central
A. Chammas , S. Kremer et F. Le Jeune
Plan du chapitre
- Radioanatomie
- Techniques d'exploration neurologique en radiologie et en médecine nucléaire
- Sémiologie normale et éléments de sémiologie pathologique
- Séméiologie pathologique élémentaire en fonction des principaux syndromes
Objectifs
- Connaître les principales techniques d'imagerie utilisées dans l'exploration du système nerveux central.
- Savoir reconnaître les éléments d'anatomie radiologique cérébrale et médullaire.
- Connaître les éléments séméiologiques normaux en TDM et en IRM.
- Connaître les éléments séméiologiques pathologiques élémentaires (sang, œdème vasogénique autour d'une lésion tumorale, œdème cytotoxique en cas d'ischémie) en TDM et IRM.
- Connaître les mécanismes physiopathologiques explorés par la TEP et la scintigraphie dans les pathologies neurologiques.
- Connaître les principaux MRP et le déroulement des examens.
Radioanatomie
Les méthodes d'exploration du système nerveux central (SNC) en radiologie et en médecine nucléaire sont abordées dans ce chapitre. Elles sont morphologiques, mais également fonctionnelles et moléculaires. Les principales structures anatomiques à connaître en imagerie du SNC sont présentées dans les figures 23.1 à figure 23.11. Elles font l'objet d'une séméiologie spécifique dont les principes sont expliqués dans le chapitre.
Coupe sagittale médiane pondérée en T1 de l'encéphale.
Cerveau : 1. lobe frontal ; 2. lobe pariétal ; 3. lobe occipital ; 4. corps calleux. Tronc cérébral : 5. pédoncules cérébraux ; 6. pont ; 7. moelle allongée ; 8. moelle spinale ; 9. vermis cérébelleux ; 10. 3e ventricule ; 11. 4e ventricule ; 12. hypophyse. Tirets : extrémité du sillon central à la face interne du cerveau séparant le lobe frontal du lobe pariétal. La figure de gauche permet de repérer la position de la coupe sagittale sur une coupe axiale T2.
Coupe axiale pondérée en T2 de la fosse postérieure.
1. Pont ; 2. pédoncule cérébelleux ; 3. vermis cérébelleux ; 4. hémisphère cérébelleux ; 5. lobe occipital ; 6. 4e ventricule ; 7. espace sous-arachnoïdien de la base du crâne (ou citernes de la base) ; 8. oreille interne ; 9. artère basilaire. La figure de gauche permet de repérer la position de la coupe axiale sur une coupe sagittale T1.
Coupe axiale du cerveau pondérée en T1 avec injection de gadolinium (coupe de Flechsig).
1. Lobe frontal ; 2. lobe pariétal ; 3. lobe occipital. Ganglions de la base du crâne (noyaux gris centraux) : 4. noyau caudé ; 5. noyau lenticulaire ; 6. thalamus ; 7. capsule interne ; 8. ventricule latéral ; 9. scissure interhémisphérique ; 10. scissure frontopariétale (de Sylvius) ; 11. corps calleux. La figure de gauche permet de repérer la position de la coupe axiale sur une coupe sagittale T1.
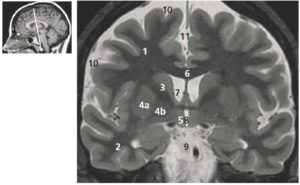
Coupe coronale (ou frontale) pondérée en T2 du cerveau (coupe de Charcot).
1. Lobe frontal ; 2. lobe temporal ; 3. noyau caudé ; 4. noyau lenticulaire (a : putamen, b : pallidum) ; 5. thalamus ; 6. corps calleux ; 7. ventricule latéral ; 8. 3e ventricule ; 9. espace sous-arachnoïdien de la base du crâne (citernes) ; 10. espaces sous-arachnoïdiens péricérébraux ; 11. scissure interhémisphérique. La figure de gauche permet de repérer la position de la coupe axiale sur une coupe sagittale T1.
Vue latérale de l'hémisphère gauche : le sillon central sépare le lobe frontal en avant du lobe pariétal en arrière.
Le cortex moteur primaire est situé en avant du sillon central (gyrus précentral). Les aires de Broca (gyrus frontal inférieur) et de Wernicke (gyrus temporal supérieur) sont situées dans l'hémisphère gauche.
Vue médiale de l'hémisphère gauche.
Dessin : Cyrille Martinet.
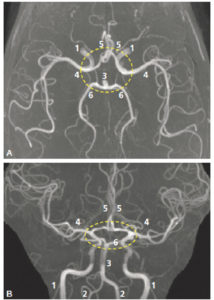
Angio-IRM par temps de vol (sans injection de produit de contraste) des artères de l'encéphale, reconstructions par projection des pixels d'intensité maximale.
Vues supérieure (A) et antérieure (B). 1. Artère carotide interne ; 2. artère vertébrale ; 3. artère basilaire ; 4. artère cérébrale moyenne (sylvienne) ; 5. artère cérébrale antérieure ; 6. artère cérébrale postérieure. Les pointillés entourent le cercle artériel du cerveau (polygone de Willis)
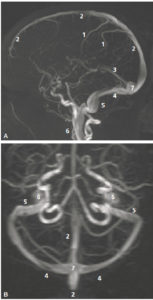
Angio-IRM par temps de vol (sans injection de produit de contraste) des veines de l'encéphale, reconstructions par projection des pixels d'intensité maximale.
Vues latérale (A) et supérieure (B). 1. Veine corticale ; 2. sinus sagittal (longitudinal) supérieur ; 3. sinus droit ; 4. sinus transverse (ou latéral) ; 5. sinus sigmoïde ; 6. veine jugulaire interne ; 7. torcular.
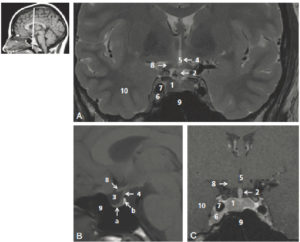
Coupes coronale pondérée en T2 (A), sagittale médiane pondérée en T1 (B) et coronale pondérée en T1 après injection de gadolinium (C) de l'hypophyse.
1. Hypophyse (a : lobe antérieur, b : lobe postérieur) ; 2. infundibulum (tige) hypophysaire ; 3. selle turcique ; 4. hypothalamus ; 5. 3e ventricule ; 6. sinus caverneux ; 7. carotide interne ; 8. chiasma optique (II) ; 9. sinus sphénoïdal ; 10. lobe temporal. La figure de gauche permet de repérer la position de la coupe coronale sur une coupe sagittale T1.
Coupe axiale pondérée en T2 de la colonne cervicale par le disque intervertébral C7-T1.
1. Disque intervertébral C7-T1 ; 2. lame ; 3. processus épineux ; 4. LCS ; 5. dure-mère ; 6. moelle spinale ; 7. foramen intervertébral ; 8. nerf spinal C8 ; 9. artère vertébrale. La figure de gauche permet de repérer la position de la coupe axiale sur une coupe sagittale T2.
Coupe axiale pondérée en T2 de la colonne lombaire en L3.
1. Corps vertébral de L3 ; 2. lame ; 3. processus épineux ; 4. LCS ; 5. racines de la queue de cheval ; 6. nerf spinal L3 ; 7. foramen intervertébral L3-L4 ; 8. muscles rétrovertébraux. La figure de gauche permet de repérer la position de la coupe axiale sur une coupe sagittale T2.
Techniques d'exploration neurologique en radiologie et en médecine nucléaire
Explorations neurologiques en radiologie
La neuroradiologie étudie les affections des systèmes nerveux central (SNC) et périphérique (SNP). En fonction des habitudes locales, l'imagerie oto-rhino-laryngologique (ORL) (voir chapitre 24) est réalisée en neuroradiologie, ou en radiologie générale. La neuroradiologie se partage entre la neuroradiologie diagnostique et la neuroradiologie interventionnelle.
Neuroradiologie diagnostique
La neuroradiologie diagnostique est fondée sur l'imagerie en coupes par TDM, ou par IRM.
La TDM est un examen facilement accessible, car de nombreux services d'urgences médicales et chirurgicales sont adossés en France à un service d'imagerie équipé d'une TDM. L'acquisition en TDM est rapide, réalisée en moins de 30 secondes pour l'exploration de l'encéphale ou du rachis. La TDM utilise les rayonnements ionisants et sa résolution en contraste est relativement faible. Son principal avantage est de permettre à la fois l'étude des structures osseuses de la voûte et de la base du crâne, des structures parenchymateuses intracérébrales et des espaces péricérébraux. La TDM a également l'avantage d'étudier les lésions thoraciques et abdominopelviennes dans le même temps d'examen en cas de polytraumatisme.
Ses principales indications sont donc les urgences traumatiques, mais également l'étude des structures osseuses (crâne, rachis).
L'IRM est plus difficile à mettre en œuvre, principalement en raison de son accès limité. En effet, en France, le nombre de machines d'IRM installées est nettement inférieur à celui des TDM. La durée d'examen est plus longue qu'en TDM (environ 20 minutes pour une IRM cérébrale). C'est un examen non irradiant et sa résolution en contraste est élevée.
Ses principales indications sont les affections médicales neurologiques, les suspicions de compression médullaire et les bilans préthérapeutiques des tumeurs cérébrales.
Neuroradiologie interventionnelle
La neuroradiologie interventionnelle (ou thérapeutique) comporte le traitement endovasculaire des malformations vasculaires (malformations artérioveineuses, anévrismes) en angiographie conventionnelle (voir chapitre 15) et le traitement de certaines affections rachidiennes comme les tassements vertébraux sous contrôle TDM ou en radiologie conventionnelle.
L'angiographie par cathétérisme est un examen invasif qui nécessite la ponction d'une artère périphérique (fémorale ou humérale) et expose aux rayonnements ionisants. Les rayons X permettent de suivre la progression du cathéter (radio-opaque) lors de la navigation endovasculaire et de visualiser les lésions vasculaires à traiter. Pour cela, on injecte par le cathéter en intra-artériel un produit de contraste iodé. L'angiographie par cathétérisme n'est pratiquement plus utilisée pour le diagnostic, car elle a été remplacée par les techniques d'imagerie en coupes (angio-TDM, angio-IRM). Elle est donc quasi exclusivement utilisée en neuroradiologie interventionnelle.
La neuroradiologie interventionnelle partage avec la neurochirurgie les indications de traitement des malformations vasculaires, en particulier les anévrismes (figure 23.12).
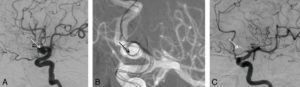
Angiographie conventionnelle par cathétérisme : opacification de l'artère carotide par injection d'iode montrant un anévrisme de l'artère cérébrale antérieure gauche.
A. Mise en évidence de l'anévrisme avant embolisation (flèche blanche). B. Pendant la mise en place par voie endovasculaire des coils au sein de l'anévrisme (flèche noire). C. Après embolisation, seul le paquet de coils est visible, l'anévrisme n'est plus opacifié par l'injection d'iode ; il est donc exclu de la circulation artérielle (flèche blanche).
Explorations neurologiques en médecine nucléaire
L'étude scintigraphique des pathologies neurologiques bénéficie des explorations par tomoscintigraphie (TEMP) ou par TEP ; les deux examens sont couplés à une TDM. Il s'agit d'une imagerie fondée sur des acquisitions volumiques qui permettent d'avoir un reflet de la distribution d'un radiopharmaceutique (MRP) en 3D dans le cerveau et de reconstruire des coupes dans tous les plans de l'espace. Les premières utilisent des MRP émetteurs gamma comme le 99mTc ou l'iode 123, et les secondes des MRP émetteurs de positons comme le 18FDG. Selon le MRP injecté, on obtiendra des informations fonctionnelles (perfusion, métabolisme, etc.) ou moléculaires (expression d'un récepteur ou d'un transporteur, etc.) sur le cerveau. Ces informations sont le plus souvent complémentaires des informations obtenues avec la TDM, et plus encore l'IRM. Dans de nombreuses maladies, l'étude combinée des deux examens est nécessaire au bilan et seule la fusion des images de médecine nucléaire et d'IRM permet d'avancer dans le diagnostic. Cette approche « multimodale » est particulièrement importante pour les explorations neurologiques et elle s'intègre dans le cadre d'un bilan multidisciplinaire.
Mécanismes physiopathologiques explorés par la TEP et la scintigraphie dans les maladies neurologiques
Il existe plusieurs MRP disponibles en routine dans les services de médecine nucléaire qui permettent d'explorer différents mécanismes physiopathologiques au niveau cérébral :
- la perfusion cérébrale globale (débit sanguin cérébral) ;
- le métabolisme glucidique ;
- le versant présynaptique de la synapse dopaminergique ;
- le dépôt des plaques amyloïdes.
Les MRP utilisés pour l'étude de ces mécanismes traversent la barrière hémato-encéphalique normale, contrairement aux produits de contraste dont le passage est le reflet de la rupture de cette barrière.
Principaux MRP et déroulement des examens
Étude de la perfusion et du métabolisme glucidique
Le débit sanguin cérébral et la consommation de glucose sont corrélés à l'activité neuronale. L'imagerie de perfusion ou du métabolisme permet donc de détecter des modifications fonctionnelles locales dues à une perte synaptique ou à un dysfonctionnement synaptique. Le métabolisme neuronal et le débit sanguin sont étroitement couplés dans le temps et dans l'espace dans les maladies neurodégénératives. Le débit sanguin cérébral local est le reflet de la demande énergétique locale et donc de la densité de neurones présents. Il existe ainsi ce qu'on appelle un couplage métabolique-perfusionnel et les deux examens mettent en évidence des anomalies identiques.
La perfusion cérébrale est étudiée après injection intraveineuse d'un MRP marqué au 99mTc comme l'HMPAO, une petite molécule lipophile diffusant facilement à travers la barrière hémato-encéphalique, piégée au niveau cérébral après avoir été transformée en molécule hydrophile. Son avantage majeur est qu'elle reflète la perfusion cérébrale au moment de l'injection puisque sa captation débute 10 à 15 secondes après l'injection. Il n'y a pas de contrainte à la réalisation de cet examen ; le patient ne doit pas être à jeun et peut avoir pris ses médicaments. Un repos neurosensoriel est nécessaire pendant 15 à 30 minutes avant l'injection.
L'acquisition tomoscintigraphique débute environ 20 à 30 minutes après l'injection et dure environ 20 minutes.
L'étude du métabolisme cérébral se fait en TEP après injection de 18F-FDG. La TEP au 18F-FDG permet d'étudier la consommation importante de glucose par le cerveau normal. Après un repos neurosensoriel de 15 minutes, l'injection du traceur se fait par voie intraveineuse et l'acquisition débute environ 30 minutes après l'injection, quand le plateau de fixation est atteint. La durée d'acquisition est de 10 à 20 minutes selon les protocoles.
Étude de la neurotransmission dopaminergique présynaptique
La synapse est constituée de trois parties : un versant présynaptique, la fente synaptique et le versant postsynaptique.
La dopamine est un neurotransmetteur appartenant à la famille des catécholamines. Au niveau cérébral, la dopamine joue un rôle important et complexe, et intervient dans diverses fonctions telles que les fonctions motrices, la cognition, la motivation, les phénomènes de récompense, la mémoire et le sommeil. En imagerie métabolique, c'est surtout sa fonction motrice que l'on va étudier.
La synapse dopaminergique a été très étudiée en médecine nucléaire avec le développement de nombreux MRP au niveau pré- ou postsynaptique dont deux permettent aujourd'hui d'étudier le versant présynaptique : le FP-CIT marqué à l'iode 123 (DatSCAN®) en scintigraphie et la fluorodopa (18F-DOPA) en TEP. Le versant postsynaptique n'est pas étudié en routine.
Le DatSCAN® est un substrat du transporteur présynaptique de la dopamine. L'acquisition débute généralement 3 à 6 heures après l'injection et dure environ 30 minutes. Il n'est pas nécessaire d'arrêter les traitements antiparkinsoniens, agonistes ou antagonistes, puisque ceux-ci agissent au niveau postsynaptique.
La 18F-DOPA est un marqueur de la synthèse de la dopamine et donc également un traceur du versant présynaptique de la synapse dopaminergique. Il est nécessaire d'arrêter les traitements antiparkinsoniens 12 heures avant l'examen. Les acquisitions débutent 90 minutes après l'injection et durent entre 10 et 20 minutes.
Sémiologie normale et éléments de sémiologie pathologique
TDM cérébrale
La substance blanche paraît moins dense (ou plus noire) que la substance grise (cortex et noyaux gris centraux). Le liquide cérébrospinal (LCS) paraît hypodense, alors que les structures osseuses (crâne, rachis) sont hyperdenses (figure 23.13).
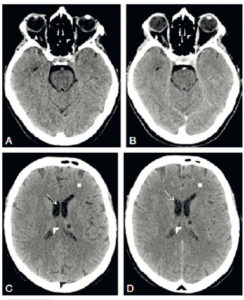
TDM cérébrale sans (A, C) et après injection (B, D) : la substance blanche (croix blanche) est moins dense que la substance grise intrathalamique (croix noire).
Le LCS (flèche blanche) est hypodense. Après injection, les vaisseaux et les plexus choroïdes sont plus hyperdenses que sur la TDM sans injection (têtes de flèche noires). La graisse intra-orbitaire est hypodense (triangles blancs). L'air au sein des cellules ethmoïdales est hypodense (têtes de flèche blanches).
L'eau, l'air et la graisse sont hypodenses (figure 23.14) ; les calcifications et le sang frais sont hyperdenses (figure 23.15).
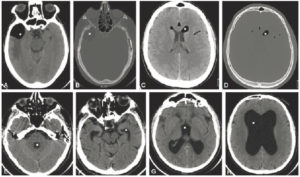
TDM cérébrale sans injection : hypodensités (étoiles).
A, B. Tumeur graisseuse extra-axiale temporale droite (méningiome lipomateux) (graisse). C, D. Pneumencéphalie suite à une fracture de la base du crâne (air). E-H. Hydrocéphalie à pression normale responsable d'une dilatation ventriculaire (liquide).
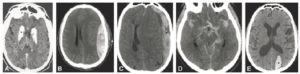
TDM cérébrales sans injection : hyperdensités spontanées intracrâniennes (croix noires).
A. Calcifications des ganglions de la base du crâne. B. Hématome extradural. C. Hématome sous-dural aigu. D. Hémorragie sous-arachnoïdienne. E. Hématome intraparenchymateux.
Après une acquisition sans injection, une injection intraveineuse de produit de contraste iodé peut être réalisée afin de rechercher des anomalies de rehaussement des vaisseaux ou des prises de contraste tissulaires (méninges, tumeur). Lorsqu'une structure est rehaussée, cela se traduit par une augmentation de la densité (ou hyperdensité) par rapport à la TDM réalisée sans injection. En pratique, on reconnaît le caractère injecté de la TDM par l'augmentation de la densité au sein des artères et des veines ainsi que des plexus choroïdes par rapport à la TDM sans injection (voir figure 23.13).
IRM cérébrale
Les séquences pondérées en T1 sont dites anatomiques. La substance blanche apparaît en hypersignal (plus blanche) que la substance grise, alors que la substance grise (cortex et ganglions de la base) apparaît en hyposignal. Le LCS est en hyposignal (figure 23.16).
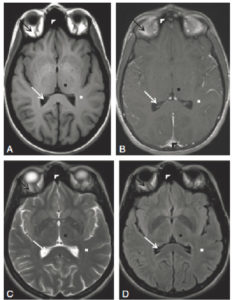
IRM cérébrale en pondération T1 (A), T1 après injection de gadolinium (B), T2 (C), et FLAIR (D).
La substance blanche est en hypersignal T1 en hyposignal T2 et FLAIR (croix blanche). La substance grise thalamique est en hyposignal T1, en hypersignal T2 et FLAIR (croix noire). Le LCS intraventriculaire est en hyposignal T1, en hypersignal T2 et en hyposignal FLAIR (flèche blanche). La graisse intraorbitaire est en hypersignal T1, T2 et FLAIR (flèche noire). L'air est en hyposignal T1, T2 et FLAIR (tête de flèche blanche). Après injection de gadolinium, les structures vasculaires apparaissent plus hyperintenses qu'avant injection (tête de flèche noire).
Si l'on cherche une prise de contraste (au niveau des méninges, d'une tumeur bénigne ou maligne, ou d'une lésion inflammatoire), on réalise une séquence en pondération T1 après injection intraveineuse de gadolinium. Les prises de contraste vont se traduire par une augmentation de l'intensité du signal (plus blanche) par rapport au T1 réalisé sans injection. Comme en TDM, on reconnaît le caractère injecté d'une image pondérée en T1 par l'augmentation du signal au sein des artères et des veines du fait de la présence intraveineuse de gadolinium (voir figure 23.16). Il est important de noter que le tissu cérébral normal n'est pas rehaussé après injection de produit de contraste car ce dernier ne traverse pas la barrière hémato-encéphalique quand celle-ci est normale.
Pour visualiser les vaisseaux, il n'est pas toujours nécessaire d'injecter du produit de contraste, contrairement à la TDM. En effet, les séquences angiographiques sans injection (ou acquisitions par temps de vol ou TOF pour Time Of Flight) permettent de reconstruire les vaisseaux en analysant les flux en leur sein. Elles sont le plus souvent suffisantes pour analyser les artères du cercle artériel du cerveau (ou polygone de Willis) et les sinus veineux cérébraux. Le T2 est presque l'inverse d'un T1 : la substance blanche est en hyposignal par rapport à la substance grise (cortex et ganglions de la base ou noyaux gris centraux) et le LCS est en hypersignal (voir figure 23.16). La graisse est en hypersignal en T1 et de signal variable en T2, et l'air et l'os sont noirs en T1 comme en T2.
La séquence FLAIR est une séquence pondérée en T2 sur laquelle le signal des liquides a été annulé. Comme sur une séquence T2, la substance blanche est toujours en hyposignal par rapport à la grise alors que la substance grise (cortex et noyaux gris centraux) paraît plus en hypersignal que la substance blanche. Le LCS apparaît en hyposignal (voir figure 23.16).
Une structure anormale en IRM est décrite selon la terminologie suivante : une structure en hyposignal ou hypo-intensité est de signal ou d'intensité inférieur(e) au parenchyme cérébral normal. Une structure en hypersignal ou hyperintensité est de signal ou d'intensité supérieur(e) au parenchyme cérébral normal. Une structure en isosignal ou iso-intensité est de signal ou d'intensité similaire au parenchyme cérébral normal.
En cas d'hématome, le signal du sang varie en fonction du degré de dégradation de l'hémoglobine (figure 23.17) (voir chapitre 21).
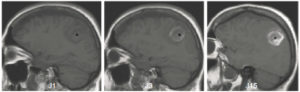
IRM cérébrales en pondération T1 sans injection : évolution du signal au cours du temps d'un hématome intraparenchymateux (croix noire) de l'isosignal vers l'hypersignal de J1 à J15.
IRM hypophysaire
L'hypophyse est explorée uniquement en IRM et par des coupes fines en T1 avant et après injection de gadolinium et en T2 (voir figure 23.9).
L'antéhypophyse est en isosignal T1 et T2 alors que la posthypophyse présente généralement un hypersignal T1 spontané lié au stockage de l'hormone antidiurétique.
Après injection de produit de contraste, l'antéhypophyse saine se rehausse de manière homogène du fait de l'absence de barrière hémato-encéphalique, ce qui permet le passage interstitiel du produit de contraste.
IRM médullaire
La moelle spinale, de petit diamètre, est uniquement explorée en IRM qui offre un meilleur contraste que la TDM (voir figure 23.10). La moelle spinale présente le même signal que le cerveau. En revanche, la substance grise est centrale et prend une forme de H, alors que la substance blanche est périphérique.
Médecine nucléaire
En scintigraphie de perfusion ou en TEP au 18F-FDG, une image normale est caractérisée par une fixation homogène et symétrique du MRP sur l'ensemble du cortex et des ganglions de la base (figure 23.18A). Les images anormales mettent en évidence une hypoperfusion ou un hypométabolisme dans les régions où il existe un dysfonctionnement neuronal ou une perte neuronale (figure 23.18B).
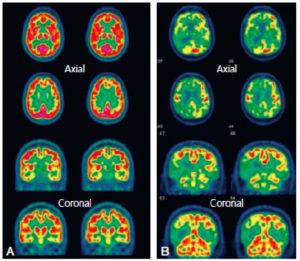
TEP au 18F-FDG.
A. Images normales : la fixation du traceur est intense et homogène, symétrique sur l'ensemble du parenchyme cortical et sous-cortical, apparaissant en rouge uniforme sur cette échelle de couleur communément utilisée. B. Images anormales : la fixation du traceur est diminuée sur l'ensemble du cortex (aspect en jaune) avec des régions cérébrales où l'examen met en évidence un hypométabolisme (aspect en vert) temporopariétal bilatéral et frontal droit. En fonction du contexte, cet aspect peut se rencontrer dans la démence de type Alzheimer. Attention, cet examen rentre dans le cadre d'un bilan spécialisé multidisciplinaire. Il faut toujours interpréter un examen d'imagerie métabolique de façon complémentaire aux données cliniques, neuropsychologiques et d'IRM.
En DatSCAN® ou 18F-DOPA, les images normales montrent une fixation homogène du striatum (noyaux caudés et putamens), sous forme de deux aires symétriques en forme de croissant d'égale intensité (figure 23.19A).
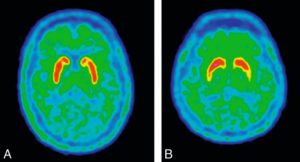
Coupes axiales de TEP à la 18F-DOPA.
A. Image normale : la fixation du traceur s'effectue au niveau des striatum, structures profondes sous-corticales ; la fixation est homogène et symétrique en avant sur les noyaux caudés et en arrière sur les putamens. B. Image anormale : la fixation est diminuée au niveau du putamen gauche avec un aspect aminci et jaune sur l'échelle de couleur utilisée. Le patient présente donc une dénervation dopaminergique présynaptique du putamen gauche en rapport avec un syndrome parkinsonien clinique à droite.
Séméiologie pathologique élémentaire en fonction des principaux syndromes
Tumeurs cérébrales
Une tumeur cérébrale (figure 23.20), du fait de l'augmentation de l'eau libre comme dans les métastases, paraît généralement hypodense en TDM et en hyposignal T1, en hypersignal T2 et FLAIR en IRM. La présence d'une néoangiogenèse et celle d'une rupture de la barrière hémato-encéphalique sont identifiées par une prise de contraste. Les tumeurs très cellulaires (par exemple le lymphome) restreignent la diffusion de l'eau libre ; elles sont en hypersignal en séquence de diffusion et en hyposignal sur la cartographie d'ADC. Les lésions tumorales cérébrales sont souvent entourées d'un œdème vasogénique apparaissant hypodense en TDM, en hyposignal T1, et en hypersignal T2 et FLAIR en IRM. Cet œdème est en plage, mal limité, et atteint préférentiellement la substance blanche, contrairement à l'œdème ischémique, cytotoxique.
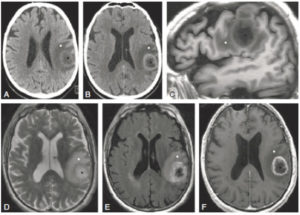
TDM cérébrale sans (A) et avec injection (B) ; IRM cérébrale en T1 sans injection (C), en T2 (D), en FLAIR (E) et T1 après injection de gadolinium (F).
Lésion tumorale intraparenchymateuse (croix noire), hypodense en TDM (A), en hyposignal T1 (C), en hypersignal T2 (D) et FLAIR (E), et rehaussée en périphérie après injection en TDM (B) et en IRM (F). La lésion est entourée d'œdème vasogénique (croix blanche) hypodense en TDM, en hyposignal T1 et en hypersignal T2 et FLAIR en IRM.
Comme les tumeurs cérébrales surexpriment généralement les transporteurs du glucose, la TEP au 18F-FDG peut également être utilisée dans certaines indications des bilans de tumeurs cérébrales, en particulier la recherche de récidive d'une tumeur de haut grade. Dans ce cas, il existe en TEP au 18F-FDG un hypermétabolisme intense lié à l'augmentation de la captation du glucose par les cellules tumorales (mécanisme différent de celui des pathologies neurodégénératives) (figure 23.21).
Coupes transversale, sagittale et coronale de TEP au 18F-FDG fusionnée avec l'IRM dans le cadre d'une suspicion de récidive d'un glioblastome occipital gauche, opéré il y a 10 mois.
Foyer hypermétabolique anormal à la partie postéro-inférieure de la prise de contraste en IRM compatible avec une récidive de haut grade comme la tumeur initiale.
La lésion tumorale et l'œdème qui l'entoure occupent de l'espace au sein du parenchyme cérébral, dans le volume non extensible qu'est la boîte crânienne. La lésion et l'œdème sont responsables d'un effet de masse, c'est-à-dire un refoulement des structures anatomiques adjacentes. Cet effet de masse peut aboutir à un engagement (figure 23.22), c'est-à-dire le refoulement de structures cérébrales à travers des orifices intracrâniens physiologiques généralement délimités par la dure-mère. On peut ainsi distinguer l'engagement sous-falcoriel, qui correspond au passage des structures de la ligne médiane sous la faux du cerveau, l'engagement temporal qui correspond à une hernie des structures temporales internes entre la tente du cervelet et le tronc cérébral, et l'engagement amygdalien qui correspond au passage des amygdales cérébelleuses au travers du foramen magnum (figures 23.23 et 23.24).
Différents types d'engagement cérébral dans un contexte d'hématome extradural temporo-pariétal droit.
1. Tente du cervelet ; 2. engagement temporal ; 3. fracture temporopariétale droite et hématome extradural droit ; 4. déviation de la faux du cerveau vers la gauche et engagement sous-falcoriel avec déviation du 3e ventricule ; 5. compression du pédoncule cérébral droit se traduisant par une hémiparésie gauche ; 6. engagement de l'amygdale cérébelleuse droite ; 7. compression du 3e nerf crânien se traduisant par un ptosis, un strabisme divergent et une mydriase homolatérale.
Source : Felten DL. Netter's Neuroscience Flash Cards. Fourth Edition. Elsevier ; 2015.
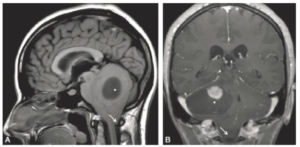
IRM cérébrale en coupe sagittale T1 sans injection (A) et coupe coronale T1 après injection de gadolinium.
Volumineuse lésion kystique cérébelleuse droite avec nodule mural prenant le contraste (astrocytome pilocytique) (croix blanche). Important effet de masse avec engagement bilatéral des amygdales cérébelleuses dans le foramen magnum (flèche blanche).
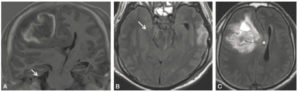
IRM cérébrale en coupe coronale en T1 (A) et en coupes axiales FLAIR (B, C).
Hématome intraparenchymateux responsable d'un engagement sous-falcoriel (croix blanche) et temporal (flèche).
L'engagement cérébral va induire la compression de certaines structures cérébrales comme la moelle allongée, par exemple en cas d'engagement amygdalien, ce qui peut rapidement aboutir au décès du patient.
Ischémie cérébrale
L'ischémie cérébrale est induite par une occlusion artérielle, le plus souvent du fait de la présence d'un caillot au sein d'une artère (voir chapitre 20). Elle se traduit par un œdème cytotoxique aboutissant à la nécrose du parenchyme cérébral au sein du territoire vascularisé par cette artère occluse. Cet œdème est typiquement bien limité à un territoire artériel et atteint plutôt la substance grise dans les premières heures. En TDM, cela se traduit par une hypodensité très discrète à la phase précoce, puis de plus en plus marquée (figure 23.25).
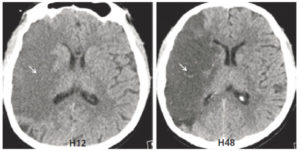
TDM cérébrale sans injection : hypodensité frontale droite (flèche blanche) correspondant à un AVC ischémique dans le territoire de l'artère cérébrale moyenne (ou sylvien) à 12 et à 48 heures du début des symptômes neurologiques.
L'IRM est plus sensible que la TDM à la phase précoce. Cela est particulièrement important car il existe maintenant des traitements de reperfusion de l'AVC ischémique de moins de 6 heures :
- l'injection intraveineuse d'un fibrinolytique, qui permet de détruire le caillot ;
- la thrombectomie, qui consiste à aspirer le caillot par voie endovasculaire en neuroradiologie interventionnelle.
La séquence IRM essentielle au diagnostic précoce de l'ischémie est la séquence de diffusion (voir chapitre 8) : la zone ischémiée est en hypersignal dès la première demi-heure après l'occlusion artérielle. Sur les autres séquences d'IRM (T2 et FLAIR), l'apparition de l'hypersignal est plus tardive : à partir de 6 heures après le début de l'ischémie (figure 23.26).
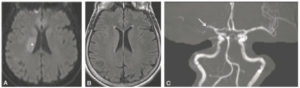
IRM cérébrale en coupes axiales diffusion (A), FLAIR (B) et angio-IRM du cercle artériel du cerveau (C).
Hypersignal en diffusion (croix blanche) correspondant à un AVC ischémique dans le territoire de l'artère cérébrale moyenne droite (ou sylvien droit). Celui-ci n'est pas encore visible en FLAIR, ce qui témoigne du caractère très récent (inférieur à 6 heures). L'angio-IRM montre une occlusion de l'artère cérébrale moyenne droite (flèche).
L'occlusion artérielle peut être mise en évidence par angio-TDM, ou par angio-IRM. Elle se traduit par la non-opacification ou la non-visualisation de l'artère occluse du fait de la présence du caillot (figure 23.26C, figure 23.27).
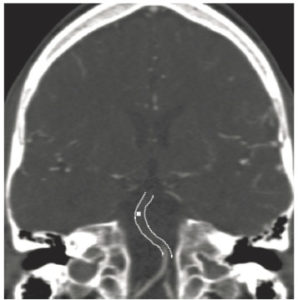
Angio-TDM du cercle artériel du cerveau montrant l'absence de rehaussement de la partie supérieure de l'artère basilaire témoignant d'une occlusion (croix blanche).
Le thrombus est représenté entre les traits en pointillés.
Hémorragie cérébrale
Le sang frais apparaît spontanément hyperdense en TDM, en l'absence de toute injection de produit de contraste (voir figure 23.15 et chapitre 21). Sa densité va ensuite évoluer vers l'hypodensité du fait de la dégradation de l'hémoglobine. Il est important de localiser l'espace dans lequel survient un saignement, en raison de sa valeur étiologique et thérapeutique :
- un hématome extradural est généralement secondaire à un traumatisme crânien avec fracture de la voûte et arrachement d'une structure vasculaire entre la voûte et la dure-mère : il apparaît sous la forme d'une lentille biconvexe hyperdense entre la dure-mère et la voûte osseuse ;
- un hématome sous-dural est généralement secondaire à un traumatisme crânien : il apparaît sous la forme d'un croissant à concavité interne hyperdense entre l'arachnoïde et la dure-mère. Il est généralement plus étendu que l'hématome extradural ;
- une hémorragie sous-arachnoïdienne est généralement secondaire à une rupture d'anévrisme : elle correspond à une hyperdensité entre la pie-mère et l'arachnoïde, dans les citernes de la base du crâne et/ou au fond des sillons corticaux ;
- un hématome intracérébral apparaît sous la forme d'une hyperdensité dans le parenchyme cérébral.
Épilepsie
Lorsqu'un examen d'imagerie est nécessaire, l'IRM est l'examen de référence, car elle permet de rechercher des anomalies responsables de la survenue de crises d'épilepsie : tumeurs, malformations corticales ou vasculaires.
En cas d'épilepsie pharmacorésistante, si un traitement chirurgical est envisagé, on peut réaliser une étude scintigraphique de la perfusion ou du métabolisme.
Celle-ci montre, au niveau de la lésion épileptogène, une hypoperfusion intercritique (en dehors des crises) en TEMP ou en TEP et une hyperperfusion percritique (pendant la crise) en TEMP.
Syndromes démentiels
Dans le cadre de l'évaluation de troubles cognitifs, l'IRM recherche des causes éventuellement curables de démences comme celles décrites ci-dessus (hématome sous-dural, tumeur, AVC), mais permet aussi de montrer les signes directs, mais tardifs, d'une maladie neurodégénérative comme une atrophie des hippocampes dans la maladie d'Alzheimer.
En médecine nucléaire, l'étude de la perfusion cérébrale et du métabolisme glucidique peut mettre en évidence précocement des zones de dysfonctionnement ou de mort neuronale se traduisant par une hypoperfusion ou un hypométabolisme. Les démences ont en général une topographie lésionnelle spécifique selon l'étiologie ; ces examens peuvent donc être utilisés à visée diagnostique et aider au diagnostic différentiel.
Tremblements et mouvements anormaux
L'IRM permet de rechercher des causes aux tremblements et mouvements anormaux (secondaires à des AVC ou lésions tumorales localisés au sein des ganglions de la base). Mais l'IRM, bien que limitée dans la maladie de Parkinson, permet également de rechercher des signes sémiologiques en faveur de certaines maladies neurodégénératives.
Le DatSCAN® et la TEP à la 18F-DOPA peuvent aider au diagnostic différentiel entre syndrome parkinsonien et tremblements essentiels.
Dans un syndrome parkinsonien, il existe une dégénérescence nigrostriée avec atteinte du versant présynaptique de la synapse dopaminergique au niveau striatal. Les images du versant présynaptique sont donc précocement anormales : asymétrie avec hypofixation du traceur du côté controlatéral aux signes cliniques (voir figure 23.19B).
Dans un tremblement essentiel, il n'y a pas d'atteinte neurodégénérative sous-jacente et les images du versant présynaptique de la synapse sont normales (voir figure 23.19A).
Perspectives
Les perspectives sont :
- l'utilisation de champs magnétiques de plus en plus élevés en IRM, qui permet d'augmenter la résolution spatiale mais s'accompagne en contrepartie de nombreuses contraintes ;
- l'utilisation de nouveaux MRP plus spécifiques comme les traceurs de la plaque amyloïde dans la maladie d'Alzheimer ;
- le développement d'appareils hybrides TEP-IRM permettant des acquisitions simultanées.
Essentiel à retenir
- En neuroradiologie, l'IRM est l'examen de première intention dans les affections médicales neurologiques, alors que la TDM est l'examen de première intention en pathologie traumatique.
- La substance blanche apparaît en hypersignal en T1, hyposignal en T2 et FLAIR, alors que la substance grise apparaît en hyposignal en T1 et en hypersignal T2 et FLAIR. Le LCS apparaît en hyposignal T1 et FLAIR et en hypersignal en T2.
- Le sang frais apparaît hyperdense en TDM. Son signal est variable dans le temps en IRM.
- En imagerie métabolique, il existe des MRP spécifiques pour l'exploration de quatre mécanismes physiopathologiques : perfusion cérébrale, métabolisme glucidique, dépôt des plaques amyloïdes, étude de la voie dopaminergique présynaptique.
- En métabolisme cérébral (18F-FDG), la fixation normale est intense, homogène et symétrique sur le parenchyme cortical et sous-cortical. Les régions anormales, où il existe un dysfonctionnement synaptique ou une mort neuronale, sont caractérisées par une fixation diminuée du traceur.
 |
Chapitre suivant |
 |
Retour au sommaire |
